扶正胶囊提取物对环磷酰胺诱导的免疫低下小鼠免疫调节作用研究*
2022-08-27陈汀成旭东胡芳陈婷朱慧唐樑
陈汀,成旭东,胡芳,陈婷,朱慧,唐樑
(南京中医药大学附属苏州市中医医院,苏州 215009)
扶正胶囊是苏州市中医医院自行研发的医院制剂,依据中医“扶正培本”“扶正驱邪”“正气存内,邪不可干”的治疗理论,由本院名老中医何焕荣主任开发,采用生黄芪、西洋参粉和冬虫夏草菌丝粉3味饮片组方而成。方中黄芪味甘、性温,具有补气升阳,固表止汗的功效,中国近代著名中西汇通派医家张锡纯认为黄芪“补气之功最优,故推之为补药之长”。[1]西洋参味甘、性凉,具有补气养阴,清热生津的功效。“对欲用人参,而不受人参之温补者,皆可用其代之。”因此,其与黄芪配伍可以中和黄芪的温补之性,并增强补气的功效。冬虫夏草味甘、性平,具有补肾益肺,止血化痰的功效,3味药共用可以共同增强该方益气补肾的功效。
扶正胶囊作为本院自制制剂在临床应用已十余年,2020年临床应用55 000余盒,具有益气补肾的功效,主要适用于免疫功能低下、疲劳综合征及慢性疾病恢复期等疾病和证候。本院临床研究表明扶正胶囊在用于治疗肺癌癌因病疲乏和配合穴位敷贴治疗稳定期肺肾两虚型慢性阻塞性肺病方面均具有较好的临床疗效[2-3]。
本实验采用环磷酰胺诱导建立小鼠免疫功能低下模型[4-6],通过测定扶正胶囊提取物对小鼠单核细胞吞噬能力、胸腺和脾脏指数、血清中细胞因子肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)、白细胞介素-17(IL-17)含量及脾T淋巴细胞亚群CD3+T淋巴细胞(CD3+)、CD4+T 淋巴细胞(CD4+)与 CD8+T淋巴细胞(CD8+)的分布及比例等多个免疫学评价指标,来考察扶正胶囊提取物对小鼠免疫功能的调节作用,旨在探讨扶正胶囊提取物的免疫调节活性,为该制剂的深入研究开发和免疫机制研究提供参考。
1 材料与方法
1.1 实验动物 SPF清洁级的KM小鼠60只,雄性,体质量(18±2)g,购自上海灵畅生物科技有限公司,质量检测单位为苏州西山生物科技有限公司,动物许可证号SCK(沪)2018-0003。分笼饲养,每组10只,实验前正常进食饮水,适应性喂养5 d。
1.2 药物与试剂 生黄芪(批号:210130,产地:内蒙古)、西洋参粉(批号:200422,产地:加拿大)、虫草被孢菌粉(批号:210324,产地:江苏)均购置苏州市天灵中药饮片有限公司。
环磷酰胺(批号:0E385A),德国 Baxter Oncology Gmbh公司;香菇多糖(批号:B24117,质量分数≥98%),由上海源叶生物科技有限公司提供;小鼠 IL-4、IL-10、IL-17、TNF-α 和 IFN-γ ELISA 试剂盒,购于江苏晶美生物科技有限公司;印度墨汁(批号:0326A21),江苏艾迪生生物科技有限公司;PBS(批号:8120015),ANTI-MO CD3e PE(批号:2172537),ANTI-MO CD4 FITC (批号:2007709),ANTI-MO CD8A APC(批号:2087760),均购置于赛默飞世尔科技(中国)有限公司。
1.3 主要仪器 ME55型分析天平,瑞士梅特勒托利多公司;紫外-可见分光光度计,岛津仪器(苏州)有限公司;KDC-140HR高速冷冻离心机,安徽中科中佳科学仪器有限公司;流式细胞仪,美国BD公司;MQT-60R台式全温振荡培养箱,上海旻泉仪器有限公司;Thermo Multiskan Sky全波长酶标仪,北京昊诺斯科技有限公司。
1.4 实验方法
1.4.1 扶正胶囊提取物的制备 按扶正胶囊处方取适量饮片,按处方生产工艺制备扶正胶囊内容物细粉;根据内容物质量,取10倍量纯化水,煎煮2次,每次1 h,合并2次煎液,浓缩至一定体积,冷藏保存备用。
1.4.2 实验动物的分组及干预方法 将60只SPF级的小鼠进行随机分组,每组10只(组别为空白组、模型组、扶正胶囊提取物低、中、高剂量组以及阳性对照组)。
除了空白组外,模型组、扶正胶囊提取物低、中、高剂量组以及阳性对照组各组小鼠腹腔注射环磷酰胺80 mg/kg,每日1次,连续两天;空白组小鼠按重量腹腔注射相同量0.9%生理盐水。
实验开始的第3天,扶正胶囊提取物低、中、高剂量组小鼠分别灌胃0.75、1.5、3 g(按生药量计算)/kg浓度的扶正胶囊提取物溶液(相当于临床单日用药量的1、2、4倍),阳性对照组灌胃60 mg/kg的香菇多糖溶液,模型组和空白组小鼠灌胃等体积的蒸馏水,每日一次,连续给药7 d;于末次给药隔日,取血,处死,分离肝脏、胸腺和脾脏。
1.4.3 碳粒廓清实验 预先准备好比色管,加入0.1%碳酸钠溶液2 mL,备用;小鼠末次给药24 h后,经尾静脉注射已按1∶5比例稀释的印度墨汁,注射剂量为0.1 mL/10 g;尾静脉注射完成后,分别在注射后的2 min和12 min从眼内眦静脉丛取血20 μL;分别加入含2 mL浓度为0.1%的碳酸钠溶液的比色管中;通过紫外-可见分光光度计,于650 nm波长下测定吸光度(OD)值。
先计算碳粒廓清指数 K,K=(lgOD1-lgOD2)/(t2-t1),其中OD1值和OD2值分别为2min和12min时取出的血液样本所测得的OD值;然后再计算吞噬指数 α,α=K1/3×(体质量/肝脏和脾脏质量)[3]。
1.4.4 脏器指数测定 脱颈椎处死小鼠后,解剖取小鼠脾脏和胸腺,用滤纸吸尽表面血渍,分别称量脏器质量,计算脾脏(胸腺)指数。脾脏(胸腺)指数=脾脏(胸腺)质量(mg)/体质量(mg)。
1.4.5 血清中 IL-4、IL-10、IL-17、TNF-α 和 IFN-γ水平检测 各组小鼠血液样本经高速冷冻离心机离心处理(转速3 000 r/min,离心10 min),分离血清。取血清样本,采用ELISA试剂盒进行检测,依据试剂盒内说明书中的操作步骤逐步操作,测定血清中 IL-4、IL-10、IL-17、TNF-α 和 IFN-γ 的含量。
1.4.6 脾脏淋巴细胞及其亚群分布检测 无菌条件下分离小鼠脾脏,取无菌培养皿,采用组织研磨法分离小鼠脾脏,制备小鼠脾细胞悬液;采用细胞计数板,光学显微镜下计数细胞,调整细胞浓度至1×106个/mL。每组样品分别取细胞悬液 100 μL,分别加入单克隆抗体CD3+-PE、CD4+-FITC、CD8+-APC 2.5 μL 标记细胞,避光保存 30 min,在 250×g、4℃条件下离心5 min,离心后弃去上清液,加入1 mL磷酸盐缓冲溶液(PBS),吹打混匀细胞后按上述条件离心,离心后再次弃去上清液,加入2 mL PBS重悬细胞,采用流式细胞仪检测样本,根据检测结果计算各样本中T细胞中CD3+CD4+与CD3+CD8+细胞亚群比例。
1.4.7 统计学方法 数据采用SPSS 24.0软件统计,数据结果均以均数±标准差(±s)表示。多个组间的数据比较将采用单因素方差分析,两组数据间的比较将采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 实验结果
2.1 扶正胶囊提取物对小鼠脾脏和胸腺指数的影响 与空白组结果相比,模型组的小鼠脾脏指数和胸腺指数均显著降低(P<0.01);与模型组结果相比,香菇多糖阳性对照组的小鼠脾脏指数和胸腺指数均显著升高(P<0.01),扶正胶囊提取物低剂量组的脾脏指数明显升高(P<0.05),中剂量组的脾脏指数呈显著升高(P<0.01),高剂量组的脾脏指数呈显著升高(P<0.01)胸腺指数呈明显升高(P<0.05),表明扶正胶囊提取物可以逆转由环磷酰胺所致的脾脏指数和胸腺指数降低。见表1。
表1 扶正胶囊提取物对小鼠脾脏和胸腺指数的影响(±s)
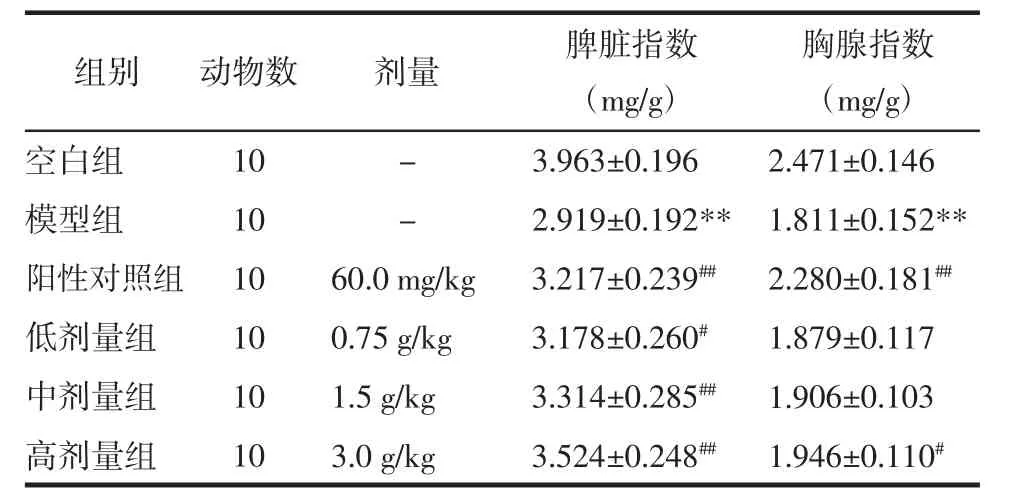
表1 扶正胶囊提取物对小鼠脾脏和胸腺指数的影响(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组阳性对照组低剂量组中剂量组高剂量组动物数1 0 1 0 1 0 1 0 1 0 1 0胸腺指数(m g/g)- 3.9 6 3±0.1 9 6 2.4 7 1±0.1 4 6- 2.9 1 9±0.1 9 2** 1.8 1 1±0.1 5 2**6 0.0 m g/k g 3.2 1 7±0.2 3 9## 2.2 8 0±0.1 8 1##0.7 5 g/k g 3.1 7 8±0.2 6 0# 1.8 7 9±0.1 1 7 1.5 g/k g 3.3 1 4±0.2 8 5## 1.9 0 6±0.1 0 3 3.0 g/k g 3.5 2 4±0.2 4 8## 1.9 4 6±0.1 1 0#剂量 脾脏指数(m g/g)
2.2 扶正胶囊提取物对小鼠单核细胞吞噬能力的影响 与空白组结果相比,模型组小鼠的廓清指数K和吞噬指数α均呈显著性降低(P<0.01);与模型组结果相比,香菇多糖阳性对照组小鼠的廓清指数K和吞噬指数α均呈明显升高(P<0.05),扶正胶囊提取物中、高剂量组小鼠的廓清指数K和吞噬指数α均呈明显升高(P<0.05),且与扶正胶囊提取物的剂量呈正相关,说明扶正胶囊提取物可以明显提高小鼠的单核细胞吞噬功能。见表2。
表2 扶正胶囊提取物对小鼠单核细胞吞噬能力的影响(±s)
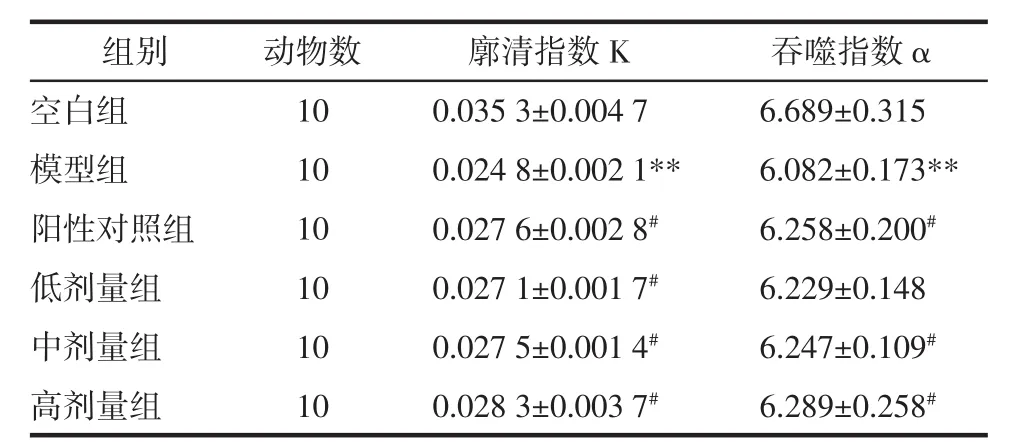
表2 扶正胶囊提取物对小鼠单核细胞吞噬能力的影响(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05。
组别空白组模型组阳性对照组低剂量组中剂量组高剂量组动物数1 0 1 0 1 0 1 0 1 0 1 0廓清指数K 吞噬指数α 0.0 3 5 3±0.0 0 4 7 6.6 8 9±0.3 1 5 0.0 2 4 8±0.0 0 2 1** 6.0 8 2±0.1 7 3**0.0 2 7 6±0.0 0 2 8# 6.2 5 8±0.2 0 0#0.0 2 7 1±0.0 0 1 7# 6.2 2 9±0.1 4 8 0.0 2 7 5±0.0 0 1 4# 6.2 4 7±0.1 0 9#0.0 2 8 3±0.0 0 3 7# 6.2 8 9±0.2 5 8#
2.3 扶正胶囊提取物对血清中IL-4、IL-10、IL-17、TNF-α和IFN-γ水平的影响 与空白组结果相比,模型组血清中的IL-4和IFN-γ水平显著降低(P<0.05,P<0.01)、IL-17和 TNF-α 水平显著增高(P<0.01)。与模型组结果相比,香菇多糖阳性对照组血清中的IL-4与IFN-γ水平明显增高(P<0.05),IL-17和TNF-α水平明显降低(P<0.05);与模型组结果相比,扶正胶囊提取物低、中、高剂量组均能显著提升小鼠血清中的IL-4、IL-10和IFN-γ水平(P<0.01),并显著降低小鼠血清中的IL-17和TNF-α水平(P<0.01),以上数据分析说明扶正胶囊提取物可以促进免疫抑制小鼠体内的IL-4、IL-10和IFN-γ表达,抑制IL-17和TNF-α表达,见表3。
表 3 扶正胶囊提取物对小鼠血清 IL-4、IL-10、IL-17、TNF-α、IFN-γ 水平的影响(±s)pg/mL

表 3 扶正胶囊提取物对小鼠血清 IL-4、IL-10、IL-17、TNF-α、IFN-γ 水平的影响(±s)pg/mL
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.05。
组别空白组模型组阳性对照组低剂量组中剂量组高剂量组动物数6 6 6 6 6 6 I L-4 I L-1 0 I L-1 7 T N F-α I F N-γ 1 6 4.4 7±2 1.8 2 3 8 6.4 1±1 2.4 1 2 3.4 9±0.8 0 1 0 7 2.4 1±4 5.2 1 2 0 9 1.7 8±3 9.8 9 1 5 2.2 0± 2.9 4* 3 8 1.4 2± 4.4 2 3 1.1 2±1.4 5** 1 7 6 0.4 4±1 6.4 9** 1 9 3 5.4 9±1 8.4 1**1 7 5.7 4±2 2.5 2# 3 9 4.5 5±1 0.3 9 1 7.6 2±2.1 1# 1 1 5 9.4 7±3 2.8 1# 2 0 0 1.0 4±1 8.9 1##1 7 1.4 7±1 5.3 5## 5 7 5.4 5± 8.4 9## 2 2.8 7±1.6 6## 1 2 6 1.3 1±3 7.4 7## 2 0 8 6.4 1± 9.8 9##1 7 2.3±1 1.4 4## 4 0 2.4 4± 3.3 6## 2 1.9 1±0.9 9## 1 4 0 1.4 1±3 8.8 8## 2 2 6 5.1 8±1 0.1 3##1 8 8.1 3±1 2.3 2## 4 4 4.8 2± 6.6 4## 1 8.9 1±2.0 1## 1 4 3 5.1 9±1 7.4 1## 2 2 0 6.2 9±4 0.1 1##
2.4 扶正胶囊提取物对脾淋巴细胞CD3+CD4+与CD3+CD8+比值的影响 流式细胞仪检测结果表明,与空白组相比,模型组的CD3+CD4+细胞表达程度和CD3+CD4+/CD3+CD8+的比值均呈显著性降低(P<0.01);与模型组结果相比,阳性对照组的CD3+CD4+细胞表达程度呈显著性升高(P<0.01),扶正胶囊提取物中剂量组的CD3+CD4+细胞表达程度和CD3+CD4+/CD3+CD8+的比值均呈明显升高(P<0.05),扶正胶囊提取物高剂量组的CD3+CD4+细胞表达程度和CD3+CD4+/CD3+CD8+的比值均呈显著性升高(P<0.01),CD3+CD8+细胞表达程度呈明显降低(P<0.05)。结果见表 4、图 1。
表4 扶正胶囊提取物对脾淋巴细胞CD3+CD4+与CD3+CD8+表达的影响(±s)
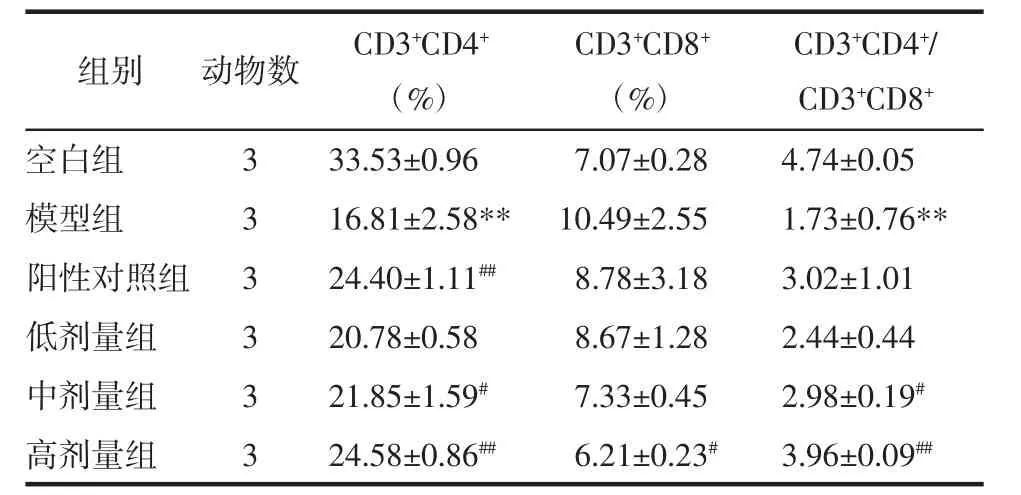
表4 扶正胶囊提取物对脾淋巴细胞CD3+CD4+与CD3+CD8+表达的影响(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
C D 3+C D 4+/C D 3+C D 8+空白组 3 3 3.5 3±0.9 6 7.0 7±0.2 8 4.7 4±0.0 5模型组 3 1 6.8 1±2.5 8** 1 0.4 9±2.5 5 1.7 3±0.7 6**阳性对照组 3 2 4.4 0±1.1 1## 8.7 8±3.1 8 3.0 2±1.0 1低剂量组 3 2 0.7 8±0.5 8 8.6 7±1.2 8 2.4 4±0.4 4中剂量组 3 2 1.8 5±1.5 9# 7.3 3±0.4 5 2.9 8±0.1 9#高剂量组 3 2 4.5 8±0.8 6## 6.2 1±0.2 3# 3.9 6±0.0 9##组别 动物数 C D 3+C D 4+(%)C D 3+C D 8+(%)
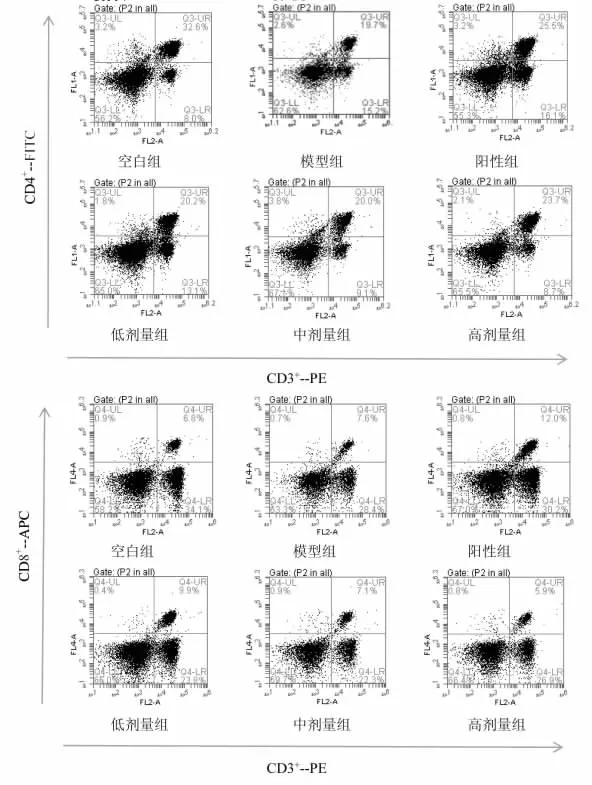
图1 小鼠脾淋巴细胞亚群CD3+CD4+与CD3+CD8+分布结果
3 讨论
在保障机体正常运行的过程中,人体免疫系统有重要地位。人体免疫系统无时无刻在保护着机体,抵御着真菌病毒等微生物侵入机体。当机体的免疫功能处于正常状态时,可以抵御外界病原的入侵,预防疾病的发生,而当人体的免疫功能降低到不足以阻止病原入侵时,就容易患上各种疾病[7]。随着人们对免疫相关的研究成果愈加重视,免疫功能相关的补益产品在改善人们生活质量方面就发挥着越来越重要的角色。中医药在调动内在抗病能力与调节机体的免疫力方面有着色彩分明的特色,苏州中医医院自行研发的中成药扶正胶囊,由名老中医何焕荣主任开发,采用黄芪、西洋参和冬虫夏草菌丝体共同组方而成,具有益气补肾的作用,适用与免疫功能低下、疲劳综合症及慢性疾病恢复期等疾病的治疗,是一款很好的免疫调节类医院中药制剂。
环磷酰胺作为一种常见的免疫抑制剂,它可以通过杀伤免疫细胞,从而影响机体免疫调节的各个阶段而起到免疫抑制作用[8];可通过腹腔注射或肌肉注射环磷酰胺,来建立动物免疫抑制模型。本实验采用环磷酰胺建立小鼠模型后,与空白组相比,发现模型组小鼠的脾脏指数和胸腺指数明显降低,小鼠单核细胞的吞噬功能显著降低,血清中IL-17和TNF-α水平升高、IL-4和IFN-γ水平显著降低,脾淋巴细胞亚群CD3+CD4+/CD3+CD8+的比值显著降低,实验结果与相关研究报道一致[9-12],说明本实验造模成功。T淋巴细胞亚群是评价抗肿瘤免疫的重要指标。T淋巴细胞(CD3+)主要分为CD3+CD4+和CD3+CD8+亚群。CD3+CD4+T淋巴细胞的增加和CD3+CD4+/CD3+CD8+的比例增加表明T淋巴细胞介导的抗肿瘤免疫水平增强[13]。
扶正胶囊由生黄芪、西洋参、虫草菌丝粉3味饮片组成,实验研究表明这三味饮片中的多种成分具均具有免疫调节作用,如黄芪中的黄芪甲苷[14]和黄芪多糖[15],西洋参中的皂苷类成分[16]和西洋参多糖[17],虫草菌丝中的虫草素[18]和虫草多糖[19],同时该类饮片联合使用较单独使用具有更好的免疫调节作用[20]。本研究结果表明:扶正胶囊提取物可以逆转由环磷酰胺导致的胸腺指数和脾脏指数降低,提高免疫抑制小鼠的单核细胞吞噬功能,促进免疫抑制小鼠血清中IL-4、IL-10和IFN-γ因子表达水平,抑制IL-17和TNF-α的表达水平,提升免疫抑制小鼠脾淋巴细胞亚群CD3+CD4+细胞的表达程度和CD3+CD4+/CD3+CD8+的比值。说明扶正胶囊提取物可以促进机体免疫器官的恢复,调节机体免疫相关功能和指标,从而实现增强机体免疫功能的作用。与阳性对照组对照,扶正胶囊提取物的免疫调节作用较好,具有良好的开发价值,通过本研究为该制剂的深入开发提供了一定的实验依据。
