毛酸浆内酯诱导人乳腺癌MCF-7细胞凋亡的机制研究*
2022-08-27余雅琴何昕雅张强康宁
余雅琴,何昕雅,张强,康宁
(天津中医药大学中西医结合学院,天津 301617)
乳腺癌是女性最常见的恶性肿瘤,其发病率与病死率呈现逐年上升的趋势[1]。目前,常用的化学治疗药物因存在毒副作用大等问题而限制其在临床上广泛使用[2-3]。因此,急需开发高效低毒治疗乳腺癌的新型药物。
乳腺癌发病病机复杂,郭艳静等认为痰浊、热毒等邪气盛实为乳腺癌发病的主要原因;刘玲琳等提出“痰毒瘀结”的病机学说,认为“痰毒瘀结、癌毒内生”是乳腺癌发生发展的核心病机。由此可见,热毒、痰浊是乳腺癌发生的重要原因[4]。“热者寒之”“结者散之”的清热解毒散结法是乳腺癌中医治疗的基本法则之一。研究表明清热解毒类中药活性成分,如苦参碱、小檗碱、冬凌草甲素等[5],均具有良好的抗乳腺癌效果。
肿瘤的发生主要是因细胞死亡失控导致的细胞无限增殖,而细胞凋亡又称为Ⅰ型程序性细胞死亡,大量研究显示抑制凋亡可显著促进肿瘤进展[6],因此,诱导肿瘤细胞凋亡是当前治疗肿瘤的重要方法之一,也是筛选抗癌药物的重要手段。近年来,相关研究发现中药活性成分能够高效地诱导肿瘤细胞凋亡[7],这不仅为肿瘤的治疗提供了新的思路,同时也为中药的开发利用拓展了新的方向。毛酸浆(Physalis pubescens L.)又名黄菇娘,为茄科酸浆属草本植物,可药食两用,性味酸平,归肺经,其性寒凉,有清热解毒、化痰利咽之功效[8]。现代药理学研究表明毛酸浆具有抗肿瘤、抗氧化及抗炎等多种活性[9-10],毛酸浆内酯(PPB)是从毛酸浆中分离提取的一种主要的睡茄内酯类化合物。据报道,PPB具有显著抑制肾癌及肝癌增殖的作用[11-12]。本课题组前期研究也发现PPB可以明显抑制乳腺癌细胞增殖,但其抗乳腺癌的相关分子机制尚不明确。本研究将首次考察PPB对人乳腺癌MCF-7细胞的生长抑制作用及相关机制,为PPB应用于乳腺癌治疗提供理论基础及实验依据。
1 材料方法
1.1 细胞和试剂 人乳腺癌MCF-7细胞购于中国科学院典型培养物保藏委员会细胞库;新鲜AB型人血小板白膜层(100 mL)购于天津市血液中心;PPB由本课题组制备,具体制备方法详见参考文献[13],其为白色粉末状固体,经高效液相色谱(HPLC)鉴定纯度≥96%,分子结构如图1所示。PPB用二甲基亚砜(DMSO)在无菌环境中溶解,于-20℃储存。药品使用前,用RPMI-1640培养基稀释至所需浓度,保证DMSO的终浓度小于1‰;RPMI-1640培养基(美国Gibco公司,31800022);胎牛血清(以色列 BI公司,货号:04-001-1ACS);青链霉素混合液(P1400)、MTT噻唑蓝(M8180)及BCA蛋白试剂测定盒(PC0020)均购于索莱宝生物科技有限公司;甲紫溶液(保定市金钟制药有限公司,H13020953);抗-FADD抗体(货号:sc-271748,玻利维亚Santa Cruz公司);抗-Bax抗体(货号:50599-2)、抗-Bcl-2抗体(货号:12789-1)、抗-PARP抗体(货号:13371-1-AP)、抗-Caspase-7 抗体(货号:27155-1-AP)、抗-Caspase-8抗体(货号:10380-1-AP)及抗-Caspase-9抗体(货号:13423-1-AP)均于中国Protein Tech公司;抗-β-actin抗体(货号:TA-09,中国 ZSGB-bio公司);二抗辣根酶标记山羊抗鼠IgG(货号:bs-0296G-Bio)及山羊抗兔 IgG(货号:bs-0295G-Bio)购自北京博奥森生物技术有限公司。
1.2 仪器 倒置相差显微镜(Leica公司,DMI1),酶标仪(Bio Tek公司,SN 254962),全自动化学发光分析系统(Tanon,5 200),电泳仪及转膜仪(Bio-Rad Laboratories,1658033),超净工作台(苏净集团安泰公司,SW-CJ-2F),台式离心机(Eppendorf,5810R),CO2恒温培养箱(Heal Force,HF90)。
1.3 细胞培养 人乳腺癌MCF-7细胞用含有10%胎牛血清、100 U/mL青霉素及10 μg/mL链霉素的RPMI-1640培养基,并置于 37℃、5% CO2、饱和湿度的条件下培养。待细胞生长融合率达≥85%时以1∶3的传代比例进行传代培养。
1.4 MTT实验 取稳定对数生长期的MCF-7细胞,以3.0×104个/mL的细胞浓度均匀接种于96孔培养板中,每孔100 μL。培养箱培养24 h后,弃去孔内原有培养基,每孔加入 0、4、8、16、32、64 μmol/L PPB 100 μL,抑制剂作用时预处理1 h,每组至少有3个复孔。加药完毕后,继续孵育培养至不同时间后,弃去孔内液体,每孔于避光条件下加入5 mg/mL MTT 100 μL,继续孵育 2.5 h,最后弃去 MTT,每孔加入DMSO 150 μL,用酶标仪在490 nm波长下,测定每孔吸光度(A值),并按以下公式计算抑制率:
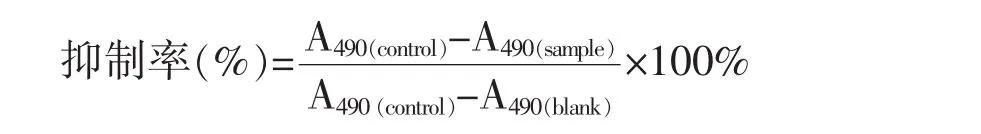
1.5 人外周血单核细胞(hPBMC)的分离制备 无菌环境下分装AB型人血小板白膜层,每管约10mL,加入PBS进行洗涤,以2 000 rpm离心10 min,离心半径为18 cm,总共洗涤3次。离心所得细胞用含2%人AB型血清的RPMI-1640培养基重悬,以2.0×106个/孔接种于96孔U型细胞培养板,放入恒温培养箱中培养,3 h 后弃去上清液,分别加入 1、2、4、8、16、32μmol/LPPB100μL,培养24h及48h后,用MTT法测定细胞抑制率。
1.6 结晶紫染色法检测细胞的克隆形成能力 将对数生长期的细胞以1.0×103个/孔接种于6孔板中,每孔含2 mL培养基,将6孔板置于培养箱中培养,24 h 后加药组每孔加入 0、4、8 及 16 μmol/L PPB 2 mL,药物作用48 h后更换为完全培养基,且每过48 h换液1次,直至培养7 d,最终使单个细胞增殖6次以上,单个细胞形成克隆细胞数量至少为50个。染色前用90%乙醇固定10 min后弃去,用PBS清洗3次,并加入0.1%的结晶紫溶液染色10 min后,继续清洗4次,待孔内干燥后观察PPB对克隆形成的影响,拍照记录克隆形成的形态变化并统计克隆形成的数量。
1.7 Western Blot法 取对数生长期的细胞以15.0×103个/孔接种于6孔板中,PPB处理细胞48 h后分别收集上清液并消化、收集细胞,加入100 μL RIPA裂解,用BCA蛋白浓度测定试剂盒检测样品的蛋白浓度。依据蛋白浓度在相应样品中加入对应5×上样缓冲液,沸水浴使蛋白变性,待样品降至常温后将其储存于-20℃保存。实验时,经过电泳、转模及封闭等处理,使用相关一抗4℃孵育过夜后用辣根过氧化物酶标记的相应二抗常温孵育1 h,洗条带时用TBST漂洗10 min,重复3次。结束上述操作后,最后条带放入ECL化学发光显影仪显影曝光。实验所得条带,用Tanon Gel Imaging System进行定量分析。
1.8 统计学分析 实验结果采用SPSS 20.0统计软件进行单因素方差分析(ANOVA)。所有实验都至少重复3次。统计数据均以均值±标准差(±s)表示。P<0.05时认为统计学差异分析有显著意义。
2 结果
2.1 PPB对人乳腺癌MCF-7细胞及正常人外周血单核细胞(hPBMC)的生长抑制作用 结果如图2所示,PPB呈时间和剂量依赖性抑制MCF-7细胞增殖,其中48 h时的半数抑制浓度(IC50)为11.24±2.84 μmol/L。克隆形成实验结果如图3所示,PPB以剂量依赖性方式抑制MCF-7细胞的克隆形成能力,且 8、16 μmol/L PPB 组与对照组(0 μmol/L)相比,差异有统计学意义(P<0.05)。此外,PPB对hPBMC 无明显细胞毒性(图 4),24 h IC50为(252.34±126.24)μmol/L,48 h IC50为(92.93 ± 35.93)μmol/L。综上,PPB具有抑制人乳腺癌MCF-7细胞生长的作用,而对正常细胞毒性很低。

图1 PPB的分子结构示意图
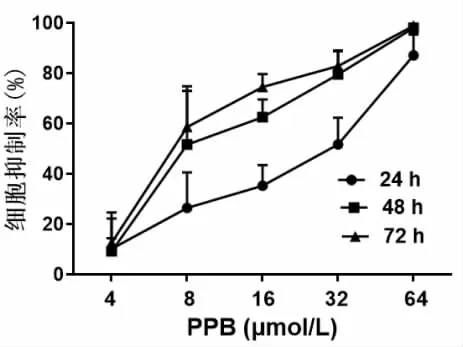
图2 PPB对MCF-7细胞增殖的影响(n=5)

图3 PPB对MCF-7细胞克隆形成的影响(±s,n=4)
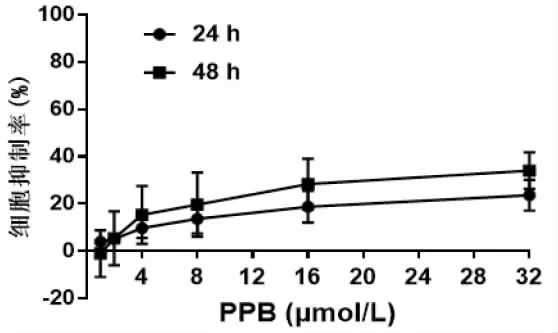
图4 PPB对hPBMC细胞增殖的影响(n=3)
2.2 PPB抑制人乳腺癌MCF-7细胞生长的作用机制
2.2.1 PPB诱导人乳腺癌MCF-7细胞发生凋亡 为了考察PPB是否能诱导人乳腺癌MCF-7细胞发生凋亡,本实验采用Western blot法考察相关凋亡蛋白的变化,结果如图5所示,PARP及Caspase-7的原型形式蛋白表达以PPB剂量依赖性方式显著减少,而其活性形式Cleaved PARP和Cleaved Caspase-7蛋白表达以PPB剂量依赖性方式显著增加。进一步,引入泛Caspase抑制剂Z-VAD-fmk考察Caspase在PPB诱导的MCF-7细胞死亡中的作用,如图6所示,与单加 PPB 组相比,预处理 Z-VAD-fmk(30 μmol/L)可显著抑制MCF-7细胞死亡(P<0.05),提示Caspases家族相关蛋白参与PPB诱导MCF-7细胞凋亡过程。综上结果说明PPB可通过诱导Caspase依赖的细胞凋亡抑制乳腺癌MCF-7细胞生长。
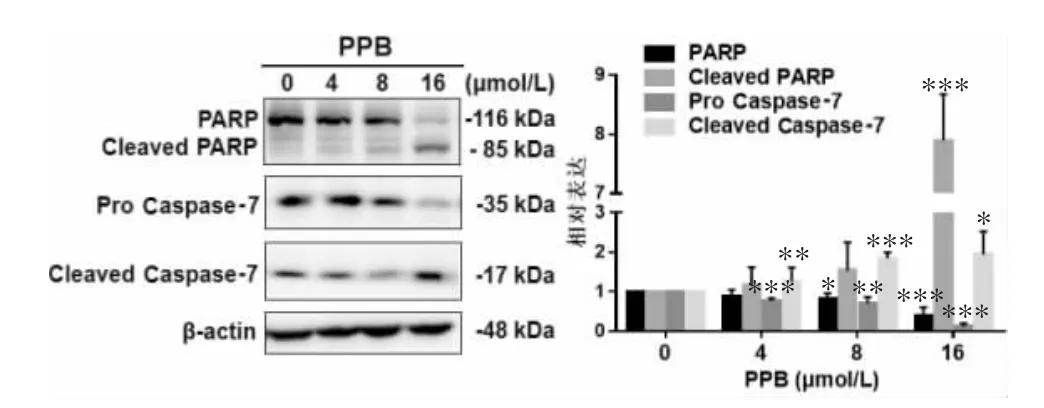
图5 PPB对特征性凋亡蛋白PARP和Caspase-7的影响(±s,n≥3)
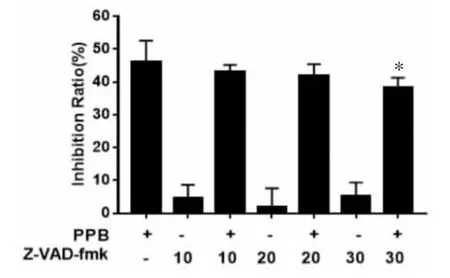
图6 Z-VAD-fmk对PPB诱导MCF-7细胞死亡的影响(±s,n=7)
2.2.2 PPB诱导人乳腺癌MCF-7细胞发生内源性和外源性凋亡 为进一步考察PPB诱导MCF-7细胞发生凋亡的具体途径,本实验采用Western Blot法进一步考察了PPB处理MCF-7细胞后内、外源凋亡途径相关蛋白的变化,如图7所示,PPB剂量依赖性的下调MCF-7细胞中Bcl-2、Caspase-9的表达,并显著上调 Bax、Cleaved Caspase-9、Cytochrome c表达,提示PPB诱导MCF-7细胞发生内源性凋亡;与此同时,外源性凋亡蛋白Caspase-8的原型形式表达量显著减少,而Fas、FADD与Cleaved Caspase-8的表达量均显著上升(图8)。上述结果表明,PPB可诱导MCF-7细胞发生内源性和外源性凋亡。
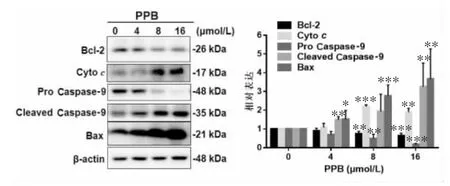
图7 PPB对内源性凋亡蛋白的影响(±s,n≥3)

图8 PPB对外源性凋亡蛋白的影响(±s,n≥3)
3 讨论与结论
乳腺癌严重威胁女性健康,近年来,中医药在乳腺癌方面的研究及应用已取得一定的成果[14],然而中药及其有效成分的开发利用尚不完全,且其潜在的抗癌机制仍未完全阐明,因此需进一步的深入研究。
目前清热解毒类中药的活性成分在抗乳腺癌方面研究广泛[15]。例如黄连的主要有效成分小檗碱可通过抑制周期阻滞、凋亡或自噬等方式诱导乳腺癌细胞死亡[16]。穿心莲主要活性成分穿心莲内酯可促进细胞凋亡及周期阻滞进而促进宫颈癌细胞死亡[17]。此外,蒲公英萜醇还可通过抑制mTOR信号通路诱导MCF-7细胞发生自噬[18]等,这些研究均证实清热解毒类中药的活性成分抗乳腺癌作用显著。本研究中毛酸浆属于清热解毒类中药,可药食两用,PPB则是从毛酸浆中提取的一种睡茄内酯类化合物。已有研究显示PPB对肾癌具有显著的细胞毒性[12]。本研究则发现PPB以时间和剂量依赖性的方式降低人乳腺癌MCF-7细胞的增殖能力,并可显著抑制MCF-7细胞的克隆形成;hPBMC为正常人外周血单核细胞,本研究显示PPB对hPBMC无明显毒性,表明PPB的细胞毒有选择性,因此PPB具有成为高效低毒的新型抗肿瘤药物的潜力,这与之前报道的睡茄内酯类化合物具有开发成为乳腺癌治疗候选药物的报道相一致[19-20]。
促进肿瘤细胞凋亡是多种中药有效成分抗肿瘤的重要方式之一。据报道,睡茄内酯类化合物可以诱导肿瘤细胞凋亡,如Physapruin A可通过抑制乳腺癌细胞增殖,并通过诱导细胞凋亡及引起DNA损伤发挥促进乳腺癌细胞死亡的作用[20];Physapubescin Ⅰ可有效地抑制人胰腺癌SW1990细胞增殖并促进其凋亡[21]。本研究则运用Western Blot法检测了睡茄内酯类化合物PPB处理人乳腺癌MCF-7细胞后PARP及Caspase-7的变化情况。细胞凋亡标志性蛋白PARP为Caspases的切割底物,被激活的Caspase-7能够降解PARP,引发级联反应,参与细胞凋亡的执行过程,因此二者在调节肿瘤细胞发生发展中起至关重要的作用[6,22-23]。结果显示,不同剂量PPB作用于MCF-7细胞后PARP、Caspase-7显著减少,而Cleaved PARP、Cleaved Caspase-7显著增加,提示PPB也可诱导MCF-7细胞发生凋亡[24]。
在内源性凋亡途径中,调节细胞凋亡的关键是Bcl-2(B-cell lymphoma 2)蛋白家族[25],且 Bcl-2 与乳腺癌密切相关[26]。当细胞在特定刺激下,Bax/Bcl-2比例上调,引起线粒体膜通透性的改变,从而促进细胞色素 c(Cytochrome c)从线粒体释放[27],并与凋亡酶激活因子-1(Apaf-1)相互作用,形成凋亡复合体并激活Caspase-9,最终导致细胞发生凋亡[25]。在本研究中,PPB呈剂量依赖性方式诱导MCF-7细胞内源性凋亡蛋白 Bax、Cleaved Caspase-9、Cytochromec显著上调,Bcl-2、原型Caspase-9显著下调,进一步证实了文献报道,即睡茄内酯类化合物可通过促进内源性凋亡途径的发生进而诱导肿瘤细胞死亡[25,28]。
在外源性凋亡途径中,当Fas与配体FasL结合后,Fas三聚化进而与FADD结合,募集Caspase-8前体蛋白形成死亡诱导信号复合体(DISC),DISC中的Caspase-8自我剪切成具有活性的Caspase-8,顺势启动下游的Caspase级联反应,激活凋亡执行通路从而完成凋亡过程[25],研究显示Caspase-8/FADD对细胞增殖有直接影响[26]。有关睡茄内酯类化合物通过外源性凋亡途径促进肿瘤细胞死亡的报道较少。然而,本研究却发现,外源性凋亡相关蛋白Fas、Cleaved Caspase-8及FADD在PPB作用于MCF-7细胞后显著上调,而原型Caspase-8的蛋白表达显著下调,表明睡茄内酯类化合物PPB还可通过诱导MCF-7细胞发生外源性凋亡来发挥抗乳腺癌作用。
综上,PPB可以显著抑制人乳腺癌MCF-7细胞增殖,且PPB对于正常的细胞毒性较小,其抗肿瘤作用机制与同时调控MCF-7细胞发生内、外源性凋亡有关。本课题组将进一步研究PPB抗乳腺癌的其他相关机制,为其抗肿瘤研究及未来的临床应用提供更丰富的实验依据。
