蝴蝶兰PhaSEP3基因的克隆及其在突变体中的表达
2022-08-27许申平蒋素华牛苏燕袁秀云
许申平,张 燕,梁 芳,蒋素华,牛苏燕,崔 波,袁秀云
(郑州师范学院 生物工程研究中心,河南 郑州450044)
花器官发育一直是分子生物学领域研究的热点之一。兰科植物属于单子叶植物中的进化类群,其花器官发育研究已取得一定进展,先后有“兰花密码”(Orchid Code)、“同源性兰花花被”(Homeotic Orchid Tepal, HOT)模型、修正的“ABCDE”模型和“花被编码”(Perianth code)模型等,这些理论的提出进一步揭示了兰科植物花被形成的机制。然而,随着研究的深入,人们发现多基因参与的花发育调控网络仍有许多未解之谜,进一步挖掘和研究MADS-box基因在不同类型花器官中的表达模式和功能作用,将有助于完善和丰富花发育理论。由此,利用花器官突变体研究相关基因的调控功能,不但能进一步理解花发育的分子机制,也有助于新品种的遗传改良。
()是E类MADS-box基因,在拟南芥()中有4个功能冗余的1/2/3/4基因(早期命名2/4/9/3),通过与A类、B类和C类MADS-box基因形成同源或异源四聚体调控花器官各轮组织的发育。迄今为止,E类MADS-box基因已在多种植物如矮牵牛(×)、羽衣甘蓝(var.)、荷花()、杧果()、番茄()、非洲菊()等双子叶植物和玉米()、水稻()、麝香百合()等单子叶植物中被分离。在兰科植物中,E类基因主要集中在石斛属()、蝴蝶兰属(s)、文心兰属()、埃利兰属()等。
Pan等的研究表明,小兰屿蝴蝶兰()有4个基因1-4,在参与花被发育的调控方面功能并不冗余;1和3只在生殖器官中表达,2除了花器官外,在营养器官中也有表达,并在花葶中表达水平最高,而4在营养器官和生殖器官中表达水平均极低,在花器官中,除了4以外,1、2和3在萼片、花瓣、唇瓣和蕊柱中均有表达。基因沉默研究结果表明,不同的基因在调控花分生组织决定性和花器官决定性方面具有不同的功能。在我们前期的研究中,已就蝴蝶兰A类、B类和C类MADS-box基因的转录表达进行了分析,并探讨了B类和C类基因在多种突变体花器官中的调控模式,而E类基因在多种突变体花器官中的表达模式还未见报道。本研究从蝴蝶兰花瓣中克隆了一个花器官发育E类基因3,分析其在不同组织与5种突变体花器官中的表达模式,以期为进一步理解兰科花器官发育的分子调控提供资料。
1 材料与方法
1.1 材料
蝴蝶兰栽培品种火鸟(Sogo Beach)、富乐夕阳(Fuller’s Sunset)、内山姑娘(Ney Shai Gu Niang)、婚宴(Wedding Promenade)和S1024(Red Coral S1024)的正常株和突变株均栽培于郑州师范学院兰花工程中心智能温室,突变株来自组织培养后的体细胞无性系变异。蝴蝶兰正常花器官两侧对称,第一轮具3枚萼片,第二轮有2枚侧瓣和1枚唇瓣,第三轮为蕊柱,是雄蕊和花柱合生形成的结构(图1)。与正常花相比,S1024突变体花器官的2枚侧萼片突变为唇瓣(萼片唇瓣化),内山姑娘突变体花器官蕊柱两侧退化雄蕊的位置分别长出1个瓣状结构(退化雄蕊瓣化),火鸟突变体花器官第2轮侧瓣突变为唇瓣而呈辐射对称(侧瓣唇瓣化),婚宴突变体花器官的萼片和唇瓣正常,侧瓣畸形不完整(侧瓣退化)、富乐夕阳突变体花器官的侧瓣较小,且在侧瓣顶端出现花药(侧瓣雄化)(图2)。
分别取每个品种正常花器官和突变花器官的各轮组织,包括萼片、侧瓣、唇瓣、蕊柱和未授粉子房,取火鸟正常株的营养器官、花器官的各轮组织与未授粉子房、授粉后10 d的子房、授粉后60 d的子房、授粉后90 d的子房壁和胚珠等组织。每份样品分别取3株作为3个生物学重复。取样后迅速将样品用液氮速冻,于-80 ℃冰箱备用。

图1 蝴蝶兰花部结构Fig.1 Floral structure of Phalaenopsis
1.2 方法
1.2.1 RNA提取与反转录
利用天根生化科技(北京)有限公司RNAprep Pure Plant Kit提取各样品的总RNA,具体方法参照说明书进行。总RNA的质量通过1%琼脂糖凝胶电泳成像检测,其浓度采用微量分光光度计测定,总RNA凝胶成像以没有DNA条带和28S条带亮度大约是18S条带的2倍为标准,样品浓度大于500 ng·μL。将火鸟侧瓣的总RNA利用M-MLV(Takara公司)反转录获得cDNA,用于蝴蝶兰E类基因的克隆。所有样品采用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa公司)进行反转录获得cDNA,再用EASY Dilution (Real Time PCR)(TaKaRa公司)稀释8倍后用于实时荧光定量PCR(qRT-PCR)反应。
1.2.2 引物设计
参考NCBI登录的E类基因序列(KF673857、KF673858、KF673859、KF673860等)设计简并引物,用于克隆该基因的保守区域片段,根据保守区域片段设计3′和5′RACE扩增引物inner和outer,将保守区域片段、5′和3′端片段进行序列拼接,并在其开放阅读框(ORF)区域设计引物ORF-F和ORF-R进行扩增、测序和验证,引物见表1。引物合成由上海立菲生物技术有限公司完成。

A,内山姑娘;B,S1024;C,火鸟;D,富乐夕阳;E,婚宴。A, Ney Shai Gu Niang; B, Red Coral S1024; C, Sogo Beach; D, Fuller’s Sunset; E, Wedding Promenade.图2 蝴蝶兰突变体花器官Fig.2 Mutant flower organs of Phalaenopsis

表1 引物信息
1.2.33基因的克隆
利用引物SEP-F、SEP-R与侧瓣的cDNA模板,进行PCR扩增,反应体系20 μL,包括10×buffer 2 μL、上下游引物各0.5 μmol·L、cDNA模板1 000~2 000 ng、dNTPs 600 μmol·L、rDNA聚合酶1 U。PCR扩增程序:95 ℃变性5 min;95 ℃ 45 s,56 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃延伸10 min。PCR扩增产物经过凝胶回收,连接到pMD19-T克隆载体上,转化大肠埃希菌DH5α,经过阳性克隆检测送菌液进行测序。5′和3′RACE采用SMARTer RACE 5′/3′ Kit(Clontech)进行扩增,具体方法参考说明书。
利用ORF-F和ORF-R再次以侧瓣的cDNA为模板进行PCR扩增,扩增体系为20 μL,包括含10×buffer 2 μL、每条引物各0.5 μmol·L、cDNA模板1 000~2 000 ng、dNTPs 600 μmol·L、rDNA聚合酶1 U。PCR扩增程序:95 ℃变性5 min;95 ℃ 45 s,57 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃延伸10 min。扩增的产物同样经过凝胶回收,连接到pMD19-T克隆载体上,转化大肠埃希菌DH5α,鉴定出的阳性克隆送菌液进行测序,对ORF片段进行验证。测序由上海立菲生物技术有限公司完成。
1.2.4 序列分析
基因序列的同源性分析在NCBI(http://blast.ncbi. nlm.nih.gov/Blast)上进行,蛋白结构域在NCBI的蛋白结构域数据库(Conserved Domain Database)中搜索;使用MEGA软件的NJ法构建系统发育树。
1.2.5 表达分析
以qSEP-F、qSEP-R为引物,稀释的样品cDNA为模板,以蝴蝶兰基因(JN185655)为内参基因(引物Act-F和Act-R),采用SYBR Premix ExTMⅡ kit(TaKaRa)进行qRT-PCR反应。反应体系为25 μL,反应条件为:95 ℃ 1 min;95 ℃ 15 s,57 ℃ 15 s,72 ℃ 15 s,40个循环。反应在实时荧光定量PCR仪(Eppendorf,Mastercycler ep realplex)上进行,每个样品3次技术重复。通过溶解曲线分析引物的特异性,并测序验证。3基因的相对表达量按照2法计算,在不同组织中基因的表达量以授粉后60 d子房为参照标准,花器官中基因的表达量以变异花器官萼片为参照标准,表达差异显著性通过SPSS 20.0软件进行分析。
2 结果与分析
2.1 PhaSEP3基因全长cDNA的克隆
利用简并引物SEP-F和SEP-R进行PCR扩增,得到1个430 bp的保守片段(图3-A),3′ RCAE和5′ RACE分别扩增到401 bp(如图3-B)和674 bp(图3-C)的片段,将3个片段进行拼接得到1个1 236 bp的序列,在NCBI进行ORF finder分析发现,该序列包含1个753 bp的开放阅读框(ORF),5′端185 bp,3′端298 bp,在3′端具有26 bp的Poly A。在ORF附近设计引物再次扩增测序,得到预期789 bp的片段(图3-D),对序列进行了验证。通过Blastn分析,该序列与小兰屿蝴蝶兰的9(XM_020737235.1)和3(KF673859.1)均具有99.2%的一致性,与春兰的3(KX347448.1)具有86%的一致性,表明该序列为蝴蝶兰E类基因,将其命名为3,NCBI登录号为MZ436812。
2.2 PhaSEP3基因编码蛋白质的序列
3基因编码250个氨基酸,通过Blastp分析发现,该序列与小兰屿蝴蝶兰的AGL9(XP_020592894.1)和PeSEP3(AHW52538.1)分别有98.8%和98.4%的一致性,与鸽石斛()的DcOSEP1(AAZ95252.1)和春兰()的CgSEP3(APY18453.1)分别具有86.8%和82.8%的一致性。多序列比对分析表明,3编码蛋白质的N端比较保守,具有典型的MADS、I、K和C端功能域,为MADS-box蛋白,并在C端有SEP-Ⅰ和SEP-Ⅱ基序(图4)。

A,保守片段扩增;B,3′ RACE;C,5′ RACE;D,开放读码框扩增。1,保守片段;2,3′ RACE片段;3,5′ RACE片段;4,开放阅读框片段;M,DL2000 分子量标记。A, Conserved region amplification; B, 3′ RACE; C, 5′ RACE; D, ORF amplification. 1, Conserved region fragment; 2, Fragment of 3′ RACE; 3, Fragment of 5′ RACE; 4, Fragment of ORF; M, DL2000 marker.图3 蝴蝶兰PhaSEP3基因扩增Fig.3 Amplification of PhaSEP3 gene in Phalaenopsis
为进一步了解该基因与其他基因的进化关系,选取有代表性的MADS蛋白构建进化树,结果表明,E类蛋白明显分为2个分支:SEP1/3和SEP2/4,在SEP1/3分支中,双子叶植物和单子叶植物分别在单独的分支上,在单子叶植物分支上,兰科植物的SEP蛋白聚在一起,其中,PhaSEP3与兰科植物的SEP1/3聚在一起,与小兰屿蝴蝶兰的AGL9和PeSEP3距离最近(图5)。
2.3 PhaSEP3基因的表达
2.3.13基因的组织表达特性
组织表达特性分析表明,3基因在根和叶中不表达,在花葶中有微量表达;在花器官的各轮均有较高表达,在侧瓣中表达水平最高;在子房发育过程中,该基因的表达水平在授粉后10 d的子房(DAP 10)中升高,在授粉后60 d的子房(DAP 60)中最高,在授粉90 d的胚珠(ovule)中次之,在授粉后90 d的子房壁(ovary wall)中表达水平最低(图6)。可以看出,该基因主要在花器官中表达,参与调控花器官的形态发育,在子房发育启动后调控子房和胚珠的发育。

图4 PhaSEP3基因编码的氨基酸序列与其他植物SEP3蛋白的氨基酸序列比对Fig.4 Multiple sequence alignment of amino acid sequences of PhaSEP3 with other SEP3s from different species

图5 蝴蝶兰PhaSEP3蛋白的系统进化分析Fig.5 Phylogenetic analysis of PhaSEP3 protein in Phalaenopsis
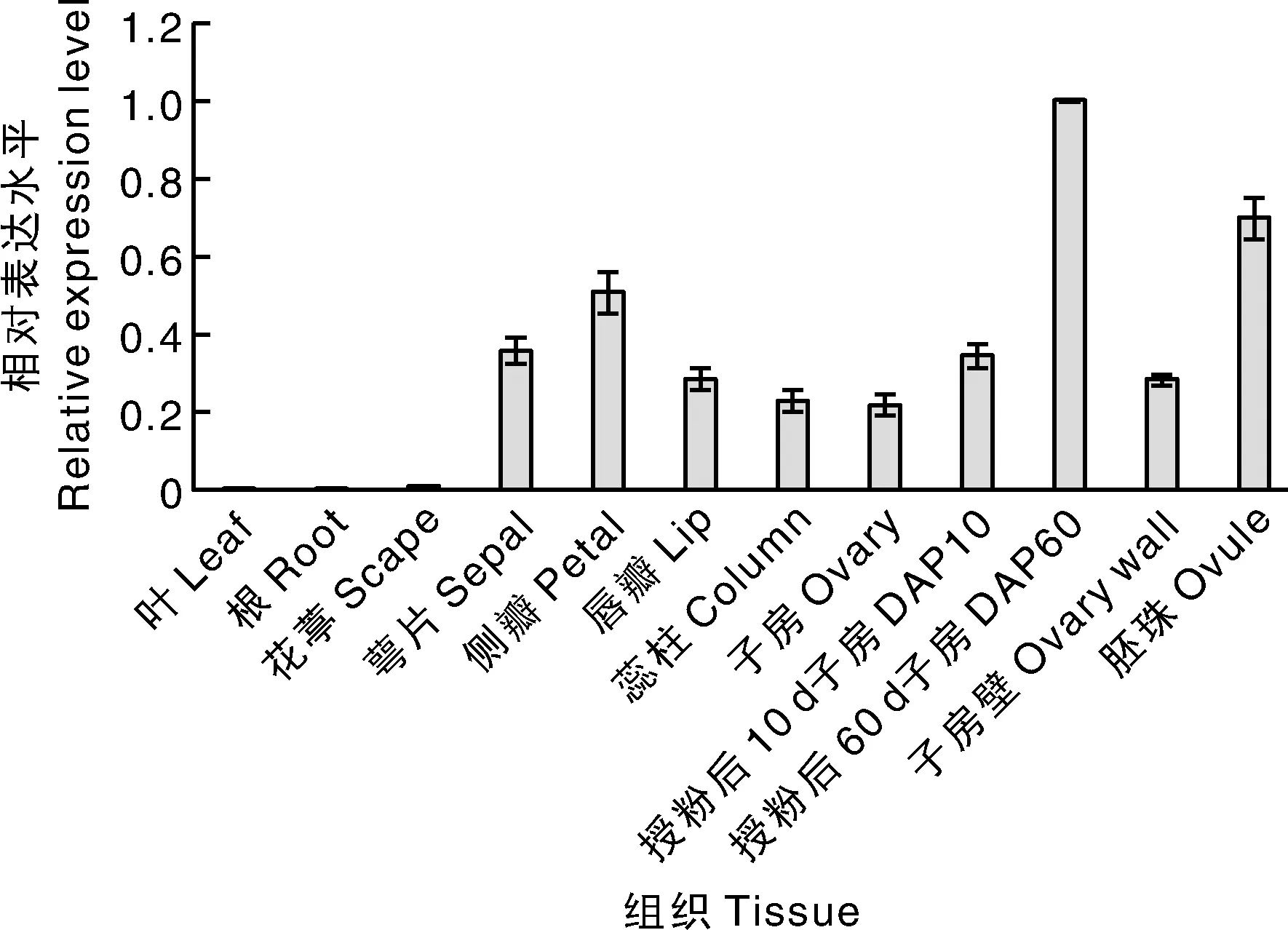
图6 PhaSEP3基因在不同组织与子房发育中的表达Fig.6 Expression of PhaSEP3 in different tissues and developing ovary

A,S1024;B,内山姑娘;C,火鸟;D,婚宴;E,富乐夕阳;*表示差异显著(P<0.05)。A, Red Coral S1024; B, Ney Shai Gu Niang; C, Sogo Beach; D, Wedding Promenade; E, Fuller’s Sunset; * indicated significant difference (P<0.05).图7 PhaSEP3基因在蝴蝶兰花器官突变体中的表达Fig.7 Expression of PhaSEP3 in floral organ mutants of Phalaenopsis
2.3.23基因在突变体花器官中的表达
为进一步研究3基因在花器官发育中的调控功能,利用5种花器官突变体分析该基因在萼片、侧瓣、唇瓣、蕊柱和未授粉子房中的表达。结果表明,在萼片唇瓣化的S1024中,3基因在萼片和唇瓣中的表达水平显著升高,在侧瓣、蕊柱和子房中的表达水平与正常花相比变化不显著(图7-A);在退化雄蕊瓣化的内山姑娘中,3基因在侧瓣、唇瓣和子房中的表达水平显著降低,在蕊柱中的表达水平显著升高,在萼片中的表达水平变化不显著(图7-B);在侧瓣唇瓣化的火鸟中,3基因表达水平在侧瓣和唇瓣中显著升高,其余组织中无明显变化(图7-C);在侧瓣退化的婚宴中,3基因表达水平在侧瓣中明显降低,在蕊柱和子房中明显升高,在萼片和唇瓣中无显著变化(图7-D);在侧瓣雄化的富乐夕阳中,该基因在萼片和侧瓣的表达水平显著升高,在唇瓣、蕊柱和子房中无明显变化(图7-E)。这些结果暗示3基因参与不同花器官突变体形态发育调控。
3 结论与讨论
本研究从蝴蝶兰花瓣中克隆了一个MADS-box基因,序列分析显示,该基因编码的蛋白质具有典型的M、I、K和C结构域,其C-端具有SEPⅠ和SEPⅡ基序,为花器官发育E类基因;系统进化树分析显示,该蛋白质与小兰屿蝴蝶兰的AGL9和PeSEP3具有最近的亲缘关系;表达分析结果表明,该基因在花器官各轮组织中均有表达;在子房发育过程中,其表达水平随着子房发育逐渐升高;在子房发育后期的胚珠中仍有较高水平的表达;在不同形态的花器官突变体组织中,3基因的表达水平发生了不同程度的变化。
诸多研究表明,基因在花分生组织和花器官决定中起着至关重要的作用,基因的突变会导致花器官形态或性质的改变。例如拟南芥123突变体的花器官全部为萼片状结构,1234突变体不能产生花器官。拟南芥3(即9)是分支中最活跃的成员,像一个“胶水”蛋白,能够与所有花器官特性MADS基因相互作用,决定花器官的生长和形态发生。Pan等的研究结果也表明,蝴蝶兰3只在生殖器官中表达,在对花器官发育调控上比其他基因更具有实质性作用,在拟南芥中过表达3显著影响拟南芥开花时间与花器官形态;在发育的子房中,3基因在胚珠中有较高表达,而在种子中未检测到表达。本研究中蝴蝶兰3基因在花器官各轮组织中均有表达,同时在发育的子房和胚珠中也有较高表达,说明该基因在决定花器官发育中具有重要作用,同时对子房的发育特别是胚珠的发育也具有调控功能。
侧瓣唇瓣化突变体是兰科植物研究较多的类型。蝴蝶兰5和7基因是3同源基因,其在侧瓣唇瓣化突变体的侧瓣和唇瓣中表达水平均明显升高;春兰的1、2、3和4的表达水平在该类突变体花器官的不同组织发生了不同的变化,其中3在侧瓣和唇瓣中的表达水平也明显升高。本研究中3基因在该类突变体(火鸟)中的表达也得到了相似的结果。据报道,在该类突变体中,A类(12、)、B类(、)、C类()、D类()和6等基因的表达在花器官中也发生了不同程度的变化,说明A类、B类、C类、D类和E类基因可能直接或间接参与该类突变体的发育调控。进一步研究表明,可能与B类、C类、D类和6相关MADS-box蛋白形成更高阶的复合物,以确定花器官的特性,、、和基因互作可调控兰科植物外轮花被的发育,而和3互作可调控内轮花被和唇瓣的发育。Hsu等提出的“花被编码”模型中,B类和AGL6蛋白可形成L(Lip)型(OAP3-2/OAGL6-2/OPI)和SP(sepal/petal)型(OAP3-1/OAGL6-1/OPI)复合体,决定唇瓣、萼片和侧瓣的发育。本研究火鸟突变体中,3基因在唇瓣中表达升高同时伴随在侧瓣中的表达升高,在S1024突变体中,3基因在唇瓣和萼片中的表达水平升高。由此推测,蝴蝶兰侧萼唇瓣化和侧瓣唇瓣化可能是由E类基因与调控唇瓣发育基因共同作用的结果。
本研究中,3基因在内山姑娘突变体的侧瓣、唇瓣和子房中表达水平均显著下降,在蕊柱中显著上升。我们前期研究的结果表明,在内山姑娘突变体中,基因(B类)在萼片和侧瓣中的表达水平降低,而在唇瓣和蕊柱中的表达水平升高,退化雄蕊瓣化的性状与基因在侧瓣表达水平的降低、在蕊柱表达水平的升高有关。鹭兰()的突变花器官中具有2个叶状侧瓣和带腹蕊柱的唇瓣,分析是因为-1(3基因)发生突变所致,表明-1在蕊柱、唇瓣和侧瓣具有调控功能。非洲菊()3基因GRCD1功能的丧失会导致雄蕊向花瓣转变。本研究中3基因在内山姑娘突变体中,与基因互为消长调控唇瓣的发育,互为促进调控侧瓣和蕊柱的发育;在婚宴突变体中,3基因在其侧瓣中的表达水平显著下降,而在蕊柱和子房中的表达水平显著上升;3基因在富乐夕阳突变体的萼片和侧瓣中表达水平显著升高。已有研究表明,在婚宴突变体中,和1(C类)基因在蕊柱中的表达水平显著升高,推测婚宴的侧瓣退化变异与3基因在侧瓣中的表达水平显著下降有关,而同时B类和C类基因在其他花组织中的表达也发生了变化;在富乐夕阳突变体中,基因在各轮组织中的表达没有显著变化,而1(C类)在蕊柱中的表达水平降低,1在蕊柱中的表达水平升高。由于其他MADS基因的改变如6过表达也会引起花瓣转化为雄蕊,表明富乐夕阳侧瓣雄化的变异可能具有更复杂的调控机制,可能还有未知基因的参与,这些结果也进一步验证了3基因“胶水”蛋白的特性。由此推测,3基因可能与B类和C类基因互作直接参与萼片、侧瓣和唇瓣的发育调控,其表达水平的改变会导致萼片唇瓣化、侧瓣唇瓣化、雄蕊瓣化和侧瓣退化等花器官形态变异,而侧瓣雄化的形态变异可能是其间接参与的结果。
基因家族随着植物的演化在被子植物中具有丰富的多样性,其功能在植物中存在冗余、部分冗余或具有多种功能。前人研究认为,类基因是其他MADS类基因发挥功能的“桥梁”或“黏合剂”,通过蛋白与蛋白互作不但在花分生组织和花器官决定中具有重要作用,也可整合非MADS-box基因如生长信号途径基因调控开花时间,参与果实的成熟、芽的生长和休眠。本研究中蝴蝶兰3基因主要在生殖器官中表达,并调控授粉后子房的发育,在不同突变体的各轮组织中表达水平发生了不同程度的变化,推测该基因与其他花发育基因共同调控了这些突变体形态的变异,而3基因如何介导其他MADS-box基因发挥调控功能,在蝴蝶兰的生长发育过程中是否还有其他功能,还有待于进一步挖掘和研究。
