螺烯的合成研究进展
2022-08-26张宁琪安超娜王宝军
邹 肖,张宁琪,刘 萌,安超娜,王宝军,张 强
(陕西省催化基础与应用重点实验室,陕西理工大学化学与环境科学学院,陕西 汉中 723100)
螺烯又称螺旋烯,是一类由多个芳(杂)环邻位稠合而成的螺旋状化合物。螺烯分为左螺旋、右螺旋2 种构型,右螺旋或者顺时针方向螺旋用P 表示,左螺旋或者逆时针螺旋用M 表示(式1)[1]。
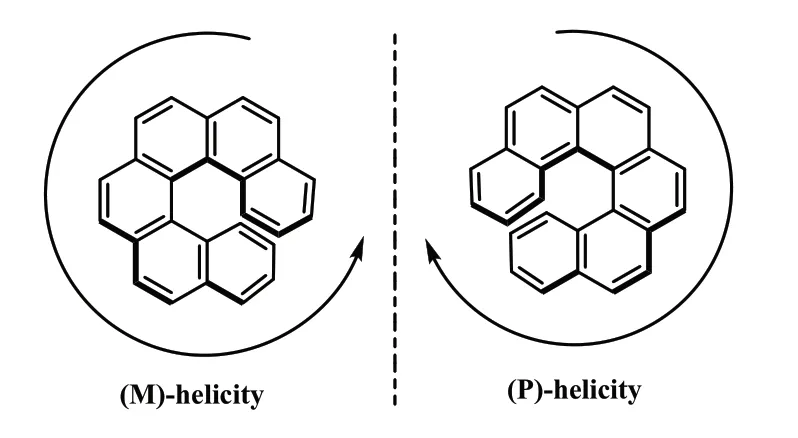
式1 [6]螺烯的2 种不同的螺旋结构Scheme 1 Two different helical configurations for [6]helicene
螺烯可分为2 大类,碳螺烯和杂螺烯。在螺烯结构中含有杂原子(如氧、氮、硼、硫等,分别为氧杂螺烯、氮杂螺烯、硼杂螺烯、硫杂螺烯等),或者共轭骨架中含有五元杂环的是杂螺烯,其余的就是碳螺烯。在螺烯前加前缀或用括号[n]中的数字,表示螺旋主体中芳香环的数量。螺烯是一类具有手性螺旋结构的分子,其特殊的螺旋结构使得螺烯具有高度的共轭性,同时表现出超强的旋光性,因此在化学传感、超分子材料、分子识别、手性催化和不对称合成等领域备受关注[2]。
1 碳螺烯的合成研究
1913 年,[4]螺旋烯的合成被首次报道[3](式2),这是早期合成的一个具有明确扭曲π 体系的碳螺烯。这种合成方法在1918 年和1931 年被再次重复。下一个里程碑式的合成是1918 年报道的[5]螺旋烯(式3)。但合成[5]螺旋烯的操作难度大,总收率较低,纯度也受到质疑,又因为它形成了一个竞争性的线性异构体,使得纯化过程更为复杂。通过对上述合成方法的改进,1933 年,经过Pschorr 环化反应和双脱羧反应,合成了[5]螺旋烯,多年后首次公开了它的X 射线晶体结构。目前,Pschorr 环化的条件已经得到了改善。
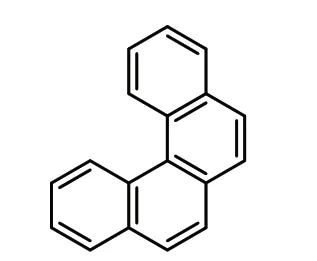
式2 [4]螺烯Scheme 2 [4]helicene
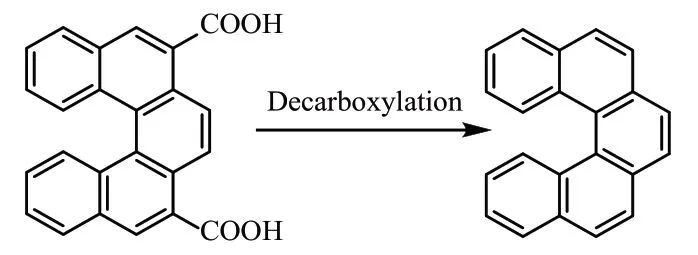
式3 [5]螺烯Scheme 3 [5]helicene
1938 年,Weidlich 课题组[4]通过Diels-Alder反应,制备了第一个全碳[5]螺烯(式4)。以3,3′,4,4′-四氢-1,1′-连二萘为双烯,与顺丁烯二酸酐进行环加成反应,可得到部分氢化的五元环酸酐衍生物,再通过脱酸酐以及脱氢芳构化,最终得到了功能化的全碳[5]螺烯。这个反应为使用一些简单的试剂来大规模合成螺烯开辟了新途径,但仍存在一定的不足,如通过Diels-Alder 反应获得的环加成产物,需要后续的多步反应来实现芳构化,同时该方法难以用于制备更高阶的螺烯。
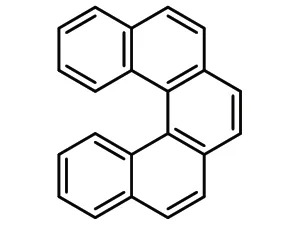
式4 [5]螺烯Scheme 4 [5]helicene
1956 年,Newman 等 人[5-6]首次通过Friedel-Crafts 反应,合成并拆分了[6]螺烯(式5)。该合成方法以1-萘甲醛为原料,通过双芳基取代的二酸分步发生傅-克反应及分子内环化反应,合成了[6]螺烯,这是结构最简单且构型稳定的螺烯单元。
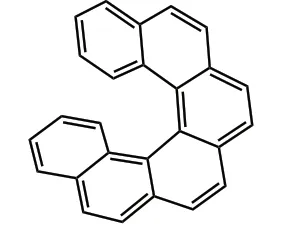
式5 [6]螺烯Scheme 5 [6]helicenes
1967 年,Martin 课题组[7]首次通过光化学反应合成了[7]螺烯(式6)。由Witting 烯化反应可以很容易地制备二苯基乙烯的反应前体,由二苯基乙烯再经光化学反应可制备[7]螺烯。在光照条件下,通常会生成难以分离的异构体,这是导致此方法合成螺烯产率低的重要原因。之后,通过光氧化环合反应合成螺烯分子的研究越来越多,光环化也因此成为了合成螺烯及其衍生物主要的、也是使用最为广泛的方法之一。
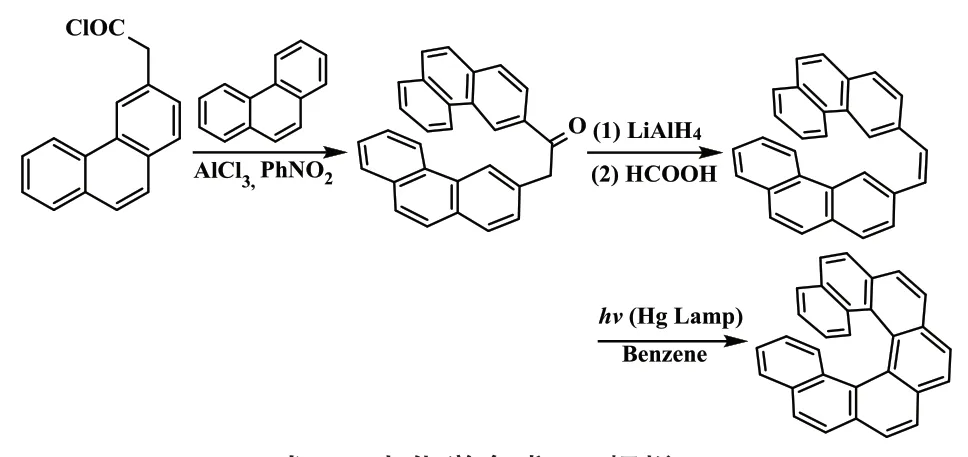
式6 光化学合成[7]螺烯Scheme 6 Photochemical synthesis of [7]helicene
2015 年,Fujita 课题组[8]巧妙地设计了一种含有6 个二苯乙烯衍生物的前体,然后通过光化学合成法,得到了一个极大拉长的[16]螺烯(式7)。该螺烯具有坚固的螺旋刚性,其消旋势垒超过了60 kcal·mol-1。
式7 [16]螺烯Scheme 7 [16]helicene
第一个多重螺旋烯为[X]型双[5]螺旋烯或六苯对二甲苯(式8),共享2 个螺旋之间的中心苯环。1959 年,克拉尔和他的研究人员[9]报道了它的吸收光谱,但没有提供详细的立体化学信息。烷氧基的六苯对二甲苯衍生物更容易由Scholl 反应制备得到。
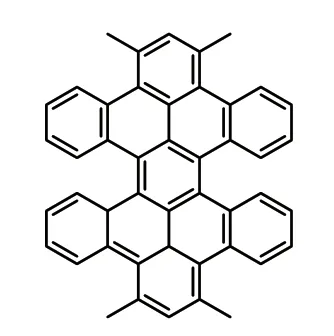
式8 双[5]螺烯Scheme 8 Double [5]helicenes
2016 年,Itami 课题组[10]巧妙地构建了一类联苯基取代的萘,然后通过脱氢环氧化、Scholl 反应、Suzuki-Miyauar 交叉偶联等反应,合成得到了一类双重[6]螺烯(式9),并报道了该螺烯的结构和性能。由于具有2 个螺烯结构,该双重[6]螺烯拥有3 种立体异构体,包括一对扭曲形式[(P,P)和(M,M)]的对映异构体和一个内消旋形式的非对映体。这3 种立体异构体可通过手性高效液相色谱得到分离。其中一对对映异构体的单晶结构呈现层状的堆积,并通过单晶X 射线衍射得到了证实。作者通过理论计算,研究了3 种异构体的动力学行为,结果表明,该双重[6]螺烯拥有高达43.5kcal·mol-1的异构化能垒,其扭曲构型的热稳定性,比内消旋式的构型高0.9kcal·mol-1。2 个对映异构体的绝对构型也通过圆二色光谱和理论计算进行了表征,并通过紫外-可见吸收光谱和荧光光谱,观察了因2 种非对映异构体分子的几何形状差异引起的电子态变化。
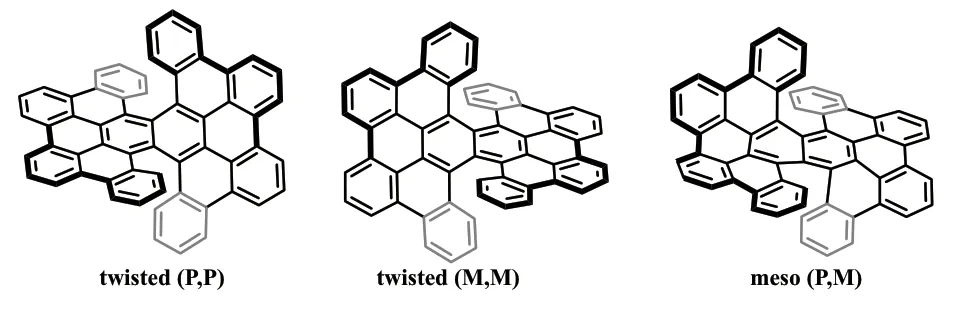
式9 双[6]螺烯Scheme 9 Double [6]helicenes
2017年Klaus Müllen课题组[11]以对叔丁基-2,6-二溴碘苯为前体,通过区域选择性氧化环化脱氢反应,合成了双[7]碳螺烯(D7H)(式10),产率高达74%。采用手性高效液相色谱分离了D7H 的扭曲构象(D7H-1)和反折叠构象(D7H-2),并通过X 射线晶体学明确了其末端苯环重叠的双[7]碳螺烯结构。基于密度泛函理论,计算得到双[7]碳螺烯的异构化势垒约为46.0kcal·mol-1。

式10 双[7]螺烯的合成Scheme 10 The synthesis of double [7]helicene
2018 年,Kenichiro Itami 课题组[12]以碗烯五硼酯为起始原料,通过5 倍的Suzuki 偶联反应以及钯催化的直接芳基化反应,得到了一种新颖的基于碗烯的五重[6]螺烯(式11)。采用手性高效液相色谱对该化合物的对映异构体进行了拆分,并通过圆二色谱对手性信息进行了表征。动力学研究表明,该五重[6]螺烯的异构化能垒为34.2kcal·mol-1,这个数值略低于单体[6]螺烯(36.2kcal·mol-1)的异构化势垒。理论计算(DFT)表明,碗烯骨架可以快速地进行碗对碗的的手性转化,同时5 个[6]螺烯片段可以逐步地进行手性反转。
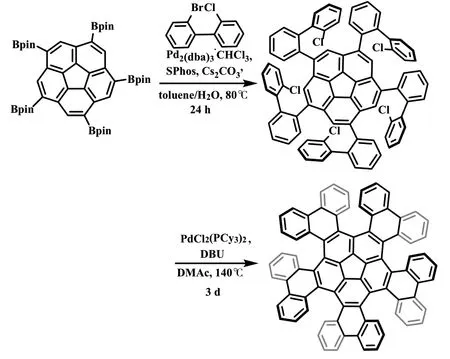
式11 五重[6]螺烯的合成Scheme 11 The synthesis of quintuple [6]helicenes
2 杂螺烯的合成研究
杂螺烯是杂原子取代的螺烯,将杂原子引入到螺旋形多环芳烃中,是制备新型手性材料的一种有效策略。在大多数情况下,杂原子取代的螺烯都展现出优于全碳类螺烯的性能,如高的荧光量子产率以及优异的手性光学性质。
2014 年,Tanaka 课题组[13]通过金催化炔烃的分子内连续芳基化反应,对映选择性地合成了氮杂单[7]螺烯和S 型的氮杂双[7]螺烯(式12)。研究揭示了金催化S 型的氮杂双[7]螺烯的对映选择性合成和圆偏振发光的增强。S 型的氮杂双[7]螺烯的圆偏振发光活性,明显高于氮杂单[7]螺烯,展现了优异的手性光学性质,其荧光不对称因子|glum|高达1.1×10-2。
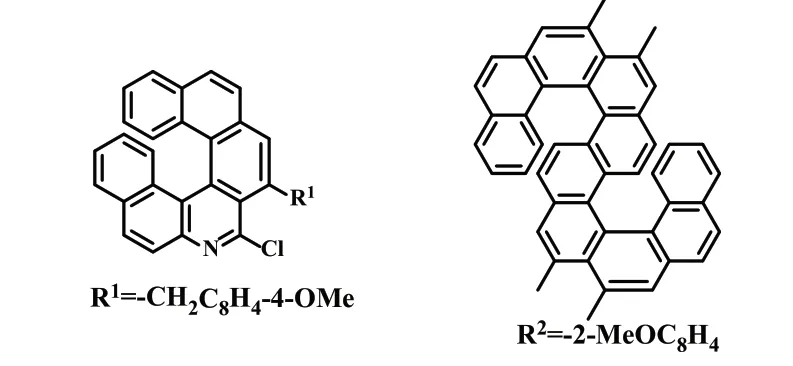
式12 氮杂单[7]螺烯和S 型氮杂双[7]螺烯Scheme 12 Aza[7]helicene and S double [7]helicenes
2016 年,Takuji Hatakeyama 课题组[14]以六溴苯为原料,经HART 反应和去烷基环化反应,两步合成了硼氧杂双[5]螺烯(式13)。该螺烯的荧光量子产率可达68%,手性光学性质研究表明,该化合物具有1.7×10-3的荧光不对称因子。硼氧杂双[5]螺烯展现出了双极性的半导体性能,表明其具有作为光电电子材料的潜力。
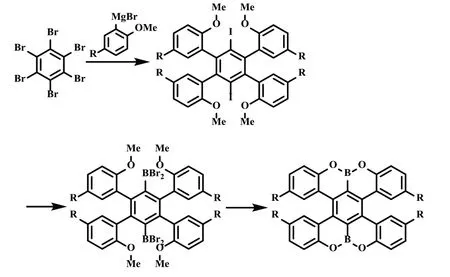
式13 硼氧杂双[5]螺烯的合成Scheme 13 The synthesis of boron and oxygen adopted double [5]helicenes
2016 年,Klaus Müllen 课题组[15]用相似的方法报道了一种硼氧杂双[7]螺烯的合成(式14),单晶X 射线分析展示了一个明显的扭曲结构,其末端的芳香烃在两端重叠。采用手性高效液相色谱对异构体进行了拆分,结构通过单晶 X 射线得到了确认。该硼氧杂双[7]螺烯的异构化能垒可达45.1kcal·mol-1,并通过圆二色谱进行了表征。
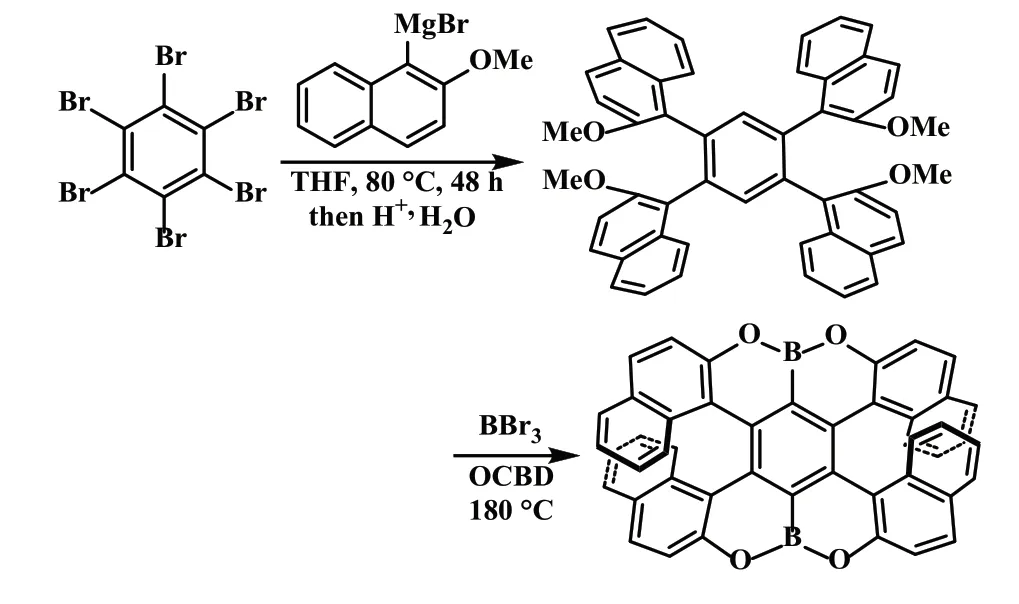
式14 硼氧杂双[7]螺烯的合成Scheme 14 The synthesis of boron and oxygen adopted double [7]helicenes
2021 年,王小野课题组[16]前所未有的B,N 嵌入非键合的双重[7]螺烯(式15),它们表现出优异的折射率。例如在300~700nm 范围内具有很强的折射率活动,在可见光光谱范围内记录的高吸收不对称因子|gabs|高达0.033,以及可调谐的圆极化发光(CPL),从红色到近红外区域(600~800nm),高光致发光量子产率(PLQYs)高达100%等。理论分析表明,高的|gabs|值与非键B 原子和N 原子结合后分子轨道分布的分离有关。新型嵌入的B,N 双杂双重[7]螺烯的合成,为今后高性能捻线材料的开发提供了一条新的思路。
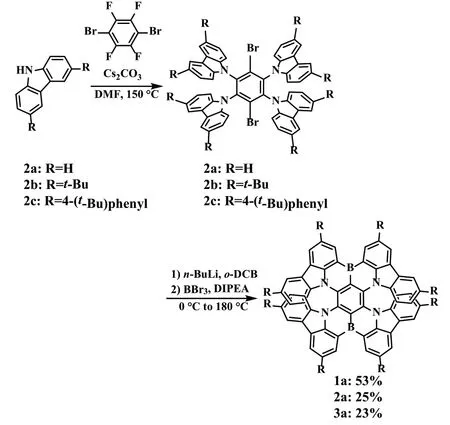
式15 B,N 双杂双重[7]螺烯的合成Scheme 15 The synthesis of B,N bis heterozygous bis[7]spiroene
2021 年,杨宇东课题组[17]报道了三重氧杂[7]螺烯的合成(式16)。以苯并呋喃为原料,2 步合成二苯并呋喃乙炔,再通过连续[2+2+2]环三聚反应和分子内脱氢环化反应,合成了一种结构新颖的三重氧杂[7]螺烯。与以往报道的双重氧杂[7]螺烯相比,该螺烯的发光不对称因子增强,表明螺旋亚基倍增是改善异氧杂螺烯发光不对称因子的一种潜在途径,对设计具有强手性反应的多环烯具有重要意义。
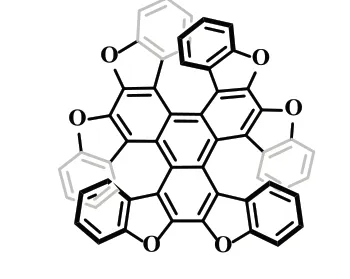
式16 三重氧杂[7]螺烯的合成Scheme 16 The synthesis of Triple Oxa[7]helicene
3 π-扩展螺烯的合成研究
π-扩展的螺烯是通过扩大π 共轭程度得到的螺烯。该类螺烯展现出一些可用于功能材料的性质,如低氧化还原电位半导体材料的带隙控制、可见光和近红外波段的光物理响应、对于分子自组装及利用分子间电子相互作用的半导体材料来说必不可少的π-π 相互作用[18]。
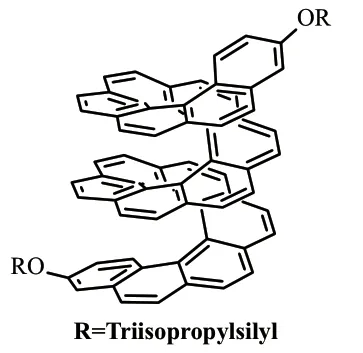
2018 年,Campaña 课题组[19]报道了由2 个鞍形和1 个平面六苯基冠烯(HBC)单元组成的对映纯超螺旋石墨烯纳米带的合成和表征。这是第一个十一碳苯并的[7]螺烯,也是第一个完全扩展的[7]螺烯(式17)。该π-扩展[7]螺烯具有良好的手性光学性质,其吸收和发射的不对称因子均可达2×10-3,同时该化合物还展现出了双光子吸收的特点。
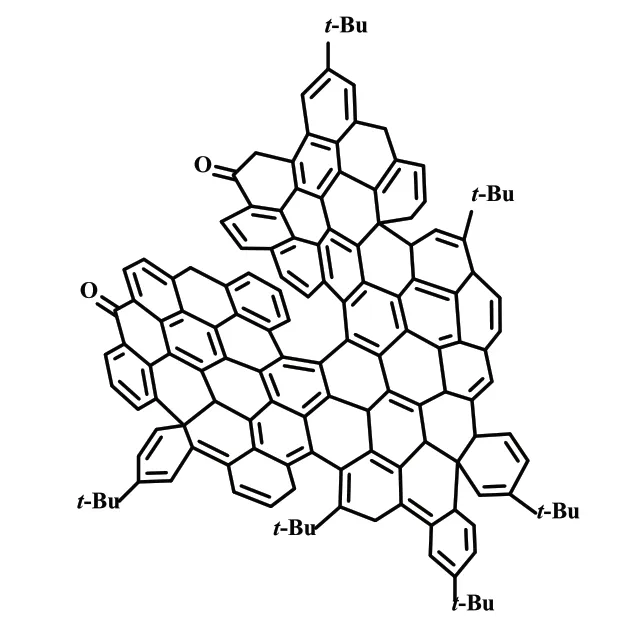
式17 π-扩展[7]螺烯Scheme 17 π-Extended [7]helicene
2018年,Norbret Jux课题组[20]以二苯醚为原料,4 步合成了一种呋喃环稠合2 个HBC 的π-扩展氧杂[7]螺烯(式18)。采用核磁共振波谱、质谱检测、X 射线分析等方法进行了全面的结构表征。对超螺旋烯和HBC 进行了物理化学分析,发现该π-扩展氧杂[7]螺烯展现出高达80%的荧光量子产率,可作为一种潜在的手性发色团。
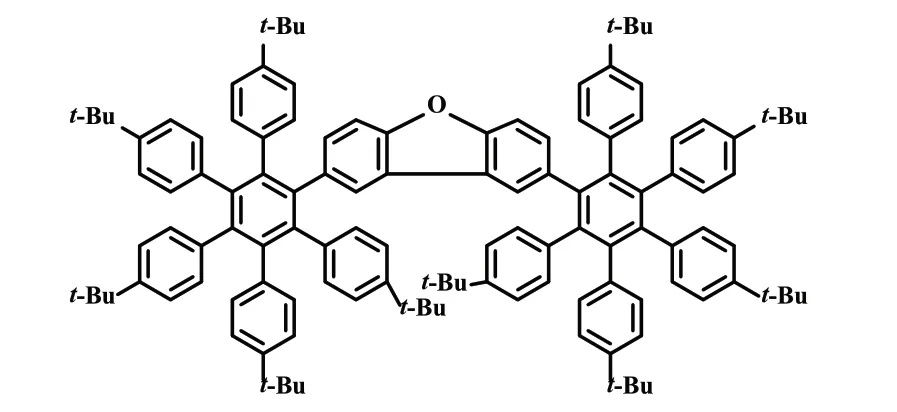
式18 π-扩展氧杂[7]螺烯Scheme 18 π-Extended Oxa[7]helicene
2018 年,Kenji Matsuda 课题组[21]报道了一种含有3 个苝结构单元的π-扩展[7]螺烯(式19)。以烯烃衍生物为原料,通过McMurry 偶联反应、光环化脱氢和芳构化反应,合成了目标化合物,结构通过单晶X 射线衍射得到了确认。单晶结构表明该扩展的螺旋体具有明显的分子内π-π 相互作用。此外,该扩展螺旋体具有较小的HOMO-LUMO 带隙以及优异的手性光学性质,吸收的不对称因子高达1.6×10-2。

式19 π-扩展[7]螺烯Scheme 19 π-Extended [7]helicene
2021 年,Klaus Müllen 课题组[22]通过区域选择性环化脱氢反应,高产率地合成了π-扩展的[7]螺烯和π-扩展[9]螺烯(式20)。X 射线晶体结构明确地证实了其独特的螺旋结构,与原始[7]螺烯和[9]螺烯相比,这些新型的π-扩展螺烯的光物理性能得到了显著改善。
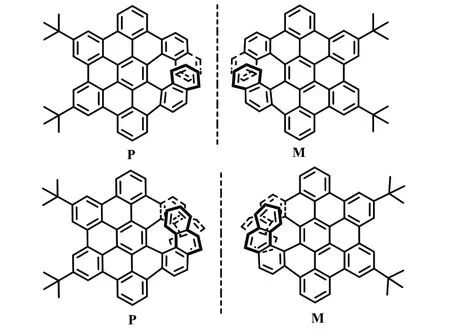
式20 π-扩展[7]螺烯和π-扩展[9]螺烯Scheme 20 π-Extension [7] spiroene and π-Extensio [9] spiroene
4 展望
螺烯是一类由邻位稠合的苯或其他芳香环形成的多环芳香化合物。由于末端芳香烃之间的空间排斥,这些芳香环扭曲形成了螺旋骨架。由于螺旋π 离域,螺烯具有独特的手性光学性质,包括旋光性(OR)、电子圆二色性(ECD)、圆偏振发光(CPL)等。随着高阶螺烯和杂螺烯的成功合成,基于螺烯独特的高旋光度、高圆二色性和圆偏振光性,越来越多针对螺烯应用方面的研究成果相继被报道,螺烯也逐渐被广泛应用在不对称催化、纳米技术、液晶材料、非线性光学、生物化学、自组装以及光探测器等领域[23-25]。
