沉默TLR4基因下调NF-κB表达抑制脑胶质瘤细胞增殖
2022-08-26刘英姿刘亮
刘英姿 刘亮
(河北医科大学第四医院 1神经外科,河北 石家庄 050011;2肿瘤研究所)
脑胶质瘤是严重危害人类健康的恶性肿瘤,是最常见的中枢神经系统肿瘤,发病率及病死率较高〔1,2〕,尽管采取了手术结合放化疗的办法,脑胶质瘤整体治疗效果仍较差〔3〕。随着免疫调控与肿瘤关系研究的深入,脑胶质瘤的免疫治疗逐步得到人们的重视,并成为研究热点。深入研究脑胶质瘤的免疫耐受及免疫调节特点对制定合理的免疫治疗策略尤为重要。Toll样受体(TLRs)是近年来发现的一类重要的模式识别受体(PRR),它可通过识别病原相关的分子模式(PAMP)及某些内源性配体引发信号转导,导致固有免疫的激活和炎性介质的释放,并参与人体多种免疫相关疾病的发生〔4,5〕。在人类已发现10种TLRs,其中TLR4与肿瘤的生物学行为密切相关〔6~8〕,成为当前肿瘤免疫领域一个新的研究热点。本研究拟研究TLR4基因与人脑胶质瘤发生发展关系,为研究人脑胶质瘤免疫调节的分子机制提供实验基础。
1 材料与方法
1.1主要试剂及仪器 All-in-OneTMqPCR Primer、H-TLR4-shRNA(1-3)质粒(GeneCopoeia, 美国);LipofectamineTM2000 (Invintrogen, 美国);高纯度质粒小提中量试剂盒 (天根生化科技有限公司,中国);RNA isolater总RNA extraction reagent、HiScript Ⅱ 1st Strand cDNA Synthesis Kit、qPCR SYBR Green Master mix试剂 (Vazyme,中国);MEM培养基 (Gibco, 美国);EdU细胞增殖检测试剂盒(锐博, 中国);FC-500型流式细胞仪 (Beckman Coulter公司, 美国);PCR仪 (Eppendorf,德国);Mx3000P荧光定量PCR仪 (Agilent, 美国)。
1.2细胞株 U-87MG细胞株购自武汉普诺赛生命科技有限公司,本实验室传代培养。接种细胞于含10%胎牛血清的MEM培养基中(补充青霉素、链霉素各100 U/L),培养器皿置于37℃含5%CO2的细胞培养箱中。
1.3TLR4-shRNA干扰质粒的构建 Gene Copoeia 公司合成干扰质粒(Catalog No.:HSH054754-CU6-a,b,c;CSHCTR001-CU6);Accession No.:NM_003266.3。载体为psi-U6.1,设计3条干扰TLR4基因的表达小发夹RNA(shRNA),3条shRNA目标序列见表1。
1.4shRNA的质粒转染脑胶质瘤U-87MG细胞沉默TLR4基因及转染效率检测 取对数生长期的U-87MG细胞4×105个/孔接种于6孔板中,细胞贴壁后待融合度达到85%~90%时,进行细胞转染,加转染试剂前用无血清及抗生素的MEM,培养液冲洗细胞2遍,每孔加2 ml无胎牛血清及抗生素的MEM培养液,利用LipofectamineTM2000脂质体转染质粒,室温放置20 min后加入6孔板中,6 h后换全培养基,转染48 h后用荧光显微镜观察,转染CU6-a、CU6-b、CU6-c,分别定义为TLR4-sh1组、TLR4-sh2组、TLR4-sh3组,转染CU6定义为阴性对照组。同时设置未转染的空白组及只加脂质体的脂质体组。细胞转染48 h后,收集细胞,磷酸盐缓冲液(PBS)洗涤细胞1次,流式细胞仪检测转染细胞的绿色荧光,以绿色荧光所占检测细胞的百分比代表转染效率,筛选出转染效率最高的质粒作为后续实验用质粒。
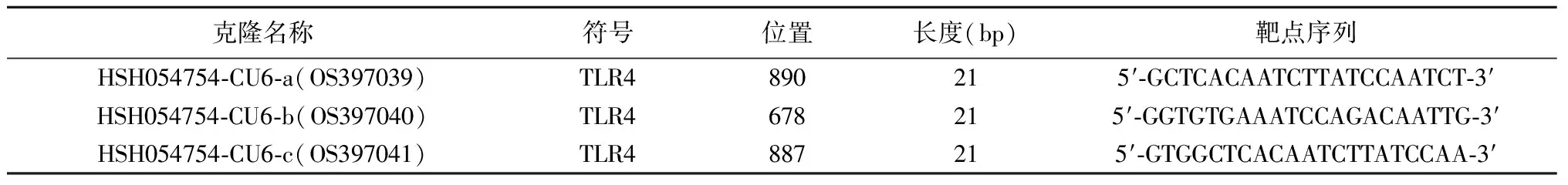
表1 shRNA 目标序列
1.5嘌呤霉素筛选稳定转染细胞 经过实验验证,CU6-b质粒沉默TLR4表达效果最佳,因此后续的siRNA实验选择CU6-b质粒。U-87MG细胞转染CU6-b重组质粒及阴性对照质粒48 h后,将细胞用MEM培养液按1∶10比例稀释,以5×104个/孔细胞加入6孔板中,向6孔板中加入筛选浓度的嘌呤霉素(600 ng/ml)。未转染的U-87MG细胞作为对照组。培养14 d,存活的细胞即为稳定转染的细胞。转染CU6-b的细胞命名为U-87MG-Sh,定义为TLR4-sh组,转染阴性对照质粒的细胞命名为U-87MG-NC,定义为阴性对照组。U-87MG-Sh 及U-87MG-NC细胞在含300 ng/ml嘌呤霉素的全培养基中培养。同时设置未转染的空白组。
1.6qRT-PCR检测U-87MG-Sh、U-87MG-NC及U-87MG细胞中TLR4、核因子(NF)-κB及细胞周期蛋白(Cyclin)D1 mRNA 表达 取生长状态良好处于对数生长期的U-87MG-Sh(TLR4-sh组)、U-87MG-NC(阴性对照组)及U-87MG细胞(空白组),冷PBS洗涤2次,加入1 ml RNA isolater试剂,常规一步法提取总RNA。按照说明书进行反转录为cDNA,以cDNA为模板进行PCR扩增。GAPDH作为内参,进行标准化。按照标准的实时定量PCR流程执行,采用SYBR-Green Ⅰ作为荧光染料,每个样品重复3次。TLR4序列由美国Gene Copoeia公司合成,Catalog number:HQP054754; NF-κB 上游引物5′-CACCCTGACCTTGCCTAT-3′,下游引物5′-CCCAGACTCCACCATTTT-3′;CyclinD1上游引物5′-CTGTCCCACTCCTACGATACGC-3′,下游引物5′-CTTGCCTCAAAGTCCTGCTTG-3′;内参GAPDH上游引物5′-CACTACCGTACCTGACACCA-3′,下游引物5′-ATGTCGTTGTCCCACCACCT-3′。应用2-ΔΔCt法计算TLR4(NF-κB或CyclinD1)mRNA的相对表达量。
1.7流式细胞术检测细胞周期 取生长状态良好处于对数生长期的U-87MG-Sh(TLR4-sh组)、U-87MG-NC(阴性对照组)及U-87MG细胞(空白组),冷PBS洗涤2次,70%乙醇 4℃固定24 h。PBS 洗涤细胞2次,调整细胞浓度为1×107/ml,取100 μl细胞悬液向其中加入1ml碘化丙啶,4℃染色30 min后上流式细胞仪检测,用Muticycle AV分析软件对DNA细胞周期拟合分析。
1.8利用EdU试剂流式细胞术检测细胞增殖 取生长状态良好处于对数生长期的U-87MG-Sh(TLR4-sh组)、U-87MG-NC(阴性对照组)及U-87MG细胞(空白组)接种至6孔板,待细胞贴壁后,更换含有EdU试剂的EdU培养基(50 μmol/L EdU),CO2培养箱内孵育2 h。常规收集细胞,PBS洗涤细胞,350 r/min 5 min离心,去上清,4%多聚甲醛固定20 min, 600 r/min离心 10 min,去上清。2 mg/ml甘氨酸中和5 min,600 r/min离心10 min 去上清,PBS洗涤细胞,600 r/min离心5 min去上清。加入1 ml 0.5%TritonX-100渗透剂室温孵育10 min,600 r/min离心10 min,去上清,PBS清洗1次去上清。加入500 μl 1X Apollo®染色反应液,充分重悬细胞,避光、室温孵育10 min后,600 r/min离心10 min,去上清。3 ml 0.5%TritonX-100渗透剂室温清洗2次,600 r/min离心10 min吸弃上清,1 ml PBS重悬,立即进行流式检测。
1.9统计学分析 采用SPSS21软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1shRNA的质粒转染脑胶质瘤U-87MG细胞沉默TLR4基因 U-87MG细胞转染48 h后,荧光显微镜下观察, TLR4-sh1组、TLR4-sh2组、TLR4-sh3组及阴性对照组大量的细胞中表达绿色荧光见图1,流式细胞术结果显示,TLR4-sh1、TLR4-sh2、TLR4-sh3组转染效率分别为〔(33.66±0.40)%、(46.20±0.31)%、(25.49±0.60)%〕,TLR4-sh2组细胞转染效率最高,后续实验选择CU6-b质粒进行实验。
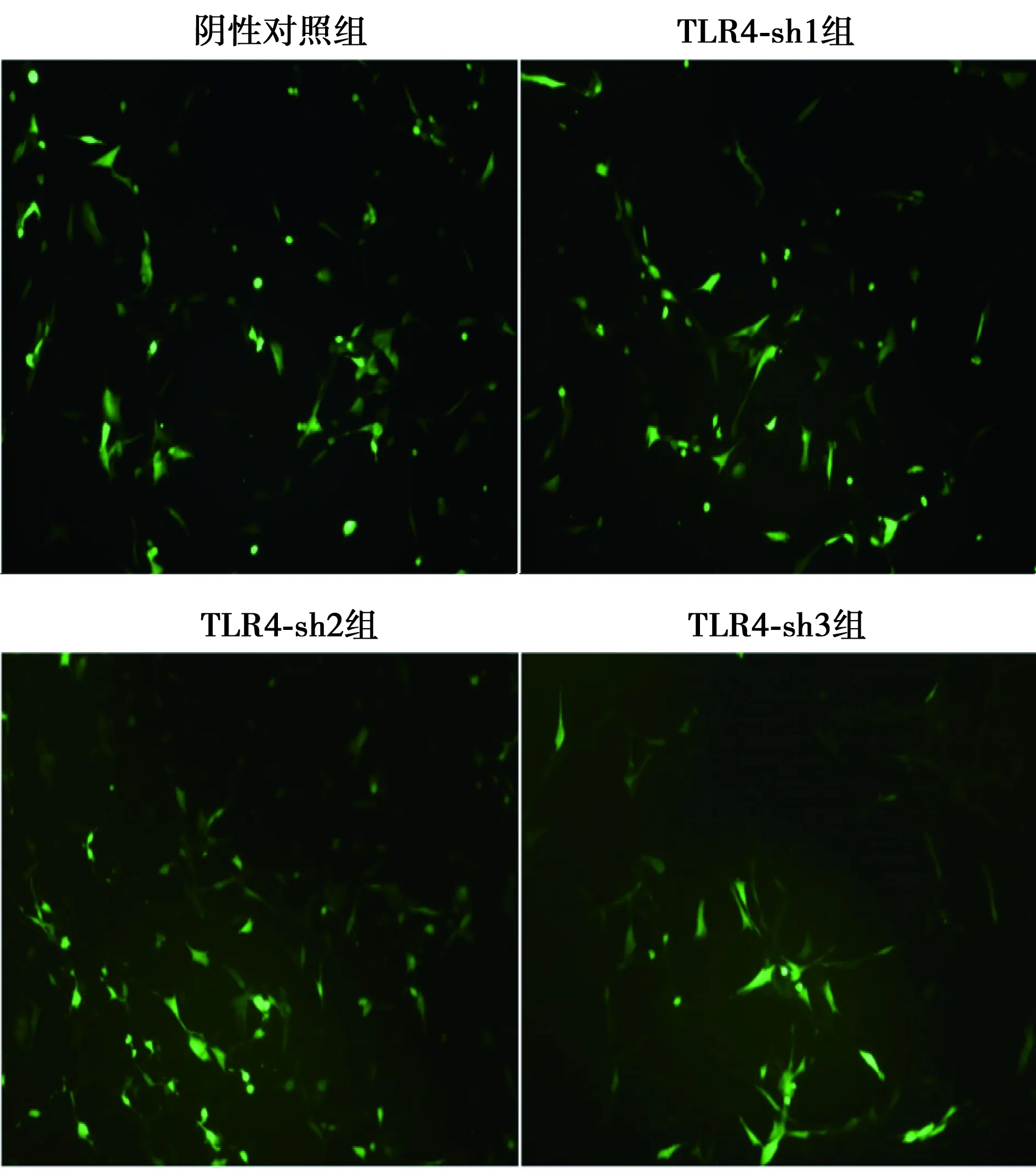
图1 荧光显微镜下观察转染细胞绿色荧光(×100)
2.2U-87MG稳定转染TLR4-sh细胞建立及转染效率、TLR4基因表达检测 600 ng/ml嘌呤霉素筛选细胞14 d后,空白组细胞全部死亡,转染CU6-b质粒及阴性对照质粒的细胞中有大量细胞存活。见图2。存活的细胞即为筛选出来的稳定转染细胞,转染CU6-b质粒的细胞命名为U-87MG-Sh定义为TLR4-sh组,转染NC质粒的细胞命名为U-87MG-NC定义为阴性对照组。TLR4-sh组及阴性对照组的转染率分别为(95.05±0.17)%及(94.75±0.72)%,见图3。TLR4-sh组细胞TLR4 mRNA表达水平(0.028 3±0.001 7)显著低于阴性对照组 (0.163 7±0.023 4)及空白组(0.166 9±0.002 9)细胞中的表达水平(P<0.01)。
2.3流式细胞术检测转染细胞增殖周期及EdU表达水平 TLR4-sh组G0/1期细胞〔(73.37±2.20)%〕显著高于空白组〔(64.70±2.28)%〕及阴性对照组〔(64.89±0.53)%,P<0.01〕;TLR4-sh组细胞增殖指数〔PI,(26.63±2.20)%〕显著低于空白组〔(35.30±2.28)%〕及阴性对照组〔(35.11±0.53)%〕(P<0.01),见图4。TLR4-sh组细胞内EdU表达水平(19.53±1.05)显著低于空白组(26.22±1.95)及阴性对照组(26.27±1.86,P<0.01)。见图5。

图2 经过嘌呤霉素筛选后荧光显微镜下观察转染 细胞绿色荧光(×100)
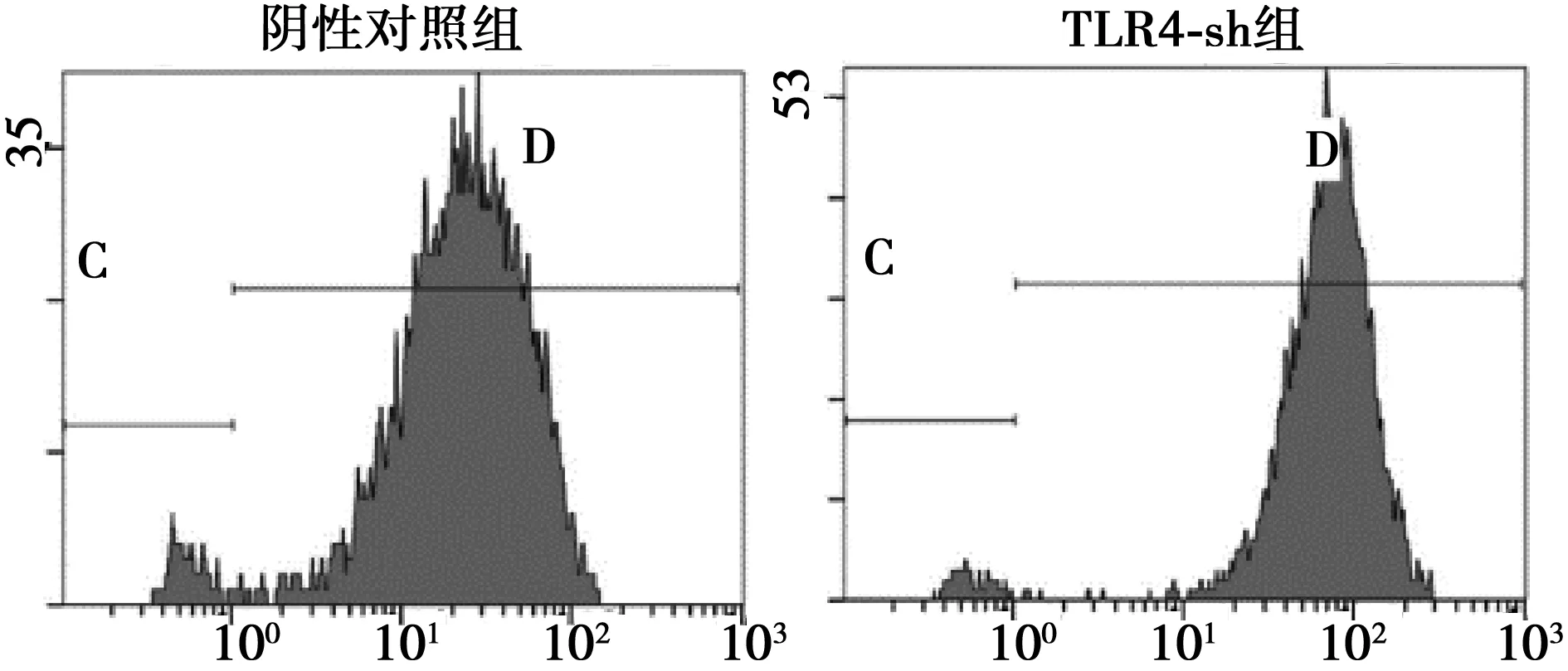
图3 流式细胞术
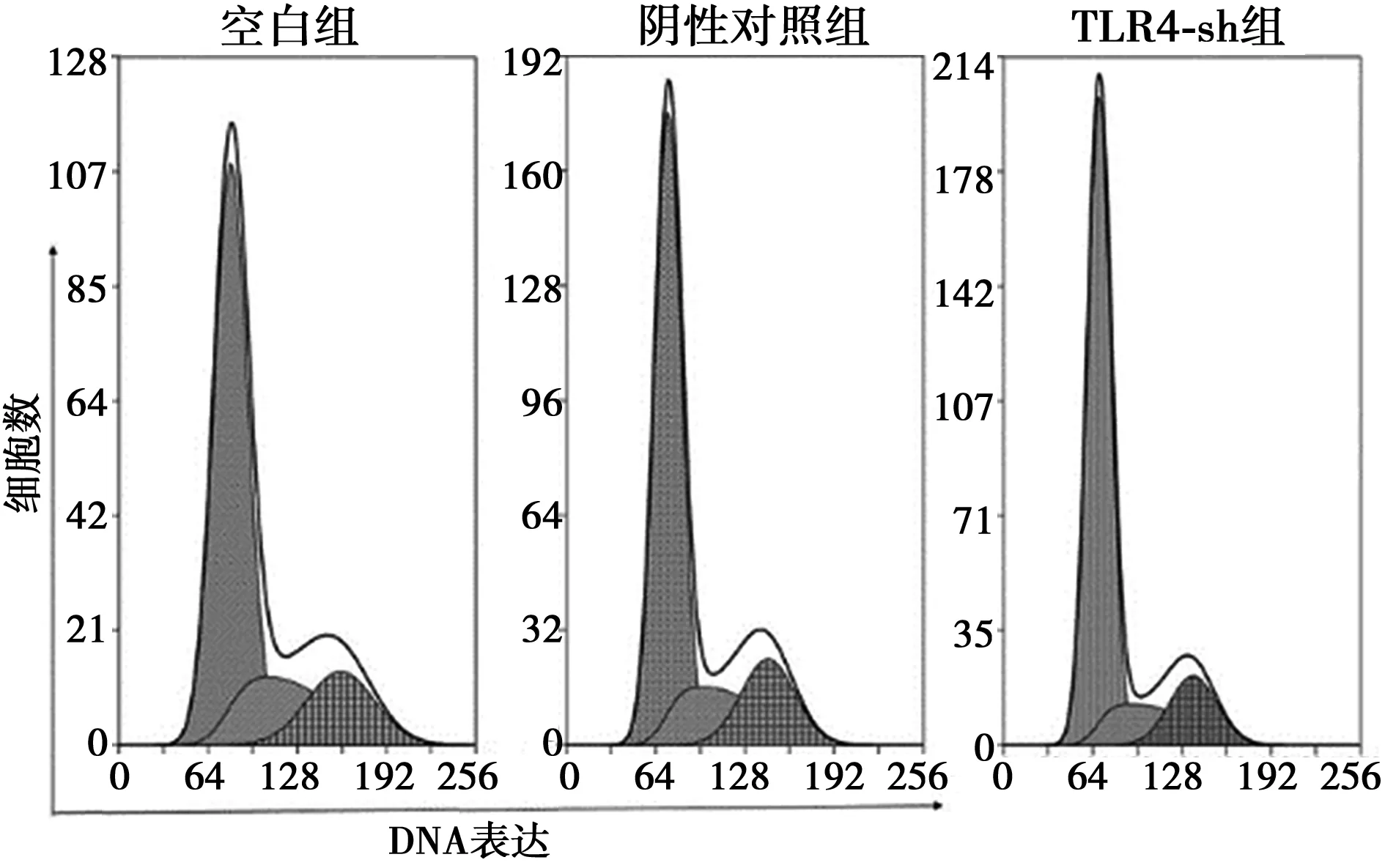
图4 转染细胞增殖周期

图5 流式细胞术检测细胞中EdU表达
2.4RT-PCR检测转染细胞中NF-κB及CyclinD1 mRNA表达水平 TLR4-sh组细胞NF-κB mRNA表达水平(0.11±0.01)显著低于阴性对照组(0.34±0.02)及空白组(0.33±0.01,P<0.01)。TLR4-sh组细胞CyclinD1 mRNA表达水平(0.21±0.02)显著低于阴性对照组(0.42±0.03)及空白组(0.41±0.02,P<0.01)。
3 讨 论
脑胶质瘤是严重危害人类健康的恶性肿瘤,是最常见的中枢神经系统肿瘤〔9,10〕。尽管采取了手术结合放化疗等治疗,脑胶质瘤整体治疗效果仍差,高级别的胶质瘤患者的平均生存期不足1年。
TLRs是哺乳动物体内所具有的Ⅰ型跨膜蛋白,是一类保守的介导固有免疫的跨膜信号传递受体家族,是PRR中的一员,参与PAMPs的识别,在识别和抵御各种病原微生物及其产物的过程中发挥重要作用。虽然TLRs介导固有免疫,但TLRs并非固有免疫系统所特有,TLRs主要表达于免疫细胞,如单核/巨噬细胞、T/B淋巴细胞、树突细胞等〔11,12〕,也可表达于一些非免疫细胞如内皮细胞〔13,14〕、平滑肌细胞〔15,16〕及肿瘤细胞〔17~19〕等。TLRs在肿瘤细胞中的表达对于肿瘤发生及发展具有重要意义,其中以TLR4最具广谱性和高表达性,高表达的TLR4可促进肿瘤生长〔20~22〕,并介导肿瘤免疫逃逸。研究表明,TLR4与肿瘤密切相关〔23~25〕,但TLR4与脑胶质瘤的发生、发展的研究鲜有报道。
NF-κB在细胞的炎症反应、免疫应答等过程中起着关键性作用,研究发现,NF-κB通过调控细胞周期及细胞凋亡,参与肿瘤发生及发展过程〔26~28〕。NF-κB是TLR4的下游目标受体,TLR4通过MyD88依赖及非依赖两种信号通路激活下游NF-κB,使之行使其功能。NF-κB可以直接激活CyclinD1,使细胞通过G1/S检测点,促进细胞的增殖〔29〕,从而促进肿瘤的发生及发展。
