SMAD7对山羊卵泡颗粒细胞增殖、凋亡的影响
2022-08-26李碧筠黄思艺王钰锟何莉娜徐德军赵中权
李碧筠,黄思艺,王钰锟,王 磊,何莉娜,唐 雪,徐德军,赵中权
(西南大学动物科学技术学院,重庆 400715)
卵泡的生长发育离不开颗粒细胞的增殖和分化,而颗粒细胞的凋亡往往导致卵泡的闭锁。转化生长因子β(transforming growth factors-β,TGF-β)是一种多功能的多肽类生长因子,能够调节细胞的增殖分化、凋亡、侵袭、迁移等过程,并参与了机体发育、免疫等生物学过程。SMAD蛋白位于TGF-β信号通路下游,在该通路传导和转录调控的过程中发挥着重要作用,绝大多数的TGF-β家族成员均需要通过SMAD信号通路才能参与细胞内的各种生理过程。SMAD7作为TGF-β和BMP信号通路的传导拮抗因子,对TGF-β/SMAD信号通路具有抑制作用。最近的研究表明,SMAD7可能是卵泡发育的负反馈调节因子。Gao等确定了SMAD7在小鼠的颗粒细胞中表达,并在体外试验中证明了SMAD7受到了来自细胞外的TGF家族成员TGF-β1、BMP4和GDF9的调控,并通过siRNA 干扰试验证明了SMAD7是TGF-β1的负调控因子。孙玉英等在滋阴补阳的中西医结合疗法对鼠卵巢储备功能下降的无排卵不孕大鼠模型试验中发现,模型组大鼠较正常组大鼠卵巢中的发育卵泡、成熟卵泡和黄体减少,闭锁卵泡明显增加,同时伴随着SMAD2、SMAD3蛋白水平的降低和SMAD7蛋白水平的上升。
SMAD蛋白家族的其他成员也对细胞的增殖、凋亡、激素分泌存在着调控作用,各个SMAD蛋白介导不同TGF-β家族成员的信号传导。有研究表明,2、3调节卵泡的发育进程。例如,Li等发现,敲除2、3基因会导致雌鼠的卵泡发育受阻并最终导致卵泡闭锁,其生殖能力显著下降。常迪等发现,2在绵羊的卵巢颗粒细胞中持续表达,并在成熟卵泡时期的表达水平最高。Nomura等发现,激活素可以通过2信号通路刺激颗粒细胞中19A1的表达,而抑制2下调19A1的表达,表明2可以通过调控19A1的表达影响雌激素分泌。此外,徐瑛蕾还发现,3对小鼠颗粒细胞中191的表达有促进作用。这些证据都表明,SMAD信号通路可能参与了卵泡的发育和闭锁过程。
在卵泡发育过程中,下丘脑、垂体分泌的促性腺激素、性腺类固醇激素和来自其他腺体以及卵巢内部产生的其他激素和细胞因子都参与了卵泡的发育过程。卵巢中的类固醇激素主要包括雄激素、雌激素、孕酮,它们主要由颗粒细胞分泌。研究表明,敲除雌激素合成的关键酶基因19A1,小鼠卵泡发育会停止在早期小腔卵泡阶段,而经过外源性雌激素治疗后,能够恢复卵泡的正常发育。在排卵前卵泡中的孕酮一直维持在一个较低的水平,直到功能黄体生成后颗粒细胞才开始大量合成孕酮以维持外周血中的孕酮浓度,进而维持雌性哺乳动物的妊娠状态。此外,高水平的孕酮会抑制原始卵泡的募集,抑制颗粒细胞生成雌二醇,进而影响卵泡的后续发育过程。尽管以往的证据表明,7的表达水平与卵泡发育、闭锁有关,但其具体的作用机制仍不清楚,有待进一步的研究。本试验探究7对颗粒细胞增殖、凋亡、类固醇激素分泌及SMAD信号通路的影响,为揭示卵泡发育、闭锁调控机制提供试验和理论依据。
1 材料与方法
1.1 主要试剂
DME/F-12培养基、胎牛血清购自美国Gibco公司,胰酶、CCK-8 试剂盒、蛋白预染marker、SDS-PAGE 蛋白上样缓冲液(5×)、SDS-PAGE蛋白制胶试剂盒购自重庆葆光生物技术有限公司,细胞裂解液购自Solarbio公司,LipoHigh脂质体高效转染试剂、RNAiso、PrimeScriptRT reagent Kit with gDNA Eraser、TB GreenPremix Ex TaqII购自TaKaRa公司,BCA蛋白浓度测定试剂盒购自生工生物工程股份有限公司, SMAD7 Rabbit pAb、SMAD2 Rabbit pAb、SMAD3 Rabbit pAb、SMAD4 Rabbit pAb、P-SMAD2 Rabbit pAb、P-SMAD3 Rabbit pAb、BAX Rabbit pAb、2 Rabbit pAb、PCNA Rabbit pAb购自重庆卡尔波生物技术有限公司。
1.2 试验动物和细胞培养
试验动物选用西南大学动物科学技术学院试验羊场3~4月龄健康大足黑山羊,所有试验均得到西南大学动物实验伦理委员会批准。待山羊屠宰后,将卵巢取出用75%的酒精喷洗,再用无菌的PBS缓冲液冲洗3遍,放入37 ℃无菌生理盐水中,迅速带回试验室进行后续试验操作。山羊卵泡颗粒细胞的培养参照Zhao等的报道。
1.3 质粒载体扩增与siRNA合成
SMAD7-pcDNA3.1(+)-N-eGFP质粒载体(图1)构建委托南京金斯瑞公司合成,对照组为空白载体。7的干扰RNA委托重庆锐博生物有限公司和上海生工合成,干扰RNA的序列(表1)。利用qRT-PCR检测siRNA干扰效率,选择siRNA-SMAD7作为后续试验材料。按照制造商说明向感受态大肠杆菌中加入 SMAD7-pcDNA3.1(+)-N-eGFP质粒载体,将已转化的感受态大肠杆菌滴加在含有相应抗生素抗性的LB固体培养基上,放入37 ℃细菌培养箱中培养。挑取培养的转化大肠杆菌的单菌落数,置于离心管中后放入摇床摇菌。取100 mL培养好的菌液吸净上清液,向菌体沉淀中分别加入Buffer MP1、Buffer MP2、Buffer MP3然后离心。将上清液多次纯化,加入异丙醇后离心留沉淀。用70%的乙醇清洗质粒DNA,离心后室温干燥质粒DNA。用适量的ddHO溶解质粒DNA,然后在仪器上测定其OD值是否符合标准。

图1 SMAD7过表达载体结构Fig.1 The structure of overexpression vector of SMAD7

表1 siRNA序列
1.4 质粒与siRNA转染
利用LipoHigh脂质体高效转染试剂分别将NC质粒、Smad7过表达质粒、siRNA-SMAD7及siRNA-control转染至山羊卵泡颗粒细胞,每组3个重复。按转染试剂操作说明,取两个1.5 mL离心管,分别加入125 μL DME/F-12培养液,然后于其中一管加入100 pmol siRNA或4 μg质粒吹打混匀;另一管加入10 μL高效转染试剂吹打混匀,室温静置5 min后,将含有siRNA或质粒的培养液加入含高效转染试剂的培养液中吹打混匀,室温静置20 min。 将制备好的转染溶液加至六孔板,并用纯DME/F-12加至每孔2 mL,于37 ℃,5% CO中培养,6 h后更换为含胎牛血清的培养液。转染24~48 h后观察结果或收取细胞进行后续试验。
1.5 CCK8及流式细胞术
将细胞接种于96孔板并转染,向每孔加入10 μL CCK8溶液。将96孔板置于培养箱孵育24、36、48、72 h后用酶标仪测定在450 nm处的吸光度(OD值)。用胰酶消化收集转染后的山羊卵巢颗粒细胞,将用PBS重悬的细胞液离心并再次重悬,加入5 mL预冷的70%乙醇于4 ℃固定过夜。再次离心重悬后加入5 μL RNaseA(10 mg·mL)37 ℃消化1 h,加入50 mg·mL碘化丙啶37 ℃避光染色1 h,在流式细胞仪上进行分析。
1.6 实时荧光定量PCR
根据制造商的说明,使用RNAiso试剂(TaKaRa,中国)从颗粒细胞中提取总RNA。使用Nanodrop1000分光光度计(中国)测定RNA浓度和纯度。研究中仅考虑吸光度比A/A为1.8~2.0的样品。根据PrimeScriptRT reagent Kit with gDNA Eraser说明书的要求首先去除基因组DNA,之后进行反转录反应。所有基因序列均源自NCBI(https://www.ncbi.nlm.nih.gov/),引物委托生工生物工程股份有限公司(上海)合成,合成引物及序列见表2。TB GreenPremix Ex TaqII荧光定量PCR的反应体系为10 μL:TB GreenPremix Ex TaqII 5 μL、Forward primer(10 μmol·L)0.4 μL,Reverse primer(10 μmol·L)0.4 μL、cDNA0.5 μL、RNase Free HO 3.7 μL。反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,循环39次;63.5 ℃检测信号,熔解曲线温度根据引物不同设置为65~95 ℃,每0.5 ℃读取一次Ct 值。
1.7 总蛋白提取和Western blot检测
按照动物全蛋白提取试剂盒(Sangon Biotech,上海)说明书提取颗粒细胞的总蛋白,提取的总蛋白按需求分装后-80 ℃冷冻保存。采用BCA法测量蛋白的浓度,具体步骤参考改良型BCA蛋白浓度测定试剂盒(Sangon Biotech,上海)说明书。将蛋白样加入4 × SDS蛋白上样缓冲液后,沸水浴10 min,迅速将蛋白样放入冰盒或-80 ℃。经过电泳、转膜等操作,将PVDF膜放入装有封闭液的培养皿中封闭2 h;TBST缓冲液洗3次,每次10 min,过夜孵育对应的一抗;TBST缓冲液洗3次,每次10 min,二抗孵育1 h;TBST缓冲液洗3次,每次10 min,利用显影液在照胶仪下观察蛋白的相对表达量。
1.8 统计分析
本试验使用prism软件进行统计分析,用独立检验对两组数据间的比较进行分析。每个选择鉴定的基因、蛋白均进行3次生物学重复以及3次技术重复。数据结果采用“平均值±标准误”表示,<0.05表示差异显著,<001表示差异极显著,>0.05表示差异不显著。

表2 用于实时定量PCR的引物序列
2 结 果
2.1 siRNA干扰效率与SMAD7-pcDNA3.1(+)-N-eGFP转染结果
通过高效脂质体转染试剂将7的siRNA转染进颗粒细胞中,利用qRT-PCR对7的表达量进行测定,发现3条siRNA对7的干扰效率均低于70%(图2A)。因此重新设计了3条7的siRNA进行试验,发现新设计的siRNA1的干扰效率最高,且干扰效率大于70%,故选用siRNA1作为后续试验所用的干扰RNA,将其命名为siRNA-SMAD7作为后续试验材料(图2B)。
通过高效脂质体将SMAD7-pcDNA3.1(+)-N-eGFP质粒载体转染颗粒细胞,24~36 h后在荧光显微镜下观察,发现细胞能发出绿色荧光,说明质粒载体成功转染进了颗粒细胞(图2C-E),可以对其进行后续相关试验。

A.3条不同的siRNA对山羊颗粒细胞中SMAD7的干扰效率;B.新设计的3条不同的siRNA对山羊颗粒细胞中SMAD7的干扰效率;C.明场图像;D.荧光图像;E.融合图像A.The interference efficiency of 3 different siRNAs on SMAD7 in gGCs; B.The interference efficiency of 3 different siRNAs newly designed on SMAD7 in gGCs; C.The image of cells in the bright field; D. The fluorescent diagram of cells; E. Merge图2 转染结果图Fig.2 Transfection result graph
2.2 SMAD7抑制山羊卵泡颗粒细胞增殖
利用CCK8法测定细胞增殖活力,结果显示7过表达在24、36、48、72 h均显著下调细胞增殖活力(<0.05, 图3A)。通过qRT-PCR和Western blot检测显示,7过表达显著下调PCNA的相对表达量(<0.01,图3B&C)。与对照组相比siRNA-SMAD7组细胞的增殖活力在24、36、48、72 h均显著上升(<0.05,图3D)。如图2E&F所示,干扰7显著促进了的mRNA和蛋白水平(<0.05)。这些结果表明7抑制卵巢颗粒细胞的增殖能力。
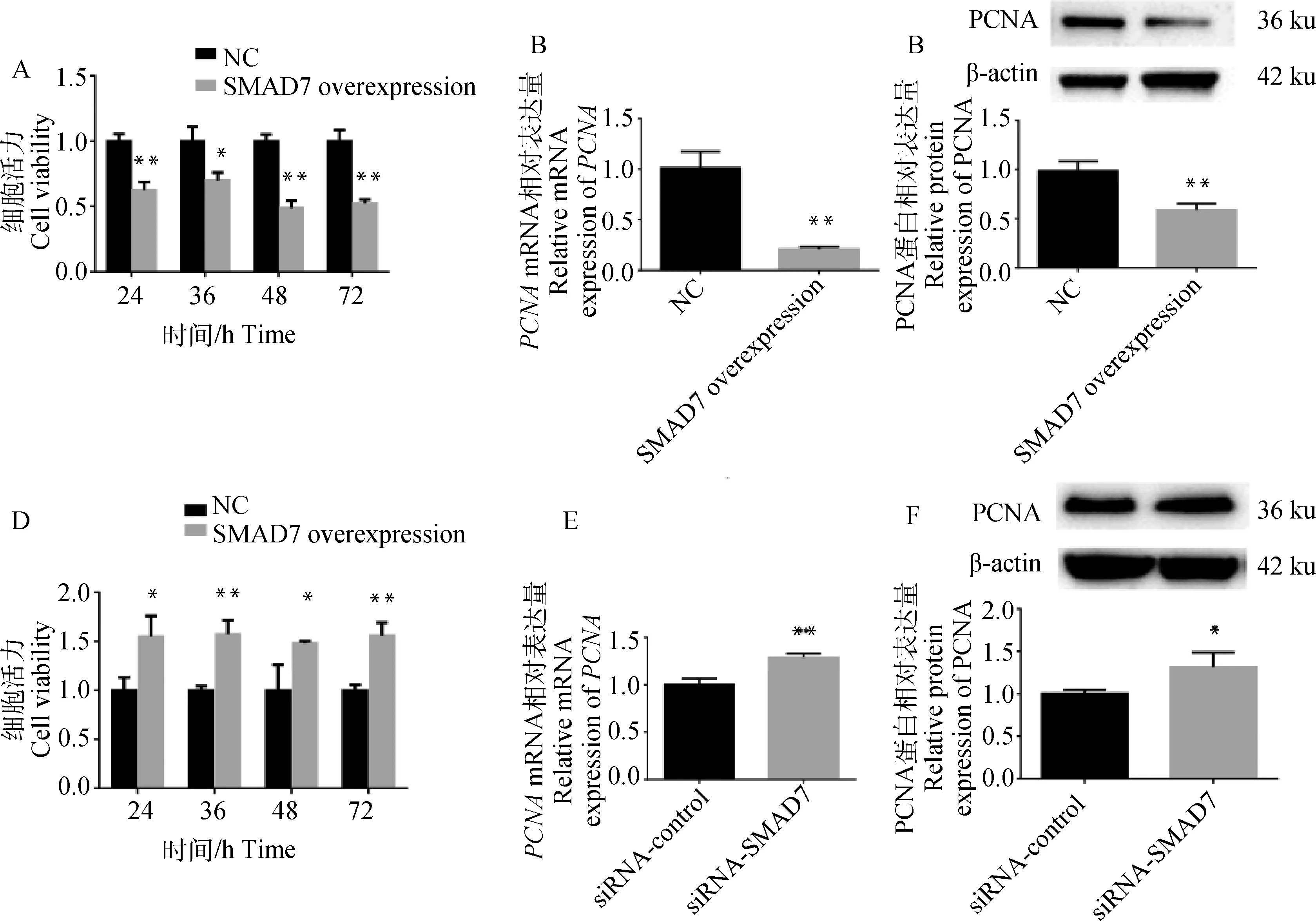
A.SMAD7过表达对山羊颗粒细胞增殖活力的影响;B&C.SMAD7过表达对增殖相关基因PCNA的影响;D.SMAD7干扰对山羊颗粒细胞增殖活力的影响;E&F.SMAD7干扰对增殖相关基因PCNA的影响A.The effect of SMAD7 overexpression on the proliferation of gGCs; B&C.The effect of SMAD7 overexpression on the proliferation-related gene PCNA; D.The effect of SMAD7 interference on the proliferation of gGCs; E&F. The effect of SMAD7 interference on the proliferation-related gene PCNA图3 SMAD7对山羊颗粒细胞增殖的影响Fig.3 The effect of SMAD7 on the proliferation of gGCs
2.3 SMAD7促进山羊卵泡颗粒细胞凋亡
利用流式细胞术检测7对颗粒细胞凋亡的影响,结果显示7过表达显著促进细胞凋亡(<0.01,图4A&B)。通过qRT-PCR和Western blot检测显示,7过表达显著下调BCL2/BAX的比值(<0.01,图4C&D)。与对照组相比siRNA-SMAD7对细胞凋亡水平没有显著的影响(>0.05,图4E&F)。如图4G&H所示, 干扰7显著上调BCL2/BAX mRNA和蛋白质表达量比值(<0.05)。这些结果表明,7是颗粒细胞的促凋亡因子。
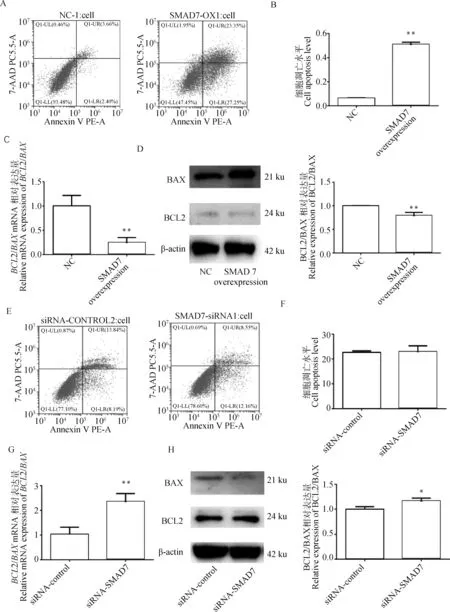
A&B.利用流式细胞仪检测细胞凋亡在NC组和SMAD7过表达组间的差异;C&D.SMAD7过表达对细胞凋亡相关基因BCL2/BAX的在mRNA和蛋白水平相对表达量的影响;E&F.利用流式细胞术检测细胞凋亡在siRNA-control组和siRNA-SMAD7组间的差异;G&H.SMAD7干扰对细胞凋亡相关基因BCL2/BAX在mRNA和蛋白水平相对表达量的影响A&B. The difference of apoptosis detected by flow cytometry between NC group and SMAD7 overexpression group; C&D. The effect of SMAD7 overexpression on the relative expression of apoptosis-related genes BCL2/BAX at the mRNA and protein levels; E&F. The difference of apoptosis detected by flow cytometry between the siRNA-control group and the siRNA-SMAD7 group; G&H. The effect of SMAD7 interference overexpression on the relative expression of apoptosis-related genes BCL2/BAX at the mRNA and protein levels图4 SMAD7对颗粒细胞凋亡及BCL2/BAX比值的影响Fig.4 Effects of SMAD7 on granulosa cell apoptosis and BCL2/BAX ratio
2.4 SMAD7对山羊卵泡颗粒细胞类固醇激素分泌的影响
利用ELLSA试剂盒测定颗粒细胞培养24 h后培养液中类固醇激素水平。结果表明,7过表达极显著上调孕酮(P4)的分泌水平,同时极显著下调雌二醇(E2)的分泌水平(<0.01,图5A)。而干扰7极显著下调P4分泌,同时极显著上调E2分泌(<0.01,图5B)。这些结果说明7抑制颗粒细胞分泌E2,促进P4的分泌。

A.SMAD7过表达对P4/E2的影响;B.SMAD7干扰对P4/E2的影响A. The effect of SMAD7 overexpression on P4/E2; B. The effect of SMAD7 interference on P4/E2图5 SMAD7对山羊颗粒细胞分泌类固醇激素的影响Fig.5 The effect of SMAD7 on the secretion of steroid hormones in gGCs
2.5 SMAD7对SMAD2、SMAD3和SMAD4表达的影响
qRT-PCR和Western blot检测显示,7过表达显著上调7的表达量(<0.05),显著下调2、3的表达量(<0.05),而4的表达量无明显变化(>0.05,图6A&B)。如图6C&D所示,干扰7显著上调2、3的表达量(<0.05),4的表达量则无明显变化(>0.05)。以上结果表明,7抑制2、3蛋白的表达而不影响4的表达。
3 讨 论
尽管人类医学的研究表明,7在调控细胞命运方面具有重要作用,但其在卵泡中的具体功能尚未阐明。本试验探讨了7对山羊卵泡颗粒细胞增殖凋亡的作用。结果发现,过表达7抑制卵泡颗粒细胞增殖、促进其凋亡,干扰7则会促进颗粒细胞增殖、抑制其凋亡。进一步的试验发现,7抑制细胞增殖相关基因的表达,促进凋亡基因的表达、抑制抗凋亡基因2的表达。这些发现与前人的报道类似,例如,Tang等发现,7抑制肺癌细胞增殖。Sobral等发现,过表达7通过27抑制环孢素(cyclosporine A, CsA)诱导成纤维细胞增殖。Lallemand等发现,7促进Mv1Lu细胞中TGF-β介导的细胞凋亡以及Mv1Lu与MDCK细胞中失巢凋亡和血清戒断诱导的细胞凋亡。Yao等发现,过表达7通过抑制1表达中断了TGF-β信号通路从而促进了猪卵泡颗粒细胞凋亡。这些证据表明,7通过控制卵泡颗粒细胞来影响卵泡闭锁进程。

A.NC组和SMAD7过表达组间SMAD2、SMAD3和SMAD4相对表达量在mRNA水平的差异;B.NC组和SMAD7过表达组间SMAD2、SMAD3和SMAD4相对表达量在蛋白水平的差异;C.siRNA-control组和siRNA-SMAD7组间SMAD2、SMAD3和SMAD4相对表达量在mRNA水平的差异;D.siRNA-control组和siRNA-SMAD7组间SMAD2、SMAD3和SMAD4相对表达量在蛋白水平的差异A. The difference in the relative expression of SMAD2, SMAD3 and SMAD4 at the mRNA level between the NC group and SMAD7 overexpression group; B. The difference in the relative expression of SMAD2, SMAD3 and SMAD4 at the protein level between the NC group and SMAD7 overexpression group; C. The difference in the relative expression of SMAD2, SMAD3 and SMAD4 at the mRNA level between the siRNA-control group and siRNA-SMAD7 group; D. The difference in the relative expression of SMAD2, SMAD3 and SMAD4 at the protein level between the siRNA-control group and siRNA-SMAD7 group图6 SMAD7对SMAD2、SMAD3和SMAD4表达的影响Fig.6 Effect of SMAD7 on SMAD2, SMAD3 and SMAD4 expression
本试验进一步研究发现,伴随着颗粒细胞的增殖和凋亡,TGFβ/SMAD信号通路中的关键传导因子也发生变化,即7过表达后2、3的表达量降低,而4的表达量没有明显变化。利用siRNA干扰7后2、3的表达量上升,4的表达量亦是没有明显变化。这些结果与Kaczorowski等报道的2、3受到抑制时细胞凋亡率会上升,进而导致卵泡发育受阻和闭锁的结果一致。这些结果提示,7可能是通过调控TGFβ/SMAD信号通路中2、3的表达来影响颗粒细胞的凋亡,这与其他研究者的研究报道相似。例如,Di等发现,通过抑制2、3途径可以抑制真皮乳头细胞的增殖;Nan等发现,ALK-SMAD2/3途径可以诱导牛乳腺上细胞的凋亡。哺乳动物的卵泡发育,由原始卵泡向优势卵泡转化过程中,颗粒细胞分泌的E2水平会迅速上升、P4水平则会急速下降,这一现象在人、牛和猪上都有相似的表现。本试验发现,7过表达促进P4分泌,抑制E2分泌。干扰7促进E2分泌并抑制P4分泌。这可能是因为7抑制了2、3的表达,进而影响下游类固醇合成相关基因的表达。Nagyova等发现,在卵丘细胞中通过抑制剂抑制2、3信号通路可导致FSH刺激的孕酮生成增加;Fang等发现,8可以通过AKL5-SMAD3轴调控孕酮的合成。前人的发现与本试验的结果一致,这些证据表明,SMAD7可能是类固醇激素合成的调节因子,但是7是如何影响雌二醇和孕酮分泌的下游调控机制还有待进一步的研究。综上所述,7通过抑制2、3的表达来抑制TGFβ/SMAD信号通路的传导,从而影响颗粒细胞的功能。
4 结 论
7抑制山羊卵巢颗粒细胞的增殖,促进凋亡,并且调节类固醇激素的分泌,同时抑制SMAD2、SMAD3的蛋白表达,从而调控山羊卵泡的发育。
