金黄色葡萄球菌在生物被膜态与浮游态的转录组差异表达分析
2022-08-26毛彦妮常佳伟康馨匀王桂琴
毛彦妮,常佳伟,李 娜,王 鑫,康馨匀,马 强,马 靓,王桂琴
(宁夏大学农学院,银川 750021)
生物被膜是引起细菌持续感染和慢性伤口感染的重要原因,细菌形成生物被膜后通常能够抵抗宿主的免疫反应,相比于浮游态菌,其对抗生素、杀生物剂的耐受性更高。金黄色葡萄球菌和表皮葡萄球菌是人类皮肤的共生菌,可通过感染伤口并蔓延至植入装置,形成生物被膜。研究表明,葡萄球菌形成生物被膜后使治疗更加困难。
寻找新的和有效的抗生物被膜手段将有助于对抗金黄色葡萄球菌的感染。本研究比较了生物被膜态和浮游态生长条件下,金黄色葡萄球菌在形态和生理学上的不同以及两种状态下表达差异显著的基因,通过对差异表达基因的功能和信号通路富集的研究,以期了解生物被膜菌的高持久性和高抗性,为进一步深入探究金黄色葡萄球菌的耐药性机制奠定基础。
1 材料与方法
1.1 主要试验菌株、试剂及仪器
本研究使用的的金黄色葡萄球菌菌株由本实验室分离纯化,保存于宁夏大学农学院兽医药理学实验室;金黄色葡萄球菌标准菌株(ATCC25923)购自中国药品与生物制品鉴定所;MHB肉汤和TSB肉汤购自北京陆桥技术有限公司;抗菌药物购自中国药品与生物制品鉴定所;细菌RNA提取试剂购自TaKaRa公司;实时荧光定量PCR试剂购自诺唯赞公司;荧光定量PCR仪购自德国Jena公司;Simpli Nano超微量分光光度计购自美国GE公司。
1.2 方法
1.2.1 浮游态细菌培养 试验菌株接入MHB肉汤中于37 ℃下以210 r·min振荡过夜培养,离心(10 min,12 000 r·min)收集浮游态细菌。
1.2.2 生物被膜态细菌培养 根据Yooh等报道的培养皿法培养静态的生物被膜。将过夜培养的金黄色葡萄球菌菌株培养物稀释至1×10cfu·mL, 接种到添加了葡萄糖的新鲜TSB肉汤培养基中,于96孔板中培养生物被膜。离心收集被膜态菌用于后续试验。
1.2.3 生物被膜态菌观察分析 采用结晶紫染色半定量法检测金黄色葡萄球菌生物被膜,37 ℃培养生物被膜8、24、48、72、96 h后,弃掉浮游菌,用0.1 mol·L磷酸钠缓冲液(pH 6.5)冲洗3次,4 ℃ 使用戊二醛固定,经结晶紫染色后,使用光学显微镜和扫描电镜(SEM)对生物被膜进行观察。
1.2.4 金黄色葡萄球菌对抗菌药物的敏感性试验 采用美国临床实验室标准委员会(CLSI)推荐的微量肉汤稀释法测定9种抗菌药物对32株金黄色葡萄球菌的生物被膜态和浮游态的最低抑菌浓度(MIC)。首先将梯度稀释的不同浓度抗菌药物按照每孔100 μL加到96孔板中,将浊度为0.5麦氏单位的生物被膜态以及浮游态的金黄色葡萄球菌菌液稀释100倍后分别取100 μL接种到不同药物浓度的孔中。每个样品设3个重复,以MHB肉汤作为阴性对照,ATCC25923作为质控菌株。置于37 ℃ 培养箱中培养18 h后观察结果。结果判定参照CLSI标准。
1.2.6 文库构建及测序 文库构建及RNA-seq测序委托北京诺禾致源科技有限公司完成。首先,通过加入带有oligo(DT)的磁珠于总RNA中富集带有poly-A尾的mRNA,然后通过片段化缓冲液进行片段化,随后使用试剂盒合成双链cDNA。对合成的cDNA进行末端修复,并在3′末端加上一个A碱基。根据Illumina配对末端样品制备试剂盒的说明书,制备RNA-seq文库并测序。设置3个生物学重复,每种生长条件下分别提取3份RNA样本。
1.2.7 测序数据的处理与分析 测序后,使用软件SeqPrep对原始测序数据进行质控。质控完成后再使用软件HISAT2将原始数据置于NCBI上进行比对,获得用于后续转录本组装和表达量计算等的mapped reads,比对完成后对转录组测序的比对结果进行质量评估。
1.2.8 表达量差异分析及GO、KEGG富集分析 为了确定差异表达基因的功能,使用检索相互作用基因/蛋白质的搜索工具(STRING)进行了GO和KEGG通路的富集分析。并用UniProt信息库确定未被STRING鉴定的蛋白质的功能。
1.2.9 RT-qPCR验证 为了验证RNA-seq数据,选择10个生物被膜形成相关基因进行RT-qPCR验证。使用Primer premier 5设计引物并用NCBI Primer-BLAST对引物特异性进行评价,挑选出合格的引物进行试验(表1),由上海生工生物工程股份有限公司合成。使用诺唯赞的反转录试剂盒将总RNA反转录为cDNA,并用SYBR Green I Real-Time PCR试剂盒进行Real-Time PCR扩增反应,以16S rRNA为内参基因,ddHO为阴性对照,每个样品设置3个重复。
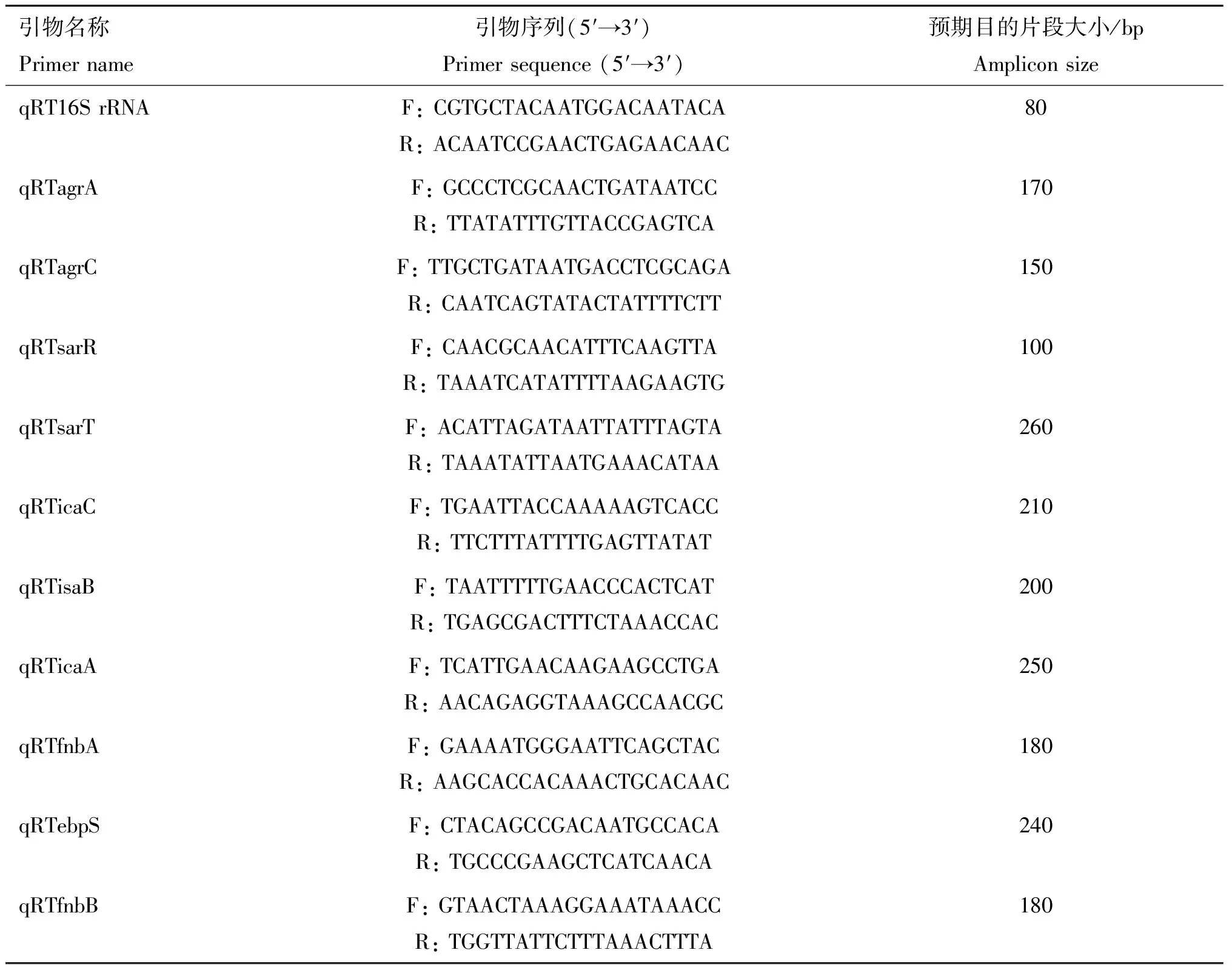
表1 RT-qPCR引物信息
1.2.10 数据处理 采用SPSS 26.0和GraphPad Prism 7软件进行统计学分析。2法计算生物被膜态和浮游态金黄色葡萄球菌 mRNA的表达量。其中△△Ct=[Ct(处理组目的基因)-Ct(处理组内参基因)]-[Ct(对照组目的基因)-Ct(对照组内参基因)]。使用one-way ANOVA进行差异分析,≤0.05认为有统计学意义。
2 结 果
2.1 金黄色葡萄球菌生物被膜形成过程的观察
光学显微镜观察金黄色葡萄球菌生物被膜的形成过程。如图1所示,光学显微镜观察结晶紫染色后的生物被膜,可见表面云絮样、团块样。8~72 h随着培养时间的延长,表面云絮样物质逐渐紧密,聚集黏附形成小菌落,杂乱无章,逐步遍布整个观察视野(图1A~D)。培养8 h后,生物膜已初具规模,但数量较少;24 h后,玻片上形成了厚厚且紧密的生物被膜,层层堆集。此后,生物被膜开始分散,96 h时生物被膜结构开始疏散,玻片上形成的生物膜结构较为稀松(如图1E)。

A~E. 培养时间分别为8、24、48、72、96 hA-E. Culture time are 8, 24, 48, 72, 96 h, respectively图1 光学显微镜下金黄色葡萄球菌生物被膜形成过程(100×)Fig.1 The biofilm formation process of S.aureus under optical microscope(100×)
扫描电镜观察金黄色葡萄球菌生物被膜结构。扫描电镜能更直观地展现金黄色生物被膜形成过程的结构变化。如图2所示,8~72 h时生物被膜菌胞外基质更加黏稠、浓密,膜内金黄色葡萄球菌更加聚集(图2A~D)。96 h时,细菌生物被膜立体结构被破坏,紧密的结构变的稀松,零散的游离菌聚集形成小型团状。生物被膜内细胞开始凹陷形成网状结构(图2E)。
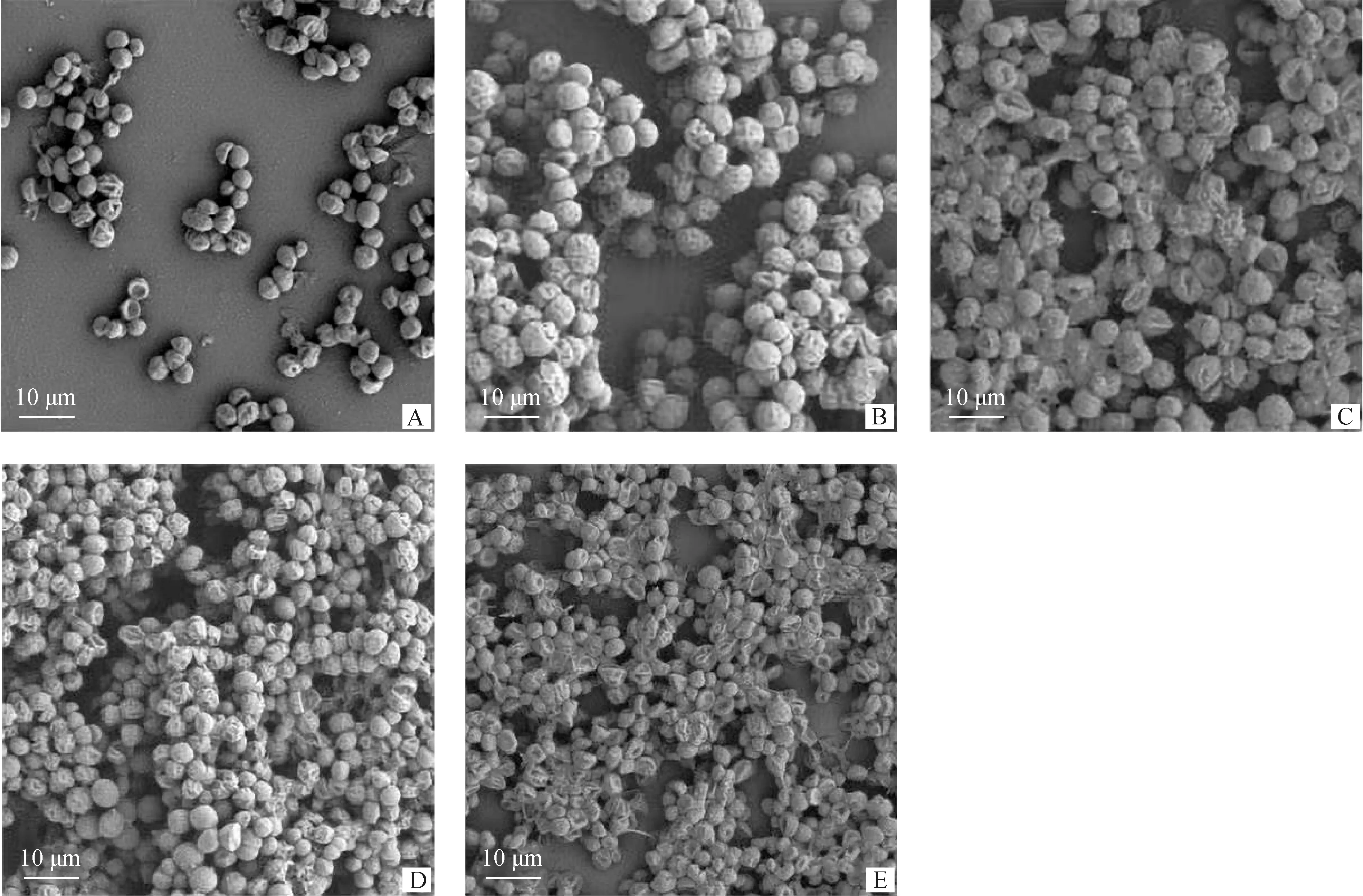
A~E. 培养时间分别为8、24、48、72、96 hA-E. Culture time are 8, 24, 48, 72, 96 h, respectively图2 扫描电镜下金黄色葡萄球菌生物被膜形成过程(3 000×)Fig.2 The biofilm formation process of S.aureus under SEM(3 000×)
2.2 金黄色葡萄球菌的生物被膜态和浮游态对抗菌药物敏感性
金黄色葡萄球菌的生物被膜态和浮游态对抗菌药物的敏感性试验结果见表2。结果显示,菌株形成生物被膜后,膜内细菌在胞外聚合物的屏障作用保护下,其抗药性较游离态菌增加,最高增加4 096倍,最低增加8倍。
本文对某规模化猪场长白猪、大白猪、长大二元猪的第一、二、三胎的妊娠期、总产仔数、产活仔数、产健仔数、仔猪初生窝重等繁殖指标进行整理,并采用SPSS软件进行统计与分析,旨在为猪场下一步的选种、选配及提高母猪的繁殖性能提供可靠的理论依据,同时为其他猪场提供方法参考。
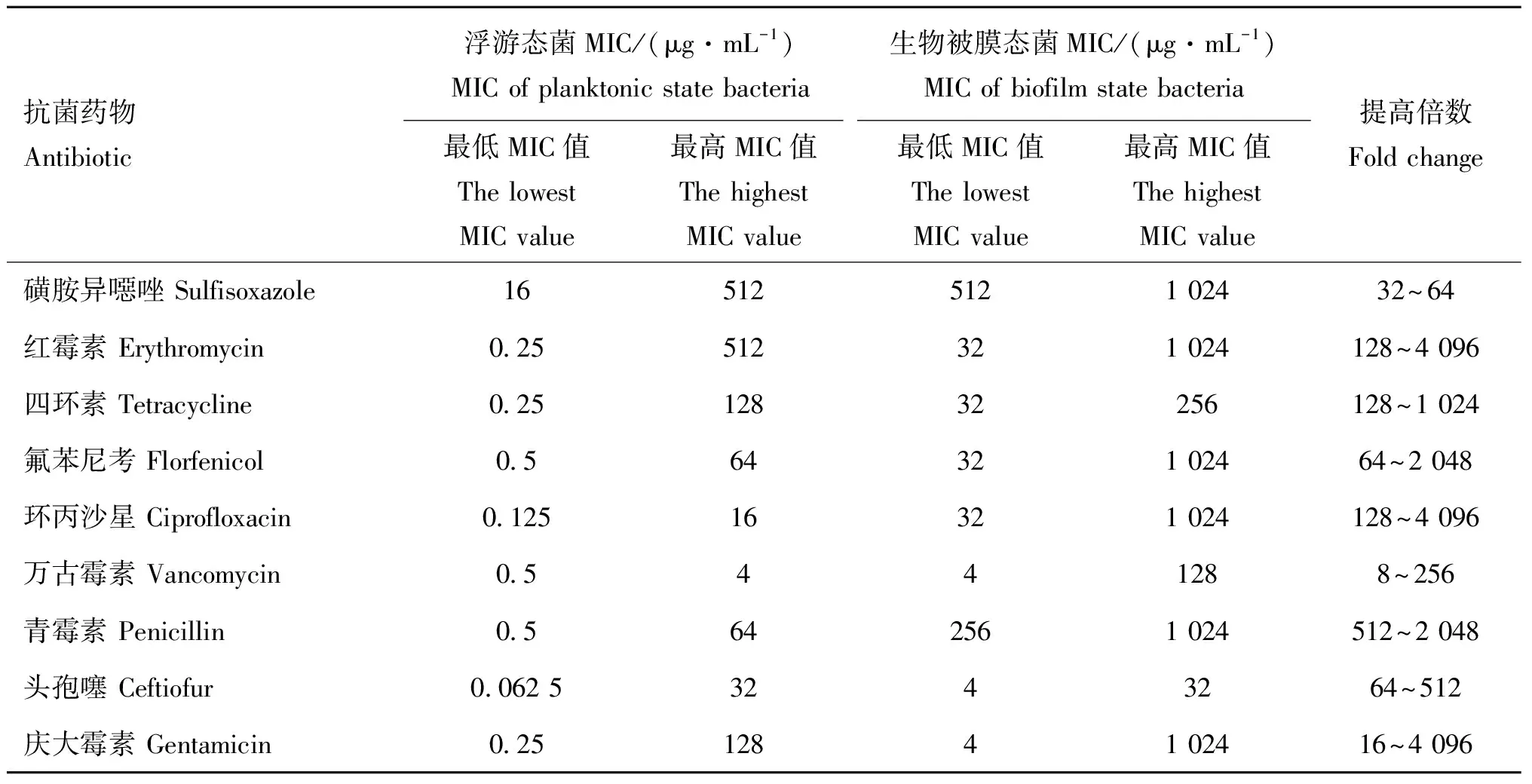
表2 32株金黄色葡萄球菌的生物被膜态与浮游态对9种抗菌药物的耐药情况
2.3 测序数据质量评估与比对统计
本试验中的测序质量评价和对比统计数据汇总如表3所示。每个样本中有97%以上的重复比对率,数据质量良好。剔除低质量片段后组装到试验组转录组中,组成转录组的基础数据,转录组序列上的标记数分别为18 190 880、16 375 516、19 683 816、20 619 370、 16 578 378和19 221 314 bp,分别占文库的97.95%、98.03%、98.03%、98.12%、98.16%和97.88%。记录序列大小相同的unigenes的数量,得到unigenes的长度。这些结果证明了本研究中组装的unigenes是高质量的。
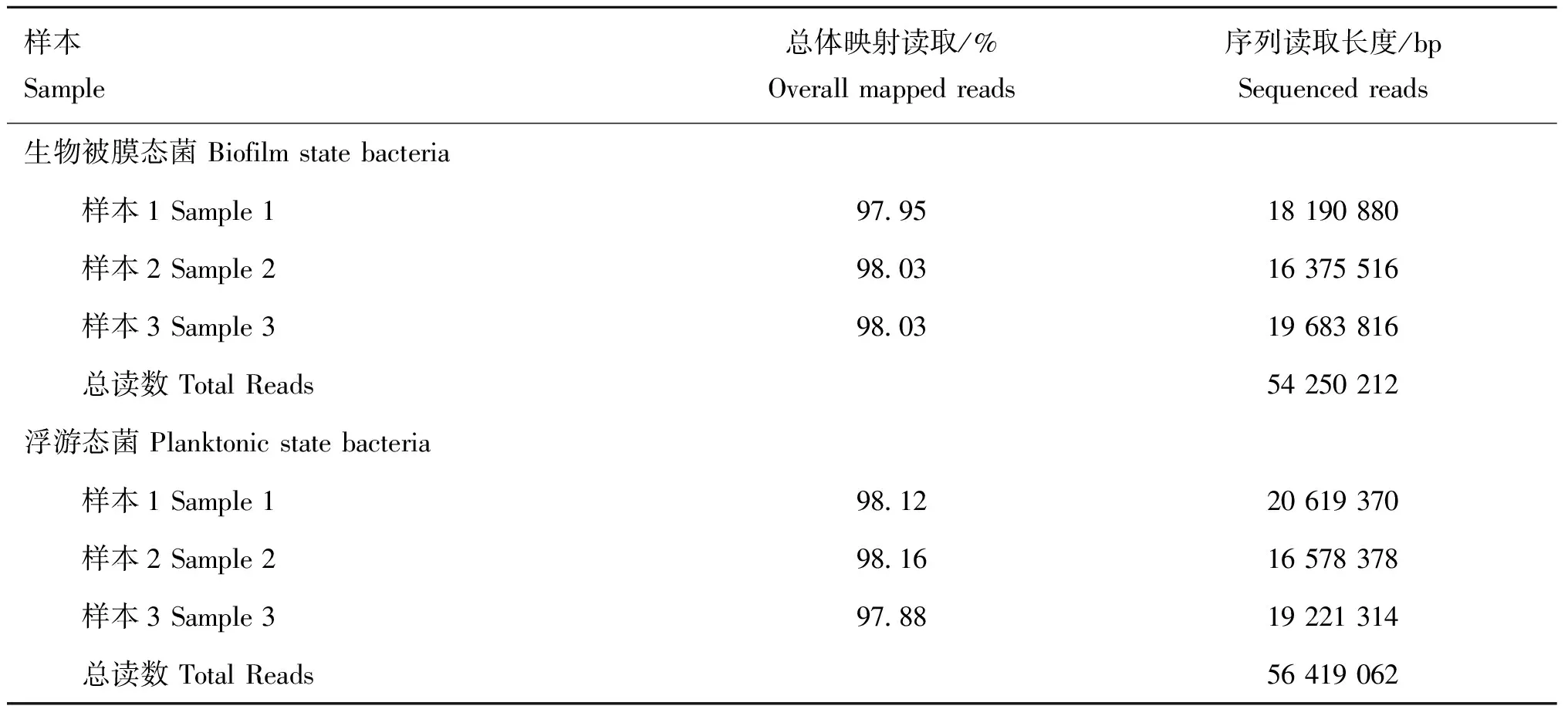
表3 总读取数和与参考基因组对应的总读取百分比
图3为生物被膜态菌和浮游态菌的转录本读数密度。如图所示,生物被膜态菌的lg(FPKM+1)在0~4内表达值较低,而在相同范围内,浮游态具有更多的表达基因。而且,浮游态的lg(FPKM+1)在3~4有大多数读数偏向,因此浮游态具有较高的基因表达水平。总体而言,两种样品类型之间大约90%的基因表达水平相似。
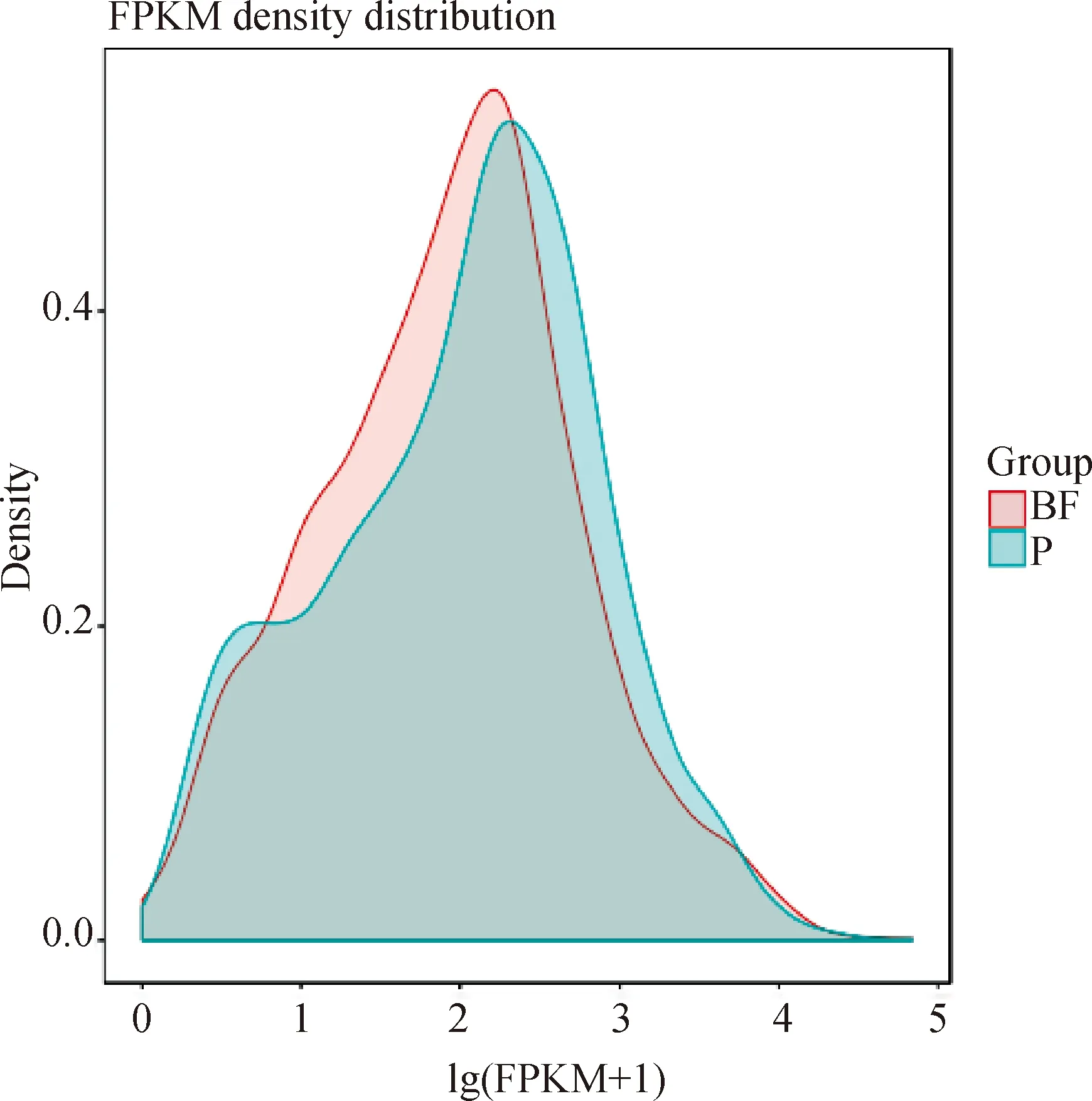
图3 各样本类型表达量分布密度图Fig.3 Density graph showing the distribution of expression levels for each sample type
图4为显示浮游态菌和生物被膜态菌基因关系的散点图。如图所示,两样本之间的基因表达水平呈正相关。两样本类型之间差异最大的上调或下调的离群值即为目标基因。
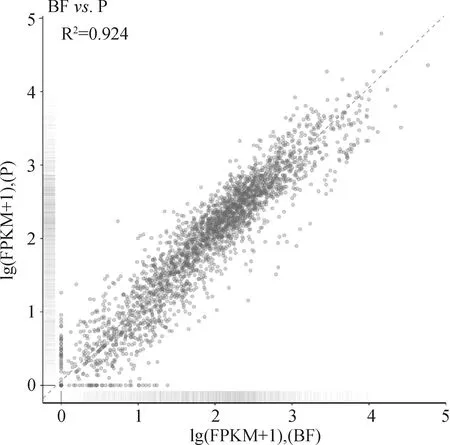
图4 浮游态和生物被膜态菌FPKM散点图Fig.4 Scatter plot of the FPKM reads for both the planktonic and biofilm state bacteria
2.4 金黄色葡萄球菌生物被膜态和浮游态全基因表达分析
从cDNA文库中,生物被膜态和浮游态分别获得了2 499个和2 494个测序读数。有37个基因仅在生物被膜态表达,32个仅在浮游态表达。如图5A所示,重叠区域中的2 462个基因为两种状态下细菌均可转录的基因。为了进行后续分析,仅考虑倍数变化大于2的基因,与浮游态菌相比,生物被膜态菌中显著差异表达的基因共1 512个,其中,760个(50.26%)基因转录水平升高,而752个(49.74%)基因转录水平降低(图5B)。
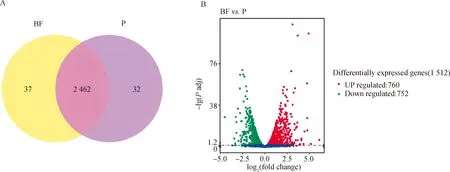
A. 基因表达维恩图;B. 差异表达基因火山图。有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示A. Venn diagram of gene expression; B. Volcanic map of differentially expressed genes. Significantly differentially expressed genes are represented by red dots (up-regulated) and green dots (down-regulated), while not significantly differentially expressed genes are represented by blue dots图5 基因表达水平比对图Fig.5 Gene expression level comparison chart
2.5 差异表达基因的GO分析
从GO功能分析结果中列举了部分功能条目,并选取了最显著的条目绘制分类饼状图(图6)。在筛选的功能条目中,有5个生物过程,3个细胞组成和7个分子功能发生变化,生物过程的分类结果表明,参与细胞过程和代谢过程的基因最多,分别占差异表达基因的28.72%和17.83%。细胞组分分类结果中,细胞实体结构和细胞内组分分别占差异表达基因的49.98%和37.09%。分子功能分类结果中,结合和催化功能蛋白基因分别占差异表达基因的41.59%和27.83%。

图6 GO富集图Fig.6 GO enrichment pie chart
2.6 KEGG富集分析
KEGG分析结果显示,有20条途径显著富集,如图7所示,与代谢相关的通路显著富集(<0.05)。其次为氨基酸的生物合成和ABC转运蛋白通路。
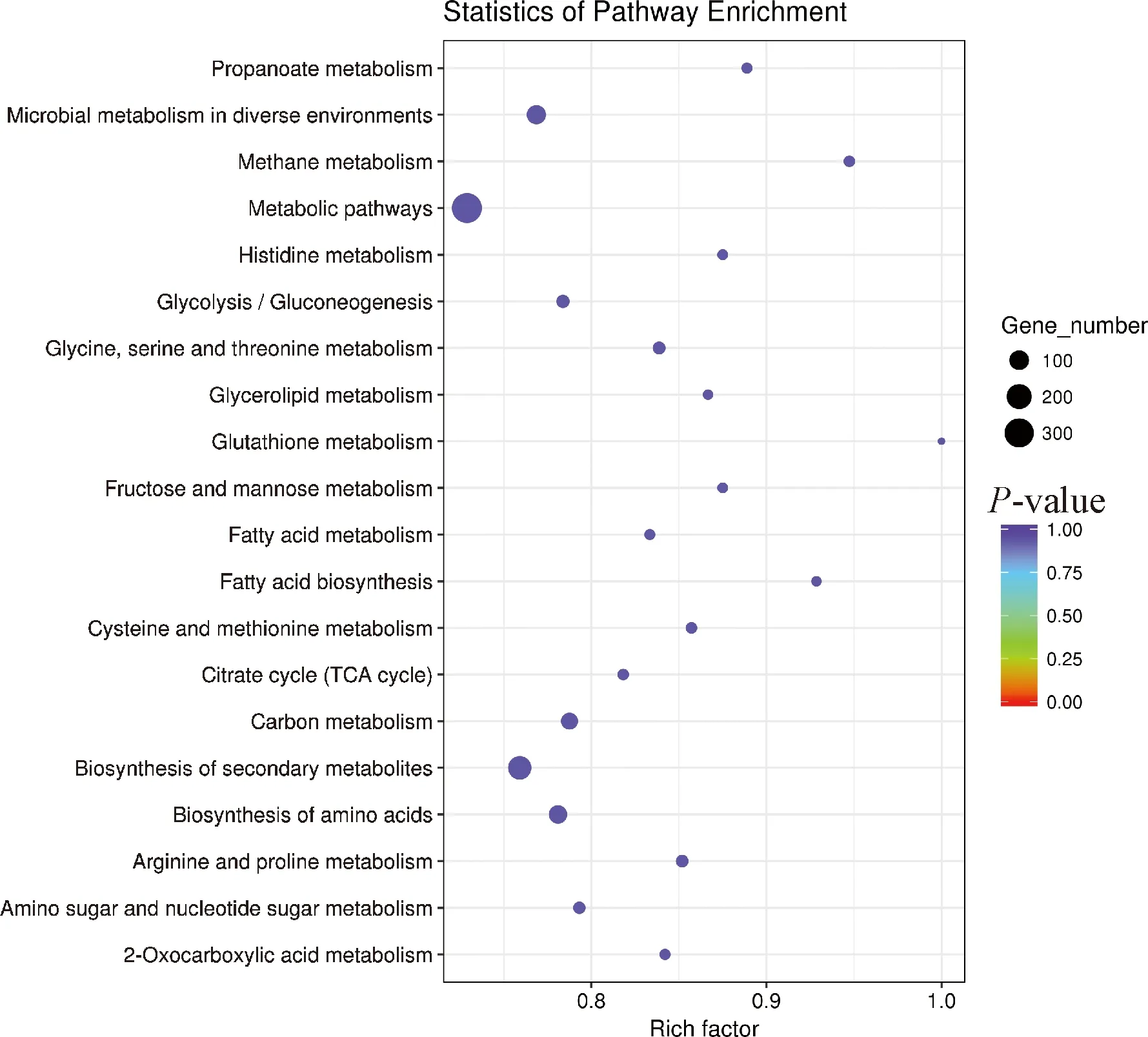
图7 差异表达基因KEGG富集散点图Fig.7 KEGG enrichment scatter plot of differentially expressed genes
2.7 差异显著基因表达分析
表4列出了生物被膜菌中转录上调和下调最多的10个基因。在转录水平下降的基因中,与编码核糖体蛋白相关的基因为、和,与葡萄糖代谢途径相关的基因有SAOUHSC_01802、SAOUHSC_01064、、、、、和。而转录水平上调的基因主要包括生物被膜形成相关,如结合因子 ()、编码相关转移蛋白的基因、SAOUHSC_01028、、SAOUHSC_00315、1、以及SAOUHSC_02864等。

表4 差异表达基因列表
2.8 与金黄色葡萄球菌生物被膜形成相关的关键基因的RT-qPCR验证
为了验证RNA-seq鉴定的基因表达谱,选择10个与生物被膜形成相关的主要基因,以16S rRNA为内参基因,用RT-qPCR方法对其相对表达水平进行定量。如图8所示,RT-qPCR的表达趋势与RNA-seq表达谱一致。其中、、、和基因表达上调,上调倍数分别为5、4、8、2和5倍,而基因、、、和表达下调,下调倍数分别为10、5、10、20和10倍。
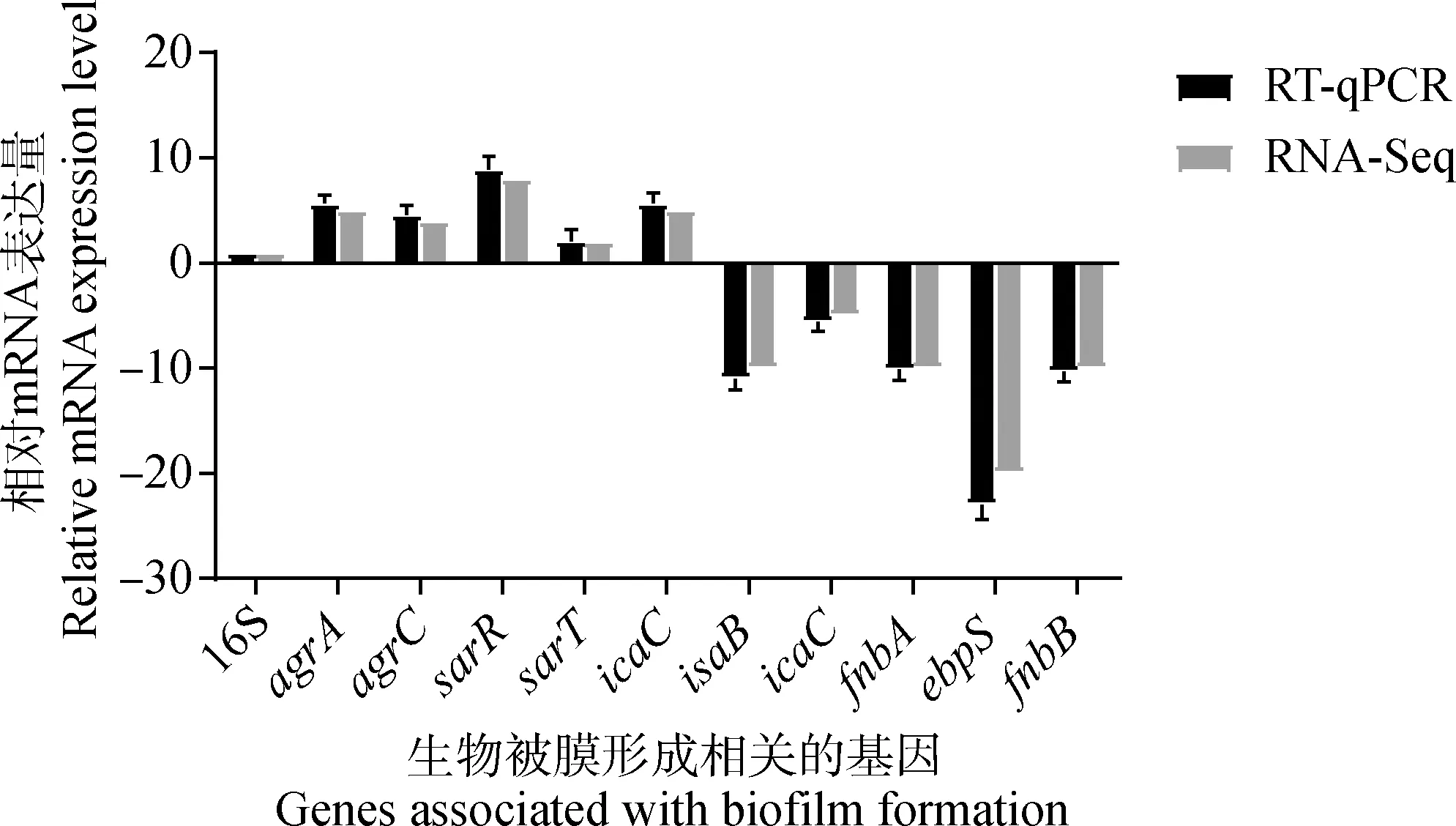
图8 各基因mRNA的相对表达量Fig.8 Relative expression of mRNA of each gene
3 讨 论
细菌生物被膜是由多糖、DNA和/或蛋白质组成的复杂生物群落。除了帮助细菌在表面定植外,生物被膜还能增强对抗生素的耐药性。金黄色葡萄球菌是引起人与动物感染的重要致病菌之一,感染范围从皮肤和黏膜的浅表感染到高侵袭性和潜在的致命感染。金黄色葡萄球菌感染,如心内膜炎、骨髓炎和与留置医疗器械相关的感染,均与细菌生物被膜的形成有关。因此,对生物被膜态和浮游态细菌进行生理和遗传差异分析十分有意义。
本试验首先通过光学显微镜与扫描电镜观察金黄色葡萄球菌生物被膜形成过程中的生理状态变化,发现在生物被膜生长的过程中随着培养时间的延长,生物被膜聚集面积越来越大,其结构也越来越紧密。在生物被膜态菌表面还可观察到一些黏性物质,可能是生物被膜形成过程中分泌的胞外多糖,可以促进细胞间黏附与成熟生物被膜三维立体结构的构建,有助于生物被膜态菌落的形成。但随着培养时间进一步增加,生物被膜内细胞开始凹陷形成网状结构,与大多数生物被膜态细菌如变形链球菌和肺炎链球菌类似,可能是在生物被膜态细菌生长过程中,随着细菌密度的增加,生物被膜内营养和氧气不足导致的。
在本研究中,与浮游态菌相比,生物被膜态菌的耐药性增加,这与Cargill和Upton报道的结果相似,可能是生物被膜中细菌代谢状态的多样性及生物被膜基质的保护,或者是抗菌药物难以渗透生物被膜,细菌生长速度缓慢以及存在抗菌药物降解酶等,从而使耐药性增加。除此之外,与浮游态菌相比,生物被膜的存在使细菌增加了突变的频率,并且生物被膜菌中的基因会发生频繁的水平转移从而导致耐药基因迅速扩散。总之,生物被膜的产生为细菌提供了重要的保护屏障,阻止抗菌药物接触细菌,干扰抗菌药物作用的正常发挥,从而加剧了细菌的感染性。
基因表达谱可以揭示有关细菌物种适应特定环境的重要信息。生物被膜是细菌的一种高度动态的活性成分,生物被膜的存在有助于细菌持续性感染。本研究分析了金黄色葡萄球菌的生物被膜态和浮游态的基因转录情况,在生物被膜态细菌中,与生物被膜形成相关的基因表达较活跃,如编码ABC转运蛋白相关的基因转录水平在生物被膜态细菌中升高,铜绿假单胞菌和加德纳菌也表现出这种现象。而参与代谢的基因(如与糖酵解相关的基因)和翻译的基因(如编码核糖体蛋白的基因)转录水平呈下调趋势,与表皮葡萄球菌和变形链球菌的报道一致,可能是由于生物被膜包裹着的细菌,其获得的营养成分和转录翻译所需的原材料有限,从而限制了其代谢和转录活动。这些信息为研究金黄色葡萄球菌生物被膜形成过程中代谢情况以及基因功能提供了重要的参考。
4 结 论
金黄色葡萄球菌在生物被膜态和浮游态的基因表达中呈现出显著的差异。这些变化可能与生物被膜态菌的持久性密切相关,同时可能与细菌毒性的发挥息息相关。生物被膜态和浮游态生物过程中的代谢差异可能对控制由金黄色葡萄球菌引起的感染有所帮助,此研究为了解金黄色葡萄球菌生物被膜形成的机理奠定了基础。
