肠道菌群失衡与药物性肝损伤的相关性研究
2022-08-26萨仁娜赵海珍
药物性肝损伤(DILI)是药物本身及其代谢产物综合作用导致的肝功能改变,相较于其他肝损伤缺乏明显的特异性,但具有潜在肝脏毒性,严重时可发展为肝衰竭甚至死亡,占爆发性肝衰竭的25%
。目前,临床缺乏治疗DILI的特效药物,该病发病机制与氧化应激及肠源性内毒素等有关。人体肠道内有大量微生物,其菌群分布易受环境因子影响,维持肠道微生态平衡对确保人体健康至关重要。进年来研究显示,DILI的发病过程中伴随有肠道菌群结构的改变,随着肠-肝轴研究的深入,肠道菌群与DILI关系的研究成为热点
。有研究表明,有效调节肠道菌群结构有助于缓解药物治疗所致的肝损伤
。故研究肠道菌群分布情况对DILI患者临床治疗有一定参考价值。本研究选取83例DILI患者为研究对象,探究其肠道菌群结构与肝损伤程度、生化指标等的关系,为DILI的防治提供可靠参考依据。
一方面,完善财务岗位的管理制度,注重财务人员专业素养提升。对于财务人员而言,岗位管理制度影响着个人的工作行为、理念和专业素养等各方面。新时代下,应当从财务岗位管理制度的完善入手,要求财务人员从计划管理、预算、决策和整理分析等方面提升加大学习力度,以逐步提升专业素养;
1 资料与方法
1.1 一般资料 经本院医学伦理委员会审批,选取2018年2月至2020年10月我院收治疗的DILI患者83例为研究对象。83例DILI患者包括男39例,女44例;年龄27~60岁,平均(43.64±3.94)岁;肝损伤程度:轻度型28例,中度型34例,重度型21例。另外选取病毒性肝炎、自身免疫性肝炎等非药物导致的肝损伤患者80例为对照组,其中男41例,女39例;年龄26~60岁,平均(45.56±3.17)岁。两组年龄、性别等一般资料比较无显著差异(
>0.05)。
1.2 纳入标准 ①符合DILI诊断标准
,用药后4周内出现肝损伤临床症状
,所用药物包括中草药、中成药、免疫抑制剂、抗肿瘤药及保健品;②年龄26~60岁;③均签署同意书。
1.3 排除标准 ①病毒性肝炎、酒精性肝病及自身免疫等其他原因导致的肝损伤;②合并胃肠慢性疾病、糖尿病及代谢综合征等影响研究结果疾病;③妊娠期妇女。
1.4 观察指标 分析所有受试者肠道菌群alpha多样性;比较两组受试者肠道菌群属于水平分布结构;比较两组受试者肝脏生化指标水平;计算肠道失衡指数(GDI),比较不同肝损伤程度GDI指数差异;分析肠道菌群失衡与各生化指标及肝损伤程度间的关系。
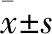
2.3 不同肝损伤程度与GDI指数的关系 三组患者GDI指数分别为-(6.23±0.87)、-(7.14±1.06)、-(10.26±2.07),三组患者GDI指数组间比较有显著差异(
<0.05)。
养殖户在养殖中应该密切观察牛的活动情况、身体状况以及精神状态等,若发现疑似结核病的牛,需要立即进行隔离治疗,向当地动物防疫监督机构报告疫情。该部门确认疫情后根据《动物疫情报告管理办法》及时上报后安排专业人员进行调查核实,并进行实验室诊断。
1.4.1 肠道菌群检测 样本采集:用采样管采集所有受试者粪便样本约1 g,将其快速放入微生物保存管,并转入冰箱,-80℃保存备用。
2 结果
2.4 两组患者肝脏生化指标水平 见表3。
1.4.3 肝脏生化指标检测 所有受试者空腹抽取5 ml肘静脉血,3 000 r/min 的转速离心10 min,分离血清-20℃保存待检。采用雅培c16000全自动生化分析仪及其配套试剂检测肝脏生化指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、白蛋白(Alb)、总胆红素(TBil)。

2.2 肠道菌群菌属丰富度差异 研究组患者肠球菌属、链球菌属、普氏菌属丰富度显著高于对照组,乳杆菌属、双歧杆菌属、梭杆菌属丰富度显著低于对照组,差异具有统计学意义(
<0.05);两组患者粪便样本中拟杆菌属丰富度比较差异无统计学意义(
>0.05)。见表2。
2.5 肠道菌群失衡与肝损伤严重程度、肝脏生化指标的相关性 部分肠道菌群失衡与肝损伤严重程度、肝脏生化指标呈显著相关性(
<0.05)。见表4。
1.4.2 检测方法 采用MasterPure DNA 纯化试剂盒(OMEGA,美国)抽提DNA,使用琼脂凝胶电泳技术测定DNA浓度及纯度;取30 ngDNA提取物,使用Phusion High-Fidelity PCR Master Mix体系(美国ThermoFisher公司)对V3~V5指定区进行PCR扩增,应用武汉华大基因公司的Illumina Miseq平台进行16S rDNA基因高通量测序,采用Ion Plus Fragment Library Kit 48 rxns(美国Thermo Fisher公司)建库。引物341F:5′-CCTAYGGGRBGCASCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′。应用北京奥维森基因科技有限公司的COPE软件统计样品序列数目,应用北京环中睿驰科技有限公司的QIIME序列分析软件,将序列聚类为用于物种分类的OTUs,结合物种组成信息结果,分析肠道菌群多样性。
2.1 粪便样本菌群多样性分析 见表1。

②外源性融资渠道狭窄。中小企业多采用债务融资方式。由于我国目前的金融管理体制仍比较严格,这种管制对金融机构主体资格做出了严格限制,并对各种业务准入实行审核批准制度,这些制度一定程度上抵挡了金融风险,但在一定程度上也挡住了大量资金进入融资领域限制了我国资本市场的正常发展,其后果就是资本供给不足、融资渠道单一。

3 讨论
引发DILI的药物有很多,其中抗结核药、中药、抗肿瘤药及抗微生物药等最容易引发DILI。正常生理状态下肠道菌群处于平衡状态,当受到疾病、药物不合理使用等机体内外因素刺激时,便会导致肠道菌群失衡。肠道菌群失衡与各种疾病存在紧密联系,肝脏生理状态受肠道菌群影响,而肠道菌群增值又受肝脏制约
。大量研究表明
,肝硬化患者使用抗生素会对肠道菌群产生重大影响,但DILI与肠道菌群关系的研究仍存在欠缺。
对于新加坡的中学生来说,经过小学阶段的洗礼,他们已经获得了足够的能力去了解这个世界,然而当前的世界,在历经科技革命之后,信息爆炸,各类资讯鱼龙混杂,难以分辨。
以往研究表明,肝脏疾病与肠道菌群存在紧密联系,菌群失调可以影响肝功能,肝脏疾病也可诱发或加重菌群失调,二者相互作用,互为因果
。药物导致肝损伤的研究较多,但有关此类患者肝损伤与肠道菌群失衡间关系的研究较少,大多数研究仅限于动物实验。邓红等
探究何首乌给药情况与肠道菌群分布间的关系,结果表明何首乌导致肝损伤大鼠存在不同程度的菌群失衡。本研究检测了83例DILI患者粪便中菌群分布情况,并与非药物导致的肝损伤患者肠道菌群菌群结构对比分析。结果证实,研究组粪便样本菌群Simpson指数较对照组显著增大,Shannon指数、Sobs指数显著减小,提示DILI患者肠道中菌群多样性下降,与以往研究结果相似。进一步分析其菌属分布结构,发现DILI患者肠道中乳杆菌、双歧杆菌及梭菌属等益生菌丰富度显著下降,而肠球菌属、链球菌属、普氏菌属等丰富度显著增大。双歧杆菌和乳酸杆菌是肠道主要益生菌,具有预防和维持肝功能作用。梭菌具有改善肝脏脂肪变性、修复肝细胞功能,降低血清ALT/AST等水平,进而发挥护肝作用
。长期使用利福平、异烟肼、乙胺丁醇等抗结核药是导致以上菌属水平下降的主要原因。GDI指数通过肠道中“有害菌”对“有益菌”的丰度差异来指征肠道菌群的失调情况,研究组GDI值显著大于对照组,且重度病例GDI指数较轻、中度高,说明随着DILI病情加重,其肠道菌群失衡情况也在加重。ALT、AST、ALP是肝脏生化实验主要指标,一般ALT或AST>40 U/L则表明肝功能异常。本研究中研究组ALT、AST、ALP、TBil及DBil水平处于较高水平,而对照组肝功能指标在正常范围内。经Pearson相关性分析,发现发现乳杆菌属、双歧杆菌属、梭杆菌属、链球菌属等与肝脏生化指标呈显著相关,说明肠道菌群参与DILI发病,肠道菌群失衡与DILI患者肝脏生化指标及疾病严重程度有紧密联系,与其他同类研究结果存在相似之处;分析原因,肠道菌群可通过诱导细胞自噬、抑制致病菌等途径发挥护肝作用,当受到药物不良反应等外界刺激时,肠道微生物环境发生改变,使其菌群结构随之发生巨大改变,与药物本身的副作用一起共同加重肝脏损伤。DILI患者肠道菌群主要表现为菌群多样性下降,乳杆菌、双歧杆菌属等益生菌丰富度下降,链球菌、肠球菌属丰富度上升。肠道菌群失衡指数GDI与患者肝脏生化指标及肝损伤严重程度呈显著相关性,说明肠道菌群变化可能参与DILI发病。
引物的设计与合成根据‘索邦’花蕾转录组数据设计引物MYB12(Clone)F和MYB12(Clone)R,根据获得的LhsorMYB12基因序列,利用Primer 5.0软件设计半定量PCR引物MYB12(RT-PCR)F和MYB12(RT-PCR)R(表1)。
本文只研究了DILI患者肠道菌群属水平与其他指标的关系,未进行种、科水平菌群分析,且未对其作用机制进行深入研究,这些内容有待进一步阐述。
[1] 杨雪, 涂荣芳, 杨晋辉. 药物性肝损伤的研究进展[J]. 临床肝胆病杂志, 2020,36(3):509-513.
[2] 李云鹏, 王新红, 张德凯. 肠道菌群失调对肝硬化的影响[J]. 临床肝胆病杂志, 2019, 35(4):193-196.
[3] 缪志敏,赖泳. 肠道菌群在药源性肝损伤中的作用及其保肝机制的研究进展[J]. 沈阳药科大学学报, 2020, 37(9):83-87.
[4] 成虹. 药物性肝损伤诊治指南解读[C].第四届中西医消化健康论坛资料汇编. 2016:28-45.
[5] 张丽丽, 胡建华. 中医药对慢性肝病肠道微生态的影响研究现状[J]. 北京中医药, 2019, 38(3):226-229.
[6] Bajaj JS, Acharya C, Fagan A,
. Proton pump inhibitor initiation and withdrawal affects gut microbiota and readmission risk in cirrhosis[J].Am J Gastroenterol,2018,113(8):1177-1186.
[7] Bajaj JS, Kakiyama G, Savidge T,
. Antibiotic-associated disruption of microbiota composition and function in cirrhosis is restored by fecal transplant[J]. Hepatology,2018,68(4):1549-1558.
[8] 王丹丹, 宋佳, 张晓岚. 肠道菌群在肝脏疾病中的作用[J]. 临床肝胆病杂志, 2019, 35(9):2120-2123.
[9] 邓红,吴纯启,赵春雪,等.高通量测序和实时荧光定量PCR分析何首乌肝损伤与肠道微生物组的关系[J].药物评价研究,2017,40(4):464-471.
[10] CHIU CC,CHING YH,LI YP,
. Nonalcoholic fatty liver disease is exacerbated in high-fat diet-fed gnotobiotic mice by colonization with the gut microbiota from patients with nonalcoholic steatohepatitis[J]. Nutrients,2017,9(11):1220-1229.
