Ag2C2O4催化剂的合成及其氧化乙苯制备苯乙酮应用研究
2022-08-25童庆军陈新华张忠洁陈祥迎
童庆军,范 磊,李 平,王 艳,陈新华,张忠洁,陈祥迎*
(1.安徽佳先功能助剂股份有限公司,安徽 蚌埠 233002; 2.合肥工业大学 化学与化工学院,安徽 合肥 230009; 3.安徽大学 材料科学与工程学院,安徽 合肥 230601)
苯乙酮是最简单的芳香酮,也是重要的化工原料,可作其他香料的中间体和药物中间体。工业制备苯乙酮的方法主要有傅克酰基化反应和乙苯直接氧化法两种,傅克酰基化反应由于产生废水废酸等问题逐渐被更绿色环保的直接氧化法取代[1]。在乙苯直接氧化反应研究中,以钴盐为主的催化体系一直是关注的焦点,这是因为钴盐的氧化还原电位高,有利于催化氧化反应的进行[2]。在典型的生产工艺中,乙酸钴作为氧化反应催化剂得到了广泛认可。然而乙酸钴在反应中容易结焦,催化效率有限,难以分离、回收等问题也是困扰企业的难点[3]。因此,开发不易团聚、高活性的催化剂是科研人员的重要目标。
为探索更易分离的催化剂,研究者将视线转向了非均相催化剂。Ag基催化剂因在贵金属中价格相对低廉,且显示出了相较于过渡金属更好的催化性能,受到广泛关注[4]。Narasimharao K等[5]将模板法制备的Fe2O3材料与一定浓度的硝酸银溶液浸渍,得到了Ag-Fe2O3纳米复合材料,实验表明,Ag的负载对材料的催化性能影响较大,Ag+分散于Fe2O3表面及内部孔道内,从而提升了材料的催化活性。Ma L等[6]以CeO2、AgNO3以及Na2CO3水溶液为原料,通过浸渍法制得了钠掺杂的Ag/CeO2纳米球催化剂,并将该催化剂用于甲醛低温催化氧化反应中,表现出较高的催化活性。
本文利用二水合草酸与硝酸银为原料,采用沉淀法制备Ag2C2O4材料,并将该催化剂用于乙苯氧化制备苯乙酮反应,考察反应温度、反应时间、催化剂用量、氧化剂类型等因素对乙苯氧化反应的影响。
1 实验部分
1.1 试剂与仪器
二水合草酸,分析纯,阿拉丁化学试剂有限公司;硝酸银,分析纯,罗恩化学试剂有限公司;乙苯,工业级,胶州市富田化工有限公司。
X射线衍射仪,X-Pert PRO MPD,荷兰帕纳科有限公司;同步热分析仪,STA449F5,德国耐驰仪器制造有限公司;X射线光电子能谱仪,XRF-1800,日本岛津有限公司;气相色谱仪,GC-9790 Plus,浙江福立分析仪器股份有限公司。
1.2 催化剂制备
分别取一定量二水合草酸与硝酸银于100 mL烧杯中,利用磁力搅拌及超声震荡使其分散均匀。然后通过恒压分液漏斗将硝酸银溶液滴入二水合草酸溶液中,搅拌使反应充分进行。反应结束后,将所得混合物抽滤、烘干即可得到产物Ag2C2O4。
1.3 乙苯氧化实验
量取100 mL乙苯于三口烧瓶中,加入一定量的Ag2C2O4催化剂。开启磁力搅拌,并保持搅拌速率为250 r·min-1,升温至所需温度后通入固定流速的气体作为氧化剂,持续反应一段时间。实验结束后,氧化液经过滤、碱洗、分液后,通过蒸馏分离,产物采用气相色谱仪检测分析。
1.4 分析方法
产物通过GC-9790 Plus气相色谱仪进行分析,色谱条件为:FID氢火焰检测器,量程1档;色谱柱为RB-inowax,30 m×0.32 mm×0.25 μm;载气为N2,流速1.0 mL·min-1,分流比40∶1,进样量0.2 μL;面积归一法定量计算。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD
图1为合成材料的XRD图。

图1 Ag2C2O4催化剂的XRD图Figure 1 XRD patterns of Ag2C2O4 catalyst
由图1可知,合成材料在17.27°、29.81°和32.46°具有三个明显的特征峰,与草酸银的标准卡片PDF-#22-1335基本一致[8]。同时其他峰的位置也与标准PDF卡片对应一致,所以制备的产物确定为Ag2C2O4材料且纯度较高。合成材料的特征峰峰型较为尖耸,表明制备的产物结晶度良好。综上所述,该制备产物为Ag2C2O4,且纯度较高,晶型较为完整,晶面生长有序程度较高。
2.1.2 TG
图2为Ag2C2O4催化剂的TG曲线。
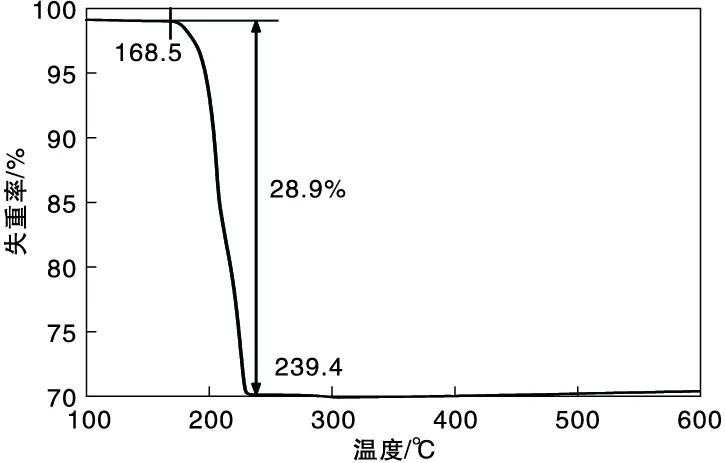
图2 Ag2C2O4催化剂的热重曲线Figure 2 TGA curve of Ag2C2O4 catalyst
从图2可以看出,Ag2C2O4催化剂失重过程只有一个,在(168.5~239.4) ℃之间,失重率为28.9%,这个失重过程对应着草酸银热分解。整个热分析过程中,样品失重后残留率为71.1%,通过计算可知,样品热分解得到的最终产物为金属银单质,这与草酸银分解的理论值相符[7]。Ag2C2O4催化剂虽然热稳定性较差,但在反应温度下,不会由于热分解导致其失活,这有利于催化剂的循环使用。
2.1.3 XPS
为检测Ag物种在材料表面的化学状态,利用X射线光电子能谱对样品进行检测,结果如图3所示。从图3可以看出,制得的Ag2C2O4催化剂中含有Ag、O、C元素[9];Ag2C2O4材料中的Ag 3d由Ag 3d5/2和Ag 3d3/2构成,其结合能峰分别在374 eV及368 eV处,这与文献[10-11]报道一致。由于单质银的结合能峰也在374 eV和368 eV处,无法对表面银的价态进行准确判断。但结合Ag2C2O4材料的热重分析可知,当样品热解温度高于160 ℃时,最后生成的样品为金属银单质,而在热解温度低于此温度时,材料仍为Ag2C2O4。说明样品在热解时,Ag+得电子变价成为了Ag。根据文献报道,此时Ag2C2O4的分解是由于草酸根离子有还原性,且Ag+有氧化性。在此过程中Ag+促进了C—C键的断裂,进而促进了草酸银分解[8]。由于Ag+被草酸根离子还原,生成CO2有利于反应正向进行,因此,Ag+被还原为Ag单质。

图3 Ag2C2O4催化剂的XPS图: (a)全谱图;(b)Ag 3dFigure 3 XPS spectra of Ag2C2O4 catalyst (a) Survey; (b) Ag 3d
2.2 反应条件对氧化反应的影响
2.2.1 反应温度
在乙苯用量100 mL、Ag2C2O4催化剂用量1.0 g、空气流速100 mL·min-1和反应时间24 h的条件下,考察反应温度对催化氧化乙苯制备苯乙酮反应的影响,结果如图4所示。由图4可知,当反应温度较低时,反应基本不会进行,随着反应温度升高,乙苯转化率与苯乙酮选择性均有提升。当反应温度为120 ℃时,苯乙酮收率有极大提高,此时乙苯转化率为12.47%,苯乙酮选择性为59.38%;当反应温度达到130 ℃时,经过24 h反应,过滤后得到的Ag2C2O4催化剂颜色由白色转变为淡棕色,可能有部分催化剂在氧化反应过程中发生了缓慢分解,导致催化剂变质;且反应温度大于130 ℃时,已接近底物乙苯的沸点(136 ℃),由于装置冷凝效果有限,乙苯蒸汽会不断逸散,对反应不利[12-13]。因此,选择反应温度120 ℃进行后续实验,此时乙苯的转化率为12.47%,苯乙酮选择性为59.38%。
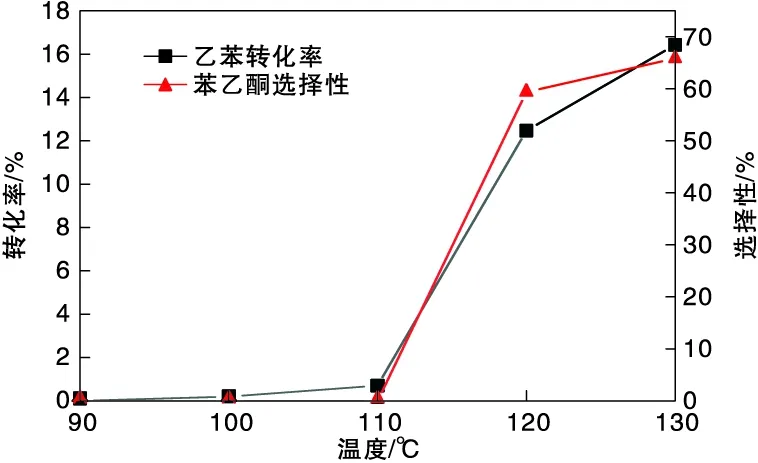
图4 反应温度对催化氧化乙苯制备苯乙酮反应的影响Figure 4 Effect of reaction temperature on catalytic oxidation of ethylbenzene to acetophenone
2.2.2 催化剂用量
在乙苯用量100 mL、反应温度120 ℃、空气流速100 mL·min-1和反应时间24 h的条件下,考察催化剂用量对催化氧化乙苯制备苯乙酮反应的影响,结果如图5所示。

图5 催化剂用量对催化氧化乙苯制备苯乙酮反应的影响Figure 5 Effect of catalyst dosage on catalytic oxidation of ethylbenzene to acetophenone
由图5可知,催化剂用量较少时,苯乙酮收率随催化剂用量增加而快速升高,当催化剂用量超过1.5 g时,苯乙酮收率提高不明显,反而会提高反应成本。因此,催化剂用量不能过低或过高[14],综合实验结果得到催化剂最佳用量为1.5 g,此时乙苯转化率为16.18%,苯乙酮选择性为65.39%。
2.2.3 反应时间
在乙苯用量100 mL、Ag2C2O4催化剂用量1.5 g、反应温度120 ℃和空气流速100 mL·min-1的条件下,考察反应时间对催化氧化乙苯制备苯乙酮反应的影响,结果如图6所示。由图6可知,反应初期,苯乙酮收率随反应时间增加而升高,并在36 h达到最大,此时乙苯转化率与苯乙酮选择性分别为18.29%和68.35%。反应时间超过36 h后,苯乙酮收率无明显增加,苯乙酮选择性略有降低,这可能是由于部分产物过氧化[15],因此选择最佳反应时间为36 h。

图6 反应时间对催化氧化乙苯制备苯乙酮反应的影响Figure 6 Effect of reaction time on catalytic oxidation of ethylbenzene to acetophenone
2.2.4 氧化剂类型
在乙苯用量100 mL、Ag2C2O4催化剂用量1.5 g、反应温度120 ℃、反应时间36 h和氧化剂气体流速100 mL·min-1的条件下,考察不同氧化剂对催化氧化乙苯制备苯乙酮反应的影响,结果如图7所示。

图7 不同氧化剂对催化氧化乙苯制备苯乙酮反应的影响Figure 7 Effect of different oxidants on catalytic oxidation of ethylbenzene to acetophenone
由图7可看出,氧化剂类型对反应影响较大,当氧源由空气改为氧气后,乙苯转化率与苯乙酮选择性有极大提高,乙苯转化率达到30.50%,苯乙酮选择性达77.67%。这是因为相同流速条件下,氧气氧化效率更高。但在实际生产中空气的获取较氧气更容易,且应用更方便、更安全。出于成本与安全性考虑,本实验中仍选择空气作为氧源。
图8为Ag2C2O4催化剂分别在空气和氧气中催化氧化乙苯产物的气相色谱图。图中各物质的出峰顺序依次为乙苯、苯乙酮以及1-苯乙醇,各峰分离度良好。
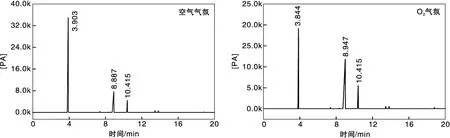
图8 Ag2C2O4催化剂催化氧化乙苯产物的气相色谱图Figure 8 The gas chromatogram of the product of catalytic oxidation of ethylbenzene by Ag2C2O4 catalyst
2.3 催化剂重复使用性能
制得的Ag2C2O4催化剂热稳定效果较好,在反应温度下不易发生分解导致催化剂失活。实验结束后,催化剂与产物通过离心、过滤分离,经洗涤、干燥、研磨后即可循环使用。回收后的催化剂再于最佳反应条件下重复试验(即反应温度120 ℃,催化剂用量1.5 g,反应36 h,气源为空气),其稳定性能如图9所示。

图9 Ag2C2O4催化剂的循环使用性能Figure 9 Recycling performance of Ag2C2O4catalyst
由图9可知,Ag2C2O4催化剂在前3次循环使用中,乙苯转化率与苯乙酮选择性基本维持不变。在3次循环后催化剂活性略有下降。乙苯转化率保持在15%左右,苯乙酮选择性保持在55%以上。
2.4 反应机理讨论
乙苯催化氧化反应是典型的自由基反应,在没有催化剂的存在时,由于反应能垒高,反应进行较为艰难。当有催化剂存在时,首先乙苯在Ag2C2O4催化剂表面被引发为乙苯自由基;随后乙苯自由基与空气或O2结合生成乙苯过氧自由基;接着在催化剂表面形成的过氧自由基会夺取底物中的α-氢,加快自由基反应过程,推动反应快速进行;最终乙苯氢过氧化物生成苯乙酮。本实验中,Ag2C2O4催化剂涉及的可能反应机理如图10所示。
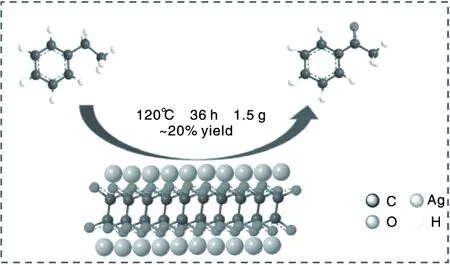
图10 Ag2C2O4催化剂的反应机理Figure 10 Reaction mechanism of Ag2C2O4catalyst
3 结 论
(1)以二水合草酸与硝酸银为原料,采用沉淀法制备了Ag2C2O4催化剂。通过TG、XRD、XPS等手段对催化剂进行表征分析,并将其用于乙苯氧化制备苯乙酮反应,产物通过气相色谱检测分析,确定了目标产物苯乙酮的生成。
(2)考察了不同因素对乙苯氧化制备苯乙酮反应的影响,结果表明,在反应温度120 ℃,反应时间36 h和催化剂用量1.5 g的最佳条件下,乙苯转化率与苯乙酮选择性最高。
(2)考察了催化剂稳定性,结果显示,催化剂在5次循环内催化效率没有明显减弱,表明催化剂稳定性较好。该催化体系有利于拓宽催化剂的选择范围,具有良好的工业化应用前景。
