单克隆抗体药物在医药洁净厂房的设计要点分析
2022-08-25樊恒达郭学涛
樊恒达,郭学涛
(上海汉智工程设计与顾问有限公司山东分公司,济南 250101)
癌症是危害人类健康的主要疾病之一,而抗体药物则是预防和治疗癌症的主要目标之一[1]。目前,已进行临床使用的肿瘤药物很容易出现敌我不分的现象,无法区分患者体内的健康细胞,有时甚至会同时杀死肿瘤细胞和癌症细胞[2]。“生物导弹”概念的出现,成为解决该难题的一个理想思路[1]。这种药物经过静脉注射到人体内,药效分子通过靶向作用,精确集中作用于肿瘤细胞,既可以增强疗效,也可以减少对机体产生毒副作用[3]。单克隆抗体由于具有良好的均一性和高度的特异性,因而在癌症治疗领域中得到了广泛应用。
1972年杂交瘤技术理念被科勒和米尔斯坦证明后,单克隆抗体的开发和应用,立即成为医学和科学研究的热点。传统的蛋白质免疫技术的程序是将体外合成和纯化抗原转入动物体内,产生免疫应答反应,而DNA免疫技术将带有目的基因序列的质粒DNA转入动物体内,外源基因序列在宿主细胞内得以表达并诱导机体免疫应答[4]。
DNA免疫可以诱导宿主产生免疫反应,尤其是抗原特异性抗体反应的分子机制,即单克隆抗体的诱导开发,包括DNA疫苗构建,递送方式,分子佐剂和DNA初免-蛋白质加强免疫等技术。
我国的抗体药物产业尚处于起步阶段,近10年,国内先后涌现出中信国健,百泰生物等多家专门从事单抗药物的生产企业,同时还有许多传统制药企业也加入到抗体药物研发领域,但是总体而言,在我国抗体行业,普遍存在的问题是细胞系表达水平低,培养规模小,纯化等技术问题,限制了我国抗体药物产业的产能规模,制约了行业的发展进程[5]。
1 单克隆抗体原液制备流程
1.1 单克隆抗体原液制备流程框图
单克隆抗体原液的生产工序包括:种细胞的复苏、细胞接种培养,细胞扩增培养,收获细胞培养液,粗纯液制备,精纯液制备,原液灌装,同时涉及培养基配置、缓冲液配置、质检等,如图1所示。
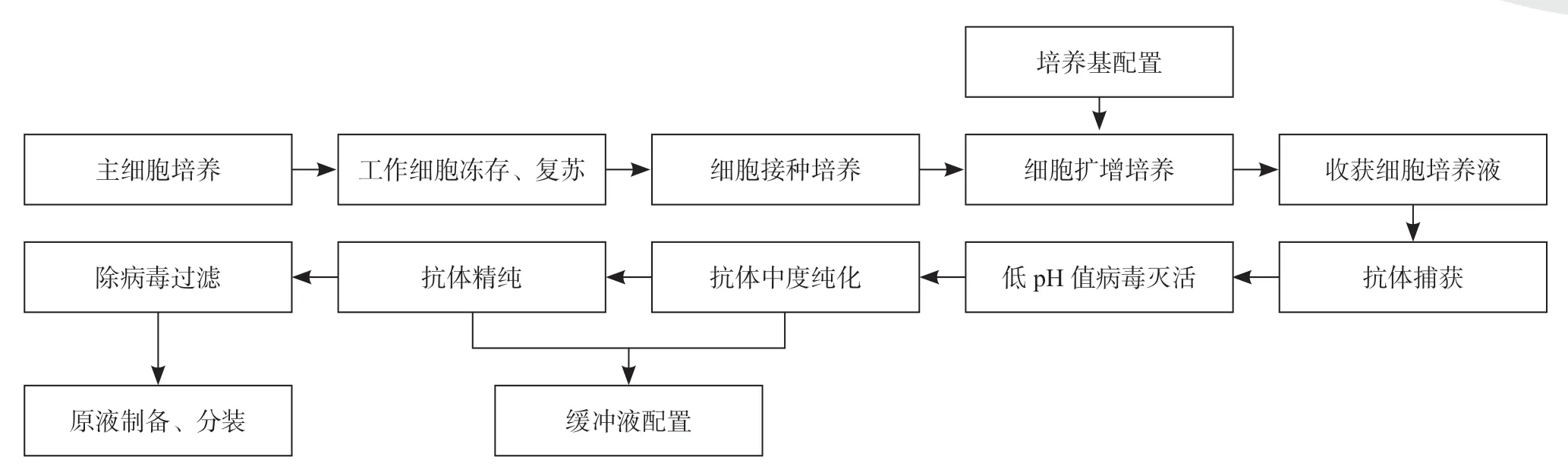
图1 单克隆抗体原液制备流程框图Fig.1 Flow chart of preparation of monoclonal antibody stock solution
2 单克隆抗体原液制备流程工艺解析
2.1 细胞培养基及缓冲液配置
细胞培养基主要分为基础培养基及补料培养基,前者用于为细胞提供生长所需的基本原料和环境的培养基,后者为细胞大规模培养阶段,为细胞生长补加必要的原料而配置的培养基。
缓冲液主要用于细胞收获及纯化阶段,包括碳酸氢钠溶液、葡萄糖溶液、磷酸缓冲液等。
配置前,确认配置操作区处于清洁有效期,设备已经经过CIP/SIP验证,按照批生产记录进行培养基及缓冲液的配置,将物料投入配制罐,经过定容、取样检测、检测渗透压、pH、细菌内毒素等参数,然后经过除菌过滤,将配置溶液转入暂存罐,供细胞培养及后续工序使用。在生产结束后,进行清场。
2.2 单克隆抗体培养与收获
2.2.1 种细胞复苏
将冻存在液氮或-70 ℃冰箱中的种细胞,浸入到37 ℃温水中,水浴解冻,使细胞恢复生长。
2.2.2 细胞接种培养
在生物安全柜的保护下,将复苏后的细胞接种至盛有细胞培养液的摇瓶中,然后放入恒温培养箱中,进行细胞培养,通过检测活细胞密度和细胞活率,达到转种要求才可以进行转种操作。
2.2.3 细胞扩增培养
在生物发酵罐中装入pH值电极、DO电极、温度电极,开启洁净压缩空气阀门,转入基础培养基,设计培养参数。启动转种程序,培养过程中,控制温度,空气、氧气、二氧化碳、pH、搅拌转速、溶氧等参数。培养过程中,每天取样检测活细胞密度、细胞活率、pH、溶氧、葡萄糖浓度、乳酸浓度、金属离子浓度、氨基酸浓度等参数。
细胞经过10~25 L wave、50 L、500 L种子生物反应器的扩增培养后,通过检测细胞悬液是否符合转种要求,转入2 000 L细胞生产罐中培养。
2 000 L细胞生产罐为产物表达和积累阶段,经过分批补料培养的方式进行细胞培养,同时每天取样检测活细胞密度、细胞活率、pH值、葡萄糖浓度等参数。根据检测结果,决定是否需要补料、补糖及消泡剂。
2.2.4 收获细胞培养液
当培养过程稳定,且检测结果达标后,可以结束细胞培养,收获细胞培养液。由于收获液中含有大量的培养基、细胞、细胞碎片等固体物质,需要采用连续流离心机、深层过滤方式进行固液分离。
在收获前,先降低反应器温度,关闭碱液管道,通过连续流离心机、深层过滤器处理后的上清液进入收获罐,当液面低于搅拌桨位置后,关闭温度、搅拌、pH值、溶氧控制,以及特气管道。
2.3 单克隆抗体分离纯化
单克隆抗体的纯化工艺一般采用三步纯化的策略,即捕获-中度纯化-精纯。
经典的工艺流程为:Protein A亲和层析、低pH值病毒灭活、阳离子交换层析、阴离子交换层析,或者复合模式色谱、除病毒过滤、超滤浓缩、除菌过滤后,即可获得抗体原液。
通常把亲和层析称为捕获工序、阳离子交换层析和阴离子交换层析称为中度纯化,超滤浓缩、除菌过滤为精纯,再加入相关辅料,即可制备成相对稳定的抗体原液。
2.3.1 亲和层析
亲和层析具有专一、高效的特性,一般使用亲和层析纯化后,抗体的纯度一般大于95%以上,收率在95%以上,所以在抗体纯化工艺中,一般使用亲和层析作为单抗的捕获工序。目前常用的纯化工艺包含使用Protein A设计的纯化工艺和使用非Protein A设计的纯化工艺。
Protein A亲和层析是利用抗体结构中的Fc区域可以特异性偶联结合Protein A蛋白,大部分杂蛋白无法结合层析介质,然后用低pH值洗脱液进行洗脱层析柱,收集粗纯抗体,达到纯化目的。
2.3.2 低pH值病毒灭活
因为在抗体生产中常用的CHO细胞系会分泌内源逆转录病毒样颗粒,这些颗粒不具备感染能力,为了安全,需要将这些病毒颗粒清除。在低pH值条件下,抗体质量稳定,但是脂包膜病毒会发生变性失活,在恒定pH值孵育一定时间后,达到灭活病毒的目的,而且HCP、DNA等杂质也会沉淀,去除部分杂质。
2.3.3 阴/阳离子交换色谱
利用等电点的差异分离蛋白。阴离子交换层析是因为病毒、HCP、DNA等杂质的等电点相对较低,酸性,在高pH值条件下,杂质会与层析介质结合,单抗的等电点较高,碱性,可以直接流穿,达到分离目的。
阳离子交换层析是采用单抗和层析介质结合,杂质、病毒与层析介质部分结合,利用不同离子强度或不同pH值的洗脱液进行洗脱、分离目的蛋白。
2.3.4 除病毒过滤
采用0.22 μm的滤膜进行纳滤,截留病毒颗粒、单抗流穿,达到去除病毒的目的。
2.4 原液制备
将经过除病毒过滤后的蛋白液收集,在隔离器内,加入蛋白稳定剂和赋形剂,制备成蛋白原液,然后分装到储存袋或储存桶内,2~8 ℃冷藏保存,待检。
3 生物安全性分析
单抗生产所用的细胞株为CHO细胞(中国仓鼠卵巢细胞),该细胞可以传上百代,在细胞培养过程中,内源蛋白分泌量极少,利于目标蛋白的分离纯化,因此CHO细胞是生物工程广泛使用的细胞,也是表达复杂生物大分子的理想宿主[6]。CHO细胞属于生物安全防护等级一级范围,对人体没有生物学危害[7]。
在生产过程中国,有活细胞存在的工序包含细胞接种,细胞扩增,细胞培养以及收获,没有活细胞的工序包含粗纯,精纯以及过滤分装,所以在工艺分区时,应将细胞活性区和非细胞活性区分开,同时,CIP系统也要单独设计。
4 污染源分析
治疗用生物制品的病毒污染源一般分为内源性病毒污染源和外源性病毒污染源。
4.1 内源性病毒污染源
工程细胞的来源,运输及保存过程可能导致病毒污染;工程细胞构建过程中,培养基、工器具、操作人员等均存在导致病毒污染的可能性;细胞在原始细胞库、主细胞库、工作细胞库的制备过程中也存在病毒污染的可能性。
4.2 外源性病毒污染源
主要包含物料、人员、房间环境、过程检测等。
物料控制包括使用受病毒污染的物料,例如试剂、培养基、色谱介质等;物料存储的隔离措施,即动物源性物料与常规非动物源性物料的隔离,否则会产生交叉污染;物料在仓储过程中被动物污染而引入病毒。
人员控制包括操作人员自身携带的病毒,以及未按照SOP操作导致的病毒污染。
环境控制包括房间洁净度无法保证;设备控制、清洁等无法保证;人流、物料、废物流的交叉污染以及共线生产的交叉污染。
过程检测包括中控检测和过程控制检测。
5 车间设计分析
5.1 人物流分析
目前对于生物类药品,人物流均采用单向流设计,其中人流全单向流和部分单向流,其中,部分单向流是指缓冲液配制间、培养基配制间等区域的人流,物流(含废物流)采用全单向流。单向流设计主要是采用双走廊设计设计理念,即从洁净走廊进,从污物走廊出。
人流,物流全单向流:人流(工作人员)和物流(原辅料,中间品,工器具,洁净衣服,废物等)从洁净走廊进入各个功能间,操作完成后,人流和物品退出到污物走廊,人流从退更房间退出,废物从功能间进入污物走廊,再通过废物处理间进行灭菌处理,传出生产区。需要循环使用的物品在污物走廊的清洗间进行清洗后,通过灭菌进入生产车间,进行循环使用。
人流部分单向流,物流全部单向流:人流(工作人员)和物流(原辅料,中间品,工器具,洁净衣服,废物等)从洁净走廊进入各个功能间,操作完成后,重要功能间(有生物活性的房间)的工作人员退出到污物走廊,其他辅助房间(即非活性房间,如培养基制备间,缓冲液制备间)的工作人员从原路返回。物流同人流,物流全单向流。
5.2 工艺区域分析
主要功能间有:细胞接种间,细胞培养/扩增间,收获间,目的蛋白收获/病毒灭活/精纯/病毒过滤间,超滤浓缩/除菌过滤间,无菌灌装间。
细胞接种间:洁净级别设计为C+A级别,房间设计为C级,使用生物安全柜;
细胞培养/扩增间:细胞扩增,培养,收获均为密闭操作,最低要求洁净级别设计为D级,建议设计为C级背景,房间设计10~25 L wave、50 L、500 L、2 000 L种子生物反应器、离心机、深层过滤装置,可以在一个房间完成,也可以分开设计,因为需要考虑培养结束后,需要马上进行清场,进行下一批产品的培养,同时生产线又在收获上一批产品,因为将培养和收获分开设计,可以提高车间的利用效率,在收获过程中,已经将细胞和细胞碎片除去,所以收获后的物流已经没有生物活性,而在收获前的区域均为生物活性区,所以宜分开设计。

图2 单克隆抗体原液车间平面布置图Fig.2 Monoclonal antibody stock solution workshop floor plan
目的蛋白收获/病毒灭活/精纯/病毒过滤间:收获后的工艺间洁净级别应设计为C级,房间设计收获罐、低pH值孵育器、阳离子层析和阴离子层析以及相应的接收罐。收获后的蛋白液首先进行目标蛋白的捕获,再进行目标蛋白的洗脱,为了防止原辅料(培养基,缓冲液等)对收获液产生的微生物污染,所以洗脱液在精纯前进行病毒灭活。
超滤浓缩/除菌过滤间:工艺间洁净级别设计为C级,压强与无菌灌装间相同,房间设计超滤系统、超滤循环罐、超滤上样罐。灭活后的洗脱液再经过纳滤过滤病毒后,得到超滤浓缩液,
无菌灌装间:工艺间洁净级别设计为C级,对于超滤浓缩除菌间,该工艺间宜设计相对正压,房间设计A级单向层流保护装置或隔离器。在层流保护下,将辅料添加到单抗原液中,并进行分装。因为超滤浓缩/除菌过滤工序与无菌灌装工序为无缝衔接的生产工序,建议将超滤浓缩/除菌过滤间与无菌灌装间设计为一个房间,或者将无菌灌装间设计为超滤浓缩/除菌过滤间的套间。
辅助房间:主要包括培养基配制间、称量间、缓冲液配制间、暂存间、CIP站、冷库等。其中培养基配制间、称量间、缓冲液配制间、暂存间的洁净级别均可设计为D级,房间为非活性区域,人物流不用设计为单向流。CIP站、冷库为一般区设计,冷库设计为2~8 ℃,用于存放待检原液。
5.3 空调系统分析:
根据GB 50457—2019《医药工业洁净厂房设计标准》、《药品GMP指南-厂房设施与设备》等规范,以及生产车间空调分区与防止交叉污染的原则,对生产车间进行分区。
在本案例中,将空调间放在车间的北侧,因为空调将从北侧取风,相对车间其他三个方向,北侧风的温度,湿度较为温和。在本案例中,空调系统共分九套,其中一套舒适性空调系统,八套净化空调系统,舒适性空调系统主要为车间的公用辅助系统,包含门厅、男更、女更、办公、制水、CIP站、工具间等;主细胞/工作细胞区域为一套净化空调系统;洁净走廊、人物流进入通道、培养基配制间、缓冲液配制间、暂存间、称量间、原液缓冲间为一套空调系统;细胞培养室一、细胞培养室二区域为一套空调系统;细胞扩增培养间、收获间、纯化间(蛋白捕获、病毒灭活、粗纯、病毒过滤)分别为一套空调系统;超滤浓缩除菌间和灌装间为一套空调系统、污物走廊、各个功能间的退出、灭菌间、人流退出通道为一套空调系统,另外,车间的冷库需要单独设计。
一般单克隆抗体项目没有活毒或有活性的病原微生物等有生物安全性的物质,在生产过程中,细胞培养区、细胞扩增培养区为细胞活性区,这些区域的空调系统建议按照全排风设计,将细胞活性物质全部排出该区域,避免危害到工作人员,排风系统经过高效过滤器处理后,排放到大气中。考虑到全排风系统需要较大的空气量,对能源的浪费较大,宜将经过高效过滤后的空气转入洁净空调的新风系统,重复利用,达到控制能耗的目的。其他非细胞活性区域的洁净空调系统可以按照回风设计。
5.4 公用工程系统分析:
车间需要纯化水、注射水、工业蒸汽、纯蒸汽、仪表气、无菌压缩空气、无菌氧气、无菌氮气、无菌二氧化碳、工艺冷冻水等公用工程系统。其中,CIP系统和工器具清洗主要用到纯化水和注射水,培养基和缓冲液的配置使用注射水,脉动真空灭菌柜、纯化水制备系统、注射水制备系统使用工业蒸汽,自动化仪表主要使用仪表气,SIP系统主要使用纯蒸汽,细胞培养,SIP后保压,物料转移等主要使用无菌压缩空气,细胞培养过程中溶氧的控制主要使用无菌氧气,无菌氮气,无菌二氧化碳,TCU控温主要使用工艺冷冻水。
由于CHO细胞培养一般需要培养连续一个月左右,不能出现故障,所以在单抗生产车间,公用工程的保障系统(生物反应器的供电、供气、制冷)设计尤为重要。所以在工程设计中,一般采用“一用一备”的原则,保证细胞培养的稳定性和可靠性。
供气系统:空压系统使用两台空压机,其中一台空压机作为备用;氮气系统也是使用两台制氮机,如果使用氮气瓶,需要将气体分布器设计为自控模式;氧气系统和二氧化碳系统一般使用气瓶,同时气体分布器设计为自控模式。
供电系统:关键设备采用双电源供电的方式,即市政供电和自备柴油发电机供电,两路电源经过双电源自动转换开关后接入UPS电源,UPS为车间内关键设备供电,由于柴油发电机过大,会造成业主成本过高,宜将主要工艺设备设计为UPS供电,当发生断电时,UPS电源可以保证柴油发电机启动时间内的供电(30~60 min),同时需要在该时间段内,自动或手动启动柴油发电机,保证关键设备的正常运行。
制冷系统:主要是使用7 ℃水,设计两套制冷系统,分别为工艺系统和空调系统使用,且这两套制冷系统可以互为备用,宜选用水冷机组,因为水冷机组优于风冷机组,且水冷机组出水温度稳定。
5.5 废水灭活分析
设计中需关注的问题是活性病毒区的给排水设计,依据GB 50015—2019《建筑给排水设计标准》,活性物质储罐及上下游工艺所需的自来水管线宜独立设置,并于支管处设置倒流防止器,软管连接的支管顶端设置真空破坏器,以防止活性废液回流污染。
依据GB 21907—2008《生物工程类制药工业水污染物排放标准》,涉及生物安全性的废水、废液等须进行灭活灭菌后才能进入相应的收集处理系统[8]。
单克隆抗体生产过程中所产生的活性废水主要由纯化区产生的高浓生产废液及细胞培养区排放的培养液,器具清洗水等。含有活性物质废水需经独立管道收集后接入高温蒸汽灭活罐进行灭活处理后方可排放,排水管道采用304不锈钢管,氩弧焊接。设备排水点与排水主管对接处采用密闭空气隔断装置,装置通气管应引至室外并设置0.22 μm滤膜,以保证洁净区内排水采用间接排水,同时防止活性废水排放时溅射及活性物质在空气中扩散,排水系统中不应设置地漏。
活性物质排水系统采用重力流排放,系统通气立管顶端于室外设置0.22 μm滤膜。通气管及连接各设备排水点支管末端应设置可独立关断的不锈钢阀门,以便于系统进行CIP冲洗。
高温灭活设备包含废液灭活罐,废液收集罐及CIP反冲洗装置,储罐容积按生产批次及灭活要求时间(20 min~2 h)进行计算,生产废水经收集罐收集后转入灭活罐,经高温灭活后冷却至40 ℃以下排入厂区污水处理系统;同时新排放的生产废水进入收集罐,进行下一批次灭活。
6 结束语
洁净厂房的设计需要综合考虑多方面的因素,需要在GMP,《建筑设计防火规范》、《洁净厂房设计标准》等国家法规的基础上,满足生产工艺流程,人员操作方便,车间建设的经济性、劳动成本、以及车间运行能耗等因素。
一个较完善的洁净厂房设计需要将人物流、机电安装等优化组合,同时污染源控制在最低限度内,同时需要提高生产效率。
随着我国生物制品类产品的迅速发展,对洁净厂房的要求越来越高,本文仅仅是个人理念的写照,还需要在实践中不断修正。
