下调miR-34a对PC12细胞阿尔茨海默病体外模型细胞凋亡和氧化损伤的影响
2022-08-25张丽覃雪何高见罗爱华高霞
张丽 覃雪 何高见 罗爱华 高霞
(1达州市中心医院老年病科,四川 达州 635000;2达州职业技术学院临床医学院;3达州市中心医院心身医学科)
阿尔茨海默病是一种慢性中枢神经系统疾病,其发病较为隐匿,主要表现为获得性知识障碍、记忆力减退,常常伴随有工作、生活等正常行为障碍〔1〕。阿尔茨海默病是仅次于心脑血管疾病、脑卒中、癌症之后的影响老年人生活质量的常见疾病,阿尔茨海默病已经成为世界范围内的热点问题〔2〕。阿尔茨海默病的病理学特征为神经元丢失、大脑皮质萎缩及β-淀粉样蛋白(Aβ)沉积形成老年斑等,目前阿尔茨海默病的发病机制还没有完全阐明,其中Aβ神经毒性研究较为透彻〔3〕。Aβ沉积产生的老年斑是阿尔茨海默病发生的重要原因。Aβ25~35是阿尔茨海默病发生的关键毒性物质,其可以诱导神经细胞氧化损伤,促进细胞凋亡发生〔4〕。研究显示,阿尔茨海默病还与miRNA的异常表达有关,miRNA参与影响神经细胞损伤过程〔5〕。miR-34a是一个在人体内广泛表达的小分子RNA,参与细胞生长、凋亡等过程〔6〕。以前的研究发现,miR-34a在阿尔茨海默病中表达上调,并且抑制miR-34a可以提高caspase-3活化水平,miR-34a在阿尔茨海默病中可能发挥促进作用〔7,8〕。本研究以PC12细胞为研究对象,用Aβ25~35处理构建PC12细胞阿尔茨海默病体外模型,探讨miR-34a在阿尔茨海默病神经细胞氧化损伤和细胞凋亡中的作用。
1 材料与方法
1.1材料 PC12细胞购自通派(上海)生物科技有限公司;p-蛋白激酶B(AKT)抗体购自美国Santacruze;Aβ25~35购自美国Sigma;inhibitor control、miR-34a inhibitor由上海吉玛制药技术有限公司合成;活性氧(ROS)水平检测试剂盒购自上海前尘生物科技有限公司;AKT抗体购自美国Proteintech;Lipofectamine 2000购自美国Invitrogen;超氧化物歧化酶(SOD)水平检测试剂盒购自碧云天生物技术有限公司;引物由广州伯信生物科技有限公司合成;谷胱甘肽过氧化物酶(GSH-Px)水平检测试剂盒购自北京雷根生物技术有限公司;活化的含半胱氨酸天冬氨酸蛋白水解酶(C-caspase)-3抗体购自美国Cell Signaling Technology。
1.2细胞分组及转染 PC12细胞分为空白对照组(Control)组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞分别在实验开始时用含有Aβ25~35浓度为20 μmol/L的细胞培养液培养,Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞分别为转染inhibitor control、miR-34a inhibitor的PC12细胞,细胞转染步骤完全按照Lipofectamine 2000转染试剂操作说明进行。
1.3实荧光定量(qRT)-聚合酶链反应(PCR)检测miR-34a表达 Control组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞培养24 h以后,收集细胞,在细胞中添加Trizol试剂,提取细胞中的总RNA,配制去除基因组DNA反应体系,包括:2 μl的5×gDNA Eraser缓冲液、200 μg总RNA、1 μl的gDNA Eraser,添加RNase free H2O至10 μl。在上述体系中添加1 μl PrimerScript RT Enzyme Mix I、3 μl的miRNA RT Primer、4 μl的5×PrimeScript缓冲液,添加RNase free H2O至20 μl,放在37℃孵育15 min,放在85℃孵育5 s,合成cDNA。配制PCR体系,包括:1 μl的cDNA模板、10 μl的SYBR Primer Ex Taq、0.4 μl的上游和下游引物,添加ddH2O至20 μl,PCR程序设置为:95℃预变性30 s;95℃变性5 s;60℃退火20 s,40个循环。根据反应得到的Ct值,按照2-△△Ct法计算miR-34a表达水平,内参为U6。引物序列为:U6上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′;miR-34a上游:5′-GGCAGTGTCTTAGCTGGTTGTA-3′,下游:5′-GTGCAGGGTCCGAGGT-3′。
1.4四甲基偶氮唑蓝(MTT)比色法检测细胞增殖 PC12细胞按照Control组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组分组方法接种到96孔板内,放在37℃,5% CO2培养箱中培养24 h。取出培养板,在每个孔中添加10 μl的MTT溶液,放在37℃孵育4 h。然后将孔内的上清溶液弃掉,添加150 μl的二甲基亚砜溶液,震荡反应10 min。酶标仪上测定每个孔450 nm OD值,以OD值代表细胞增殖能力。
1.5流式细胞术检测细胞凋亡 Control组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞培养24 h以后,收集细胞,用冰预冷以后的磷酸盐缓冲液(PBS)反复悬浮洗涤2次以后,在细胞中添加200 μl的Binding缓冲液充分混合,再吸取5 μl碘化丙啶(PI)及膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)溶液添加到细胞中,放在室温条件下结合孵育15 min,用流式细胞仪检测之前再添加300 μl的Binding缓冲液。
1.6Western印迹检测细胞中C-caspase-3、p-AKT、AKT蛋白表达 Control组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞培养24 h以后,收集细胞,添加RIPA蛋白裂解试剂,放在冰上裂解20 min,4℃,12 000 r/min离心10 min。收集上清溶液,用二喹啉甲酸(BCA)法测定提取蛋白浓度,放在-80℃保存备用。配制十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,分离胶浓度为10%,浓缩胶浓度为5%。在蛋白上样孔内添加30 μg的蛋白样品,蛋白样品在上样之前需要与等体积的电泳缓冲液混合煮沸5 min。设置电泳电压为100 V,电泳30 min以后,将电压设置为120 V,继续电泳2.5 h。取出凝胶,置于转膜缓冲液中浸泡5 min。将聚偏氟乙烯(PDVF)膜也浸泡在转膜缓冲液中。以400 mA的电流转膜50 min。取出NC膜,放在含有5%牛血清白蛋白的封闭液中孵育结合2 h,然后将NC膜放在含有1∶200稀释的C-caspase-3抗体、1∶600稀释的p-AKT抗体、1∶800稀释的AKT抗体中,放在4℃条件下孵育过夜。将PDVF膜置于1∶2 000稀释的二抗溶液中,在室温中孵育2 h。电化学发光(ECL)方法发光,分析条带的灰度值。内参为GAPDH,分析目的条带的表达变化。
1.7ROS、SOD、GSH-Px水平检测 Control组、Aβ25~35组、Aβ25~35+Anti-NC组、Aβ25~35+Anti-miR-34a组细胞培养24 h以后,收集细胞,分别用ROS、SOD、GSH-Px水平检测试剂盒检测ROS、SOD、GSH-Px水平,步骤完全按照试剂盒说明进行。ROS水平检测结果以Control组作为内参,分析相对荧光强度。
1.8AKT信号抑制剂对下调miR-34a的PC12细胞增殖、凋亡和ROS、SOD、GSH-Px水平影响 取转染miR-34a inhibitor后的PC12细胞,用含有Aβ25~35浓度为20 μmol/L和LY294002浓度为50 μmol/L的细胞培养液培养,计为Aβ25~35+Anti-miR-34a+LY294002组,以Aβ25~35+Anti-miR-34a组作为对照,细胞培养24 h后,MTT法检测细胞增殖,流式细胞术检测细胞凋亡,Western印迹检测细胞中C-caspase-3、p-AKT、AKT蛋白表达,试剂盒检测ROS、SOD、GSH-Px水平,步骤同上。
1.9统计学分析 采用SPSS21.0软件进行单因素方差分析。
2 结 果
2.1miR-34a inhibitor对Aβ25~35条件下PC12细胞中miR-34a表达的影响 与Control组(1.00±0.08)比较,Aβ25~35处理以后的PC12细胞中的miR-34a表达水平(1.90±0.12)明显升高(P<0.05);转染miR-34a inhibitor后的PC12细胞经过Aβ25~35处理以后,细胞中的miR-34a表达水平(0.75±0.06)较Aβ25~35+Anti-NC组(1.89±0.16)明显下降(P<0.05)。提示miR-34a inhibitor下调Aβ25~35条件下PC12细胞中miR-34a表达水平。
2.2miR-34a inhibitor对Aβ25~35条件下PC12细胞增殖和凋亡影响 Aβ25~35处理以后的PC12细胞增殖能力明显下降,细胞凋亡率明显升高,细胞中C-caspase-3蛋白表达水平明显升高(P<0.05);转染miR-34a inhibitor后的PC12细胞经过Aβ25~35处理以后,细胞增殖能力明显升高,细胞凋亡率明显降低,细胞中C-caspase-3蛋白表达水平明显降低(P<0.05)。见图1、图2、表1。提示miR-34a inhibitor提高Aβ25~35条件下PC12细胞增殖能力并减少细胞凋亡。
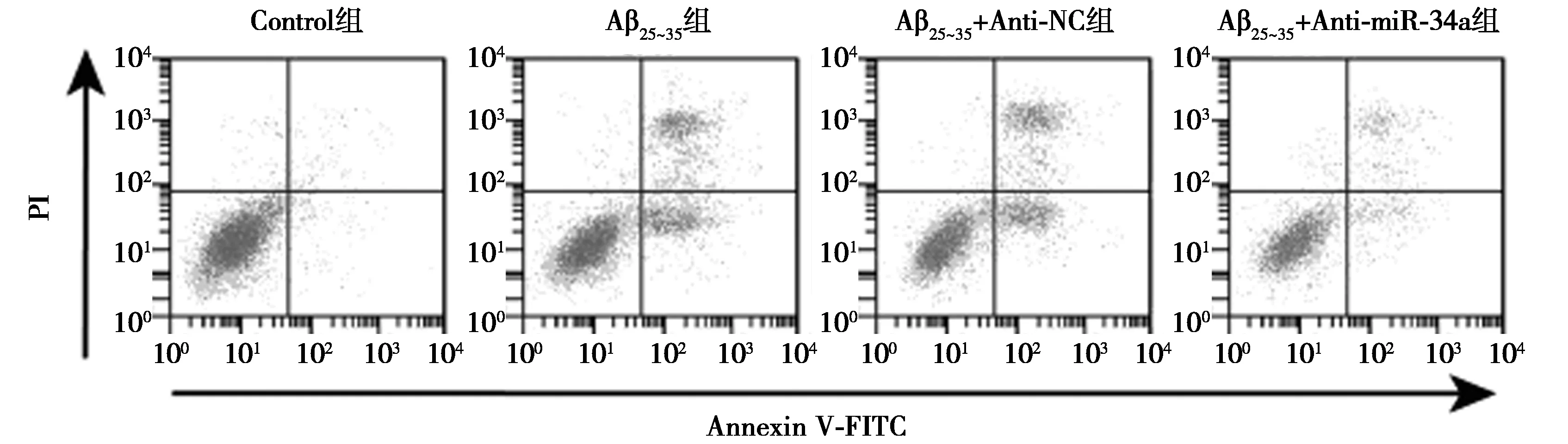
图1 流式细胞术检测细胞凋亡

1~4:Control组,Aβ25~35组,Aβ25~35+Anti-NC组,Aβ25~35+Anti-miR-34a组;图3同图2 Western印迹检测C-caspase-3蛋白表达
表1 各组PC12细胞OD值、凋亡率和 C-caspase-3蛋白水平比较
2.3miR-34a inhibitor对Aβ25~35条件下PC12细胞中ROS、SOD、GSH-Px水平影响 Aβ25~35处理以后的PC12细胞中ROS水平明显升高,SOD、GSH-Px水平明显下降(P<0.05);转染miR-34a inhibitor后的PC12细胞经过Aβ25~35处理以后,细胞中ROS水平明显降低,SOD、GSH-Px水平明显升高(P<0.05)。见表2。提示miR-34a inhibitor提高Aβ25~35条件下PC12细胞中抗氧化酶SOD、GSH-Px活性,减少细胞中ROS积累。
表2 各组PC12细胞中ROS、SOD、 GSH-Px水平比较
2.4miR-34a inhibitor对Aβ25~35条件下PC12细胞中AKT信号影响 Aβ25~35处理以后的PC12细胞p-AKT蛋白水平明显下降(P<0.05);转染miR-34a inhibitor后的PC12细胞经过Aβ25~35处理以后,细胞中p-AKT蛋白水平明显升高(P<0.05)。见图3、表3。提示miR-34a inhibitor提高Aβ25~35条件下PC12细胞中AKT信号激活水平。
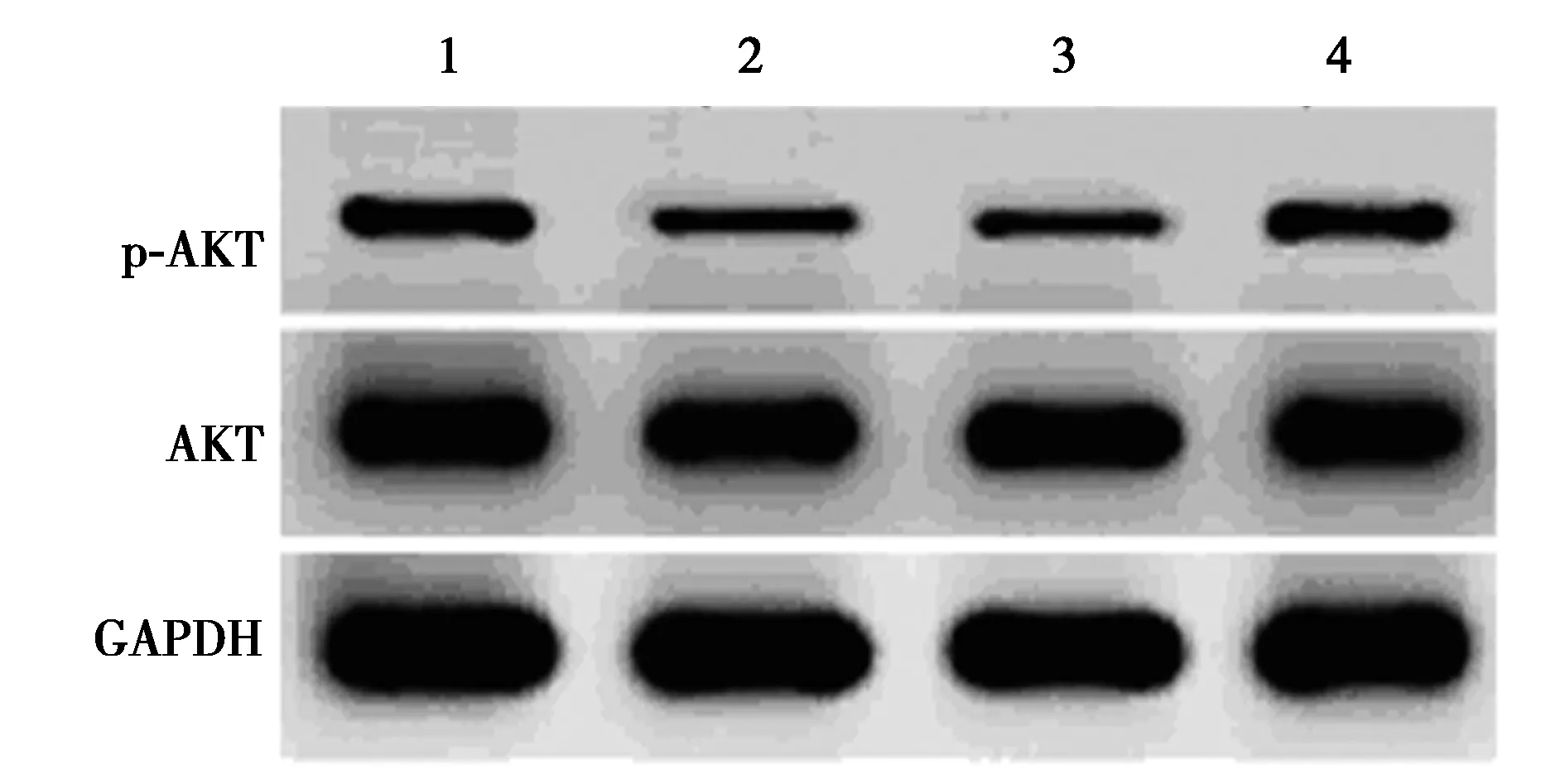
图3 Western印迹检测各组PC12细胞 p-AKT、AKT蛋白水平
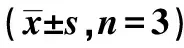
表3 各组PC12细胞中p-AKT、 AKT蛋白水平比较
2.5AKT信号抑制剂对miR-34a inhibitor激活Aβ25~35条件下PC12细胞中AKT信号的影响 AKT信号抑制剂处理后的转染miR-34a inhibitor的Aβ25~35条件下PC12细胞中p-AKT蛋白水平明显下降(P<0.05)。见图4、表4。提示AKT信号抑制剂减弱miR-34a inhibitor对Aβ25~35条件下PC12细胞中AKT信号激活作用。
2.6AKT信号抑制剂对miR-34a inhibitor影响Aβ25~35条件下PC12细胞增殖、凋亡和ROS、SOD、GSH-Px水平的作用 AKT信号抑制剂处理后的转染miR-34a inhibitor的Aβ25~35条件下PC12细胞OD值明显降低,细胞凋亡率明显升高,细胞中C-caspase-3蛋白水平明显升高,细胞中ROS水平明显升高,SOD、GSH-Px水平明显下降(P<0.05)。见图5、表5、图6。提示AKT信号抑制剂逆转miR-34a inhibitor对Aβ25~35条件下PC12细胞增殖、凋亡和ROS、SOD、GSH-Px影响。

1~2:Aβ25~35+Anti-miR-34a组,Aβ25~35+Anti-miR-34a+LY294002组;图6同图4 Western印迹检测两组PC12细胞 p-AKT、AKT蛋白水平
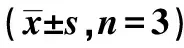
表4 两组PC12细胞中p-AKT、 AKT蛋白水平比较
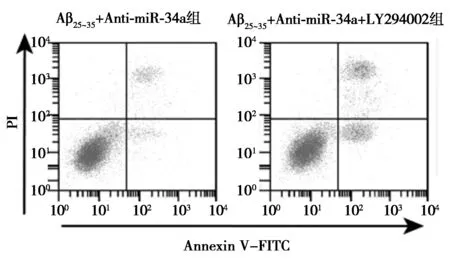
图5 流式细胞术检测两组细胞凋亡
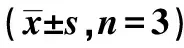
表5 两组PC12细胞OD值、凋亡率、C-caspase-3蛋白水平和ROS、SOD、GSH-Px水平比较
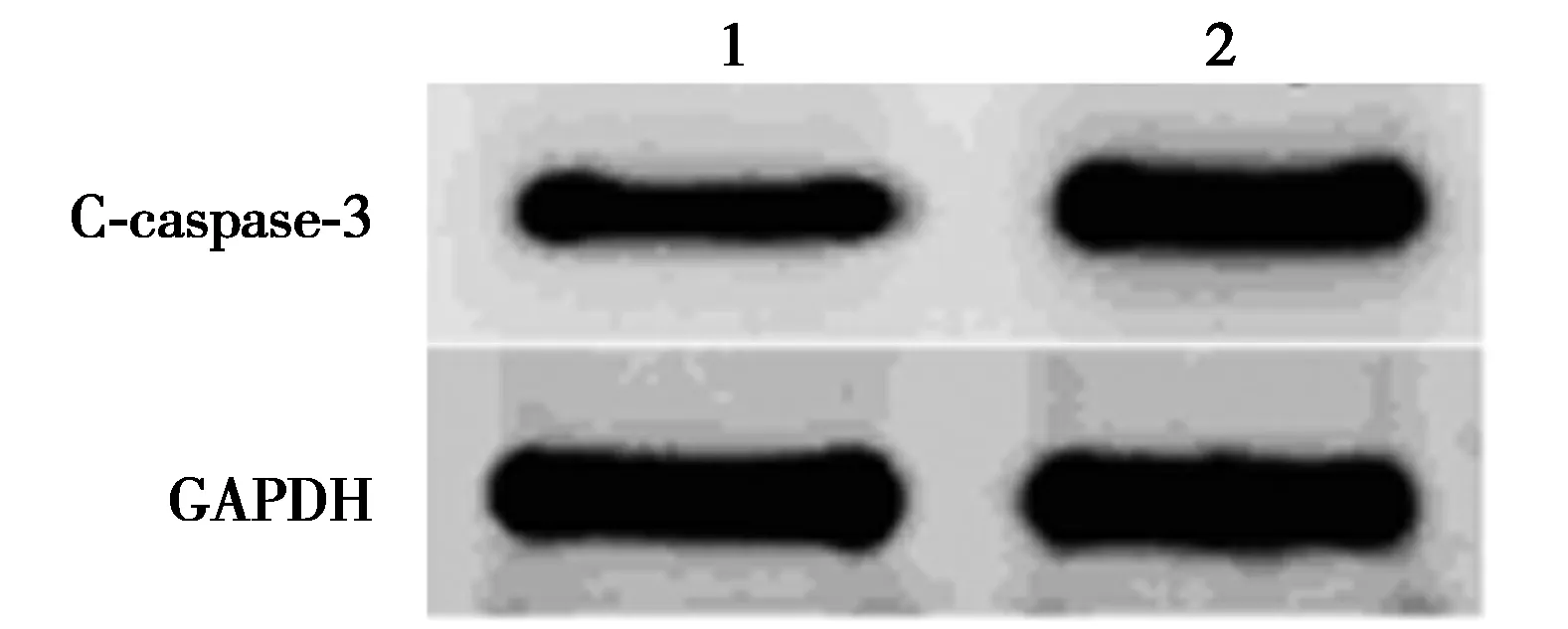
图6 Western印迹检测两组C-caspase-3蛋白表达
3 讨 论
Aβ是常用的体外研究阿尔茨海默病细胞模型诱导因子〔9〕。氧化损伤可以诱导细胞凋亡发生。研究显示,机体内的SOD、GSH-Px等抗氧化酶活性下降以后,细胞内的ROS不能被及时清除而聚集在细胞内,过量的ROS能够激活细胞内的caspase凋亡反应,诱导细胞凋亡发生〔10〕。caspase-3是caspase凋亡反应的下游因子,也是细胞凋亡的执行因子,其活化后形成C-caspase-3能够不可逆的诱导细胞凋亡发生〔11〕。本研究结果提示Aβ25~35诱导PC12细胞凋亡和氧化损伤,说明构建了PC12细胞阿尔茨海默病体外模型。
miRNA是一种非编码的RNA,其长度一般在20 nt左右,在自然界真核生物体内广泛存在〔12〕。miRNA功能多样,其参与不同类型细胞生长、凋亡、能量代谢、氧化应激等生理过程,miRNA是一个重要调控因子〔13〕。有研究报道显示,miRNA还与多种人类疾病的发生有关,miRNA可能是疾病治疗的分子标志物〔14〕。最近的研究显示,miRNA参与阿尔茨海默病的发生,其与神经损伤有关〔15〕。以前的研究发现,miR-34a在阿尔茨海默病中表达上调,并且下调miR-34a可降低caspase-3活化水平〔6,7〕。本研究结果说明下调miR-34a可以改善PC12细胞阿尔茨海默病体外模型损伤,这与上述研究结果相符合,均证实下调miR-34a可能具有改善阿尔茨海默病的作用。
AKT信号通路在人体内的多个生理以及病理过程中均发挥重要作用,其可以影响细胞的生长、代谢、凋亡、衰老等过程,AKT磷酸化水平升高后标志着AKT信号通路被激活〔16~19〕。研究显示,AKT在阿尔茨海默病中激活水平下降,并且抑制AKT信号通路促进Aβ25~35条件下PC12细胞凋亡和损伤〔20~22〕。本实验显示,AKT信号通路抑制剂可以逆转下调miR-34a对Aβ25~35条件下PC12细胞增殖、凋亡和氧化损伤的作用,提示下调miR-34a通过激活AKT信号改善PC12细胞阿尔茨海默病体外模型损伤。
综上,miR-34a在阿尔茨海默病中可能发挥促进作用,下调其表达可以减少PC12细胞阿尔茨海默病体外模型细胞凋亡,改善氧化损伤,作用机制与激活AKT信号有关。以后实验中应探讨miR-34a通过何种靶向调控机制影响AKT信号通路及细胞凋亡和氧化损伤。
