迷迭香酸对胃癌细胞SGC-7901增殖和凋亡的影响及机制
2022-08-25杨晓南丁玉忠杨桃李雪松褚斌
杨晓南 丁玉忠 杨桃 李雪松 褚斌
(武威市中医医院 1中医内科,甘肃 武威 733000;2普外科;3甘肃省肿瘤医院消化肿瘤内一科;4武威市中医医院胃镜室)
胃癌是消化系统常见的恶性肿瘤,但因临床表现隐匿,缺乏辨识度,大部分患者确诊时已进入中晚期〔1~4〕。尽管手术、放疗、化疗等治疗手段可抑制胃癌的病程,但仍有较大的毒副反应〔5〕,且预后效果不佳,患者5年生存率较低〔6〕。
迷迭香酸(RA)主要来源于迷迭香、薄荷、鼠尾草、百里香等植物中〔7〕。具有广泛的药理活性,抗氧化〔8~10〕、抗微生物〔11〕、抗炎〔12,13〕、抗病毒〔14〕、抗癌〔15〕等作用。鉴于前期学者研究显示,RA对多种癌细胞的抑制作用显著。本课题探讨RA对胃癌细胞SGC-7901生长、增殖、凋亡的影响及机制。
1 仪器与材料
1.1细胞 人胃癌细胞SGC-7901购自中国科学院上海细胞研究所。
1.2主要试剂 RA(美国Sigma公司);胎牛血清、RPMI1640培养基、青霉素-链霉素双抗(美国Gibco公司);胰蛋白酶、磷酸盐缓冲液(PBS)(北京谱析科技有限公司);抗胆囊收缩素细胞计数试剂盒(CCK8)试剂盒、二喹啉甲酸(BCA)蛋白定量检测试剂盒、低密度脂蛋白(LDL)试剂盒、丙二醛(MDA)试剂盒(南京建成生物工程研究所),活性氧(ROS)检测试剂盒(碧云天生物工程有限公司),放射免疫沉淀试验(RIPA)裂解液、磷酸化蛋白酶抑制剂、显影定影试剂、β-actin(武汉赛维尔生物科技有限公司)。
1.3主要仪器 Navios流式细胞分析仪,美国Beckman Coulter公司;酶标仪,美国Bio-Tek公司;细胞粉碎机,安拓思纳米技术(苏州)有限公司;ECO1.2超净工作台及CO2培养箱,美国Thermo Scientific公司;Ne0fuge15R台式高速冷冻离心机,Heal Force 力康仪器(上海)有限公司;DYCZ-24K型双板垂直电泳仪,北京六一生物科技有限公司。
1.4方法
1.4.1细胞培养 将胃癌细胞SGC-7901接种于培养基(含有10%胎牛血清、1%青链霉素双抗的RPMI1640),放置于37℃、5%CO2、饱和湿度的无菌培养箱中。后续试验中,取对数生长期细胞,并用0.25%胰蛋白酶进行消化处理。
1.4.2CCK8法测细胞活性 取对数生长期SGC-7901胃癌细胞,经消化离心后,加入培养液,以1×105细胞密度,接种于96孔板中,置培养箱24 h。加入10 μl不同浓度的RA溶液培养,浓度分别为0.00、0.25、0.50、1.25、2.50、5.00、10.00、20.00、40.00、80.00、160.00 μmol/L,设定3个平行组,48 h后,每孔加入10 μl的CCK8试剂,放置培养箱孵育2 h后用酶标仪(450 nm)测吸光度值(OD)。根据下列公式计算:细胞存活率=实验孔OD/对照孔OD×100%。
1.4.3BrdU检测细胞增殖 取对数生长期胃癌细胞SGC-7901,经消化离心后,加入培养液,以1×105细胞密度,接种于96孔板中,置培养箱24 h。加入10 μl不同浓度的RA溶液(0、10、20、40 μmol/L)培养48 h后,分别加入BrdR试剂,按照说明书进行操作处理。
1.4.4流式检测细胞凋亡 取对数生长期胃癌细胞SGC-7901,经消化离心后,加入培养液,以1×105细胞密度,接种于96孔板中,置培养箱24 h。加入10 μl不同浓度的RA溶液(0、10、20、40 μmol/L),每组设置3个复孔,培养48 h后,经低温离心、PBS洗涤,于4℃避光水浴染色5 min,1 h内用流式细胞仪检测。
1.4.5ELISA检测氧化应激标志物 取对数生长期胃癌细胞SGC-7901,经消化离心后,加入培养液,以1×105细胞密度,接种于96孔板中,置培养箱24 h。加入10 μl不同浓度的RA溶液(0、10、20、40 μmol/L),培养48 h后,分别依据试剂盒说明书步骤,配制测定孔及各种空白对照孔;将培养板置于酶标仪,测定450 nm吸光度,根据所测OD值分别计算LDL活力及MDA含量。
1.4.6荧光探针检测活性氧(ROS) 取对数生长期胃癌细胞SGC-7901,经消化离心后,加入培养液,以1×105细胞密度,接种于96孔板中,置培养箱24 h。加入10 μl不同浓度的RA溶液(0、10、20、40 μmol/L),培养48 h后,吸净清液,每孔中加入100 μl的H2DCFDA染液(5 μmol/L),放置于避光条件反应30 min后,激光扫描共聚焦显微镜检测细胞荧光强度,激发波长和吸收波长分别为488和490 nm。荧光强度越强,ROS水平越高。
1.4.7流式检测线粒体膜电位的变化 取对数生长期胃癌细胞SGC-7901,加入培养液,以1×105细胞密度,接种于6孔板,置培养箱24 h,加入不同浓度的RA处理(0、10、20、40 μmol/L),药物作用48 h后,收集细胞,经PBS重悬细胞、染色及过滤处理后,采用流式细胞仪检测。
1.4.8Western印迹检测相关蛋白表达 取对数生长期胃癌细胞SGC-7901,加入培养液,以1×105细胞密度,接种于6孔板,置培养箱24 h,加入不同浓度的RA处理(0、10、20、40 μmol/L),药物作用48 h后,用预冷的PBS洗涤,加入裂解液处理30 min,收集细胞,离心15 min(4℃,12 000 r/min),收集上清液。按照BCA试剂盒说明,进行蛋白定量。取样后进行聚丙烯酰胺凝胶电泳、转膜、封闭、洗膜、一抗、二抗处理后,加入显色剂进行检测。
1.5统计学处理 采用SPSS20.0软件进行方差分析。
2 结 果
2.1CCK8测定RA对SGC-7901细胞生长的影响 RA 10 μmol/L组细胞生长率〔(79.38±5.88)%〕,与对照组〔(100.00±4.90)%〕相比,RA对细胞生长的抑制作用较小,不具有显著性差异。随药物浓度的增加,自20 μmol/L开始〔20 μmol/L(52.92±8.82)%、40 μg/L(29.40±7.84)%、80 μmol/L(12.74±5.88)%、160 μmol/L(7.84±6.68)%〕,RA细胞生长的抑制作用增加,具有显著性差异(P<0.05)。由CCK8实验结果,选择0、10、20、40 μmol/L RA浓度,进行后续实验。
2.2BrdU检测RA对SGC-7901细胞增殖的影响 与对照组(RA 0 μmol/L)Brd U阳性细胞率(92%±6%)相比,除RA 10 μmol/L组(88%±6%)差异无统计学意义外,20、40 μmol/L组BrdU阳性细胞率均显著降低(42%±7%、17%±8%,P<0.05)。见图1。
2.3流式检测细胞凋亡 与对照组细胞凋亡率(4.7%±0.8%)相比,除RA 10 μmol/L组(5.0%±1.0%)差异无统计学意义外,RA 20、40 μmol/L组细胞凋亡率均显著升高(28.4%±4.1%、36.8%±3.3%,P<0.05),见图2。
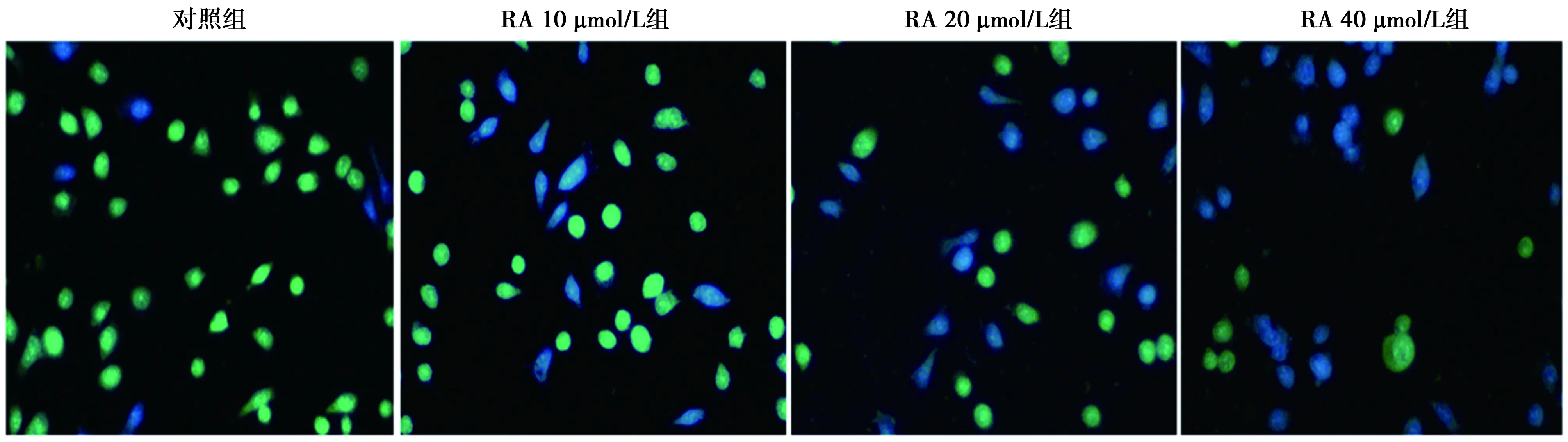
图1 不同浓度RA对SGC-7901细胞增殖的影响(BrdU染色,×200)

图2 不同浓度RA对SGC-7901细胞凋亡的影响
2.4ELISA检测氧化应激标志物 与对照组相比,除RA 10 μmol/L组差异无统计学意义外,RA 20、40 μmol/L组LDL、MDA水平显著增加(P<0.05),见表1。
2.5荧光探针检测ROS 与对照组(6±4)相比,除RA 10 μmol/L组(7±3)差异无统计学意义外,RA 20、40 μmol/L组荧光强度逐渐增强,ROS水平显著升高(29±6、76±9,P<0.05),见图3。
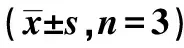
表1 各组SGC-7901细胞中LDL和 MDA含量比较

图3 不同浓度RA对SGC-7901细胞ROS的影响(免疫荧光染色,×200)
2.6流式检测线粒体膜电位的变化 与对照组〔(123.88±8.07)%〕相比,RA组(RA 10、20、40 μmol/L)绿色荧光细胞(红色荧光百分比/绿色荧光百分比)增加〔(20.96±4.77)%、(3.03±1.29)%、(1.28±0.78)%〕,其中20、40 μmol/L组促进线粒体膜去极化的效果显著(P<0.05)。
2.7Western印迹检测线粒体损伤标志物相关蛋白表达 与对照组相比,除RA 10 μmol/L组差异无统计学意义外,其余两组(RA 20、40 μmol/L)线粒体凋亡途径相关蛋白指标B细胞淋巴瘤-2相关X蛋白/B细胞淋巴瘤-2(Bax/Bcl-2)及活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved caspase)3/caspase3显著上升(P<0.05),见表2、图4。
2.8Western印迹检测核因子E2相关因子2/血红素氧合酶(Nrf2/HO)-1通路相关蛋白表达比较 与对照组相比,除RA 10 μmol/L组差异无统计学意义外,其余两组(RA 20、40 μmol/L)Nrf2/HO-1通路相关蛋白p-Nrf2/Nrf2、NAPDH醌氧化还原酶(NQO)1、HO-1表达均显著上升(P<0.05),见表3、图5。
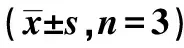
表2 各组SGC-7901细胞中线粒体损伤 标志物相关蛋白表达比较

1~4:对照组,RA 10 μmol/L组,RA 20 μmol/L组,RA 40 μmol/L组,下图同图4 不同浓度RA对SGC-7901细胞线粒体 损伤标记物相关蛋白表达的影响
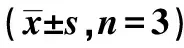
表3 各组SGC-7901细胞中Nrf2/HO-1 通路相关蛋白表达比较

图5 不同浓度RA对SGC-7901细胞 Nrf2/HO-1通路相关蛋白表达的影响
3 讨 论
胃癌是消化系统中常见的恶性肿瘤,发病机制受到多种因素的调控。与前期相比,胃癌的治疗水平有所提高,患者的预后得到一定程度的改善,但治疗效果仍不令人满意〔5〕。前期学者研究显示,RA对口腔癌〔16〕、乳腺癌〔17〕、肝癌〔18〕、直肠癌〔19〕等肿瘤细胞的生长和增殖具有抑制作用显著。本研究结果显示RA对细胞生长及增殖有抑制作用,与上述研究一致。
细胞凋亡是在复杂的分子生物学机制下,细胞受相关因子调控的自主死亡,对机体具有重要的生理学意义〔20,21〕。Xie等〔22〕的研究发现,通过抑制细胞生长与增殖,诱导癌细胞凋亡。本研究结果显示细胞凋亡率显著升高,与上述研究一致。因此,推断RA抑制SGC-7901细胞的生长及增殖,可能与调控细胞凋亡有关。
在生物体内,MDA是自由基作用于脂质发生过氧化反应的产物,反映脂质的过氧化程度及膜系统的受损程度〔23〕。载脂蛋白结合细胞外基质中负电性的蛋白聚糖引起LDL驻留在内膜〔24〕,而线粒体解联的呼吸链,会产生大量的ROS,氧化相关脂质物质〔25〕。本研究结果提示膜系统受损及细胞过氧化程度严重;荧光强度逐渐增强,ROS水平显著升高,说明发生氧化应激反应,结果与前面标志物水平吻合。因此,说明RA通过氧化应激反应,促进胃癌SGC-7901细胞凋亡。
线粒体转膜电位不平衡,其中高表达的Bcl-2及Bax能影响膜电位的耗散,导致膜穿透性的改变,线粒体表面发生聚合并形成孔道,使线粒体内的促凋亡因子和细胞色素C释放入细胞质引发凋亡〔26〕。caspase-3是细胞凋亡中重要的效应因子及主要执行者。其活化形式为Cleaved caspase-3,同样是细胞凋亡进入不可逆阶段的重要标志〔27〕。本研究与上述研究一致。因此,说明RA通过调控线粒体损伤相关指标水平,促进胃癌SGC-7901细胞凋亡。
Nrf2是调控细胞氧化应激反应的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节者〔28〕。NQO1及HO-1均是Nrf2调控的抗氧化因子。李慧等〔29〕研究表明,Nrf2/HO-1是诱导细胞凋亡的重要通路。本研究结果提示RA通过调控Nrf2/HO-1通路相关蛋白表达,促进胃癌SGC-7901细胞凋亡。
