Wnt/β-catenin通路介导的cSN50.1对高糖诱导HK-2细胞转分化的影响
2022-08-25栾海艳谭晶赵晓莲孙洁张国艳辛华
栾海艳 谭晶 赵晓莲 孙洁 张国艳 辛华
(佳木斯大学 1 基础医学院,黑龙江 佳木斯 154007;2微生态-免疫调节网络与相关疾病重点实验室;3附属第一医院)
据流行病学调查显示,我国65岁以上的糖尿病患者约为3 550万,占世界糖尿病老年患者的1/4,居全球首位〔1〕。老年糖尿病的特点是患者年龄较大、病程较长,罹患慢性并发症的风险和病情危重程度较高,其致残和致死率也较其他患者更高〔2〕。糖尿病肾脏病(DKD)是糖尿病最常见和最严重的并发症之一,且一旦出现,多数将发展成终末期肾病(ESRD),同时也是糖尿病致残致死的重要原因〔3,4〕。因此,如何有效防治糖尿病肾脏病已成为临床目前十分重要和急需解决的问题。本文拟分析人工合成的多肽cSN50.1对人肾小管上皮细胞HK-2转分化的影响及其作用机制。
1 材料与方法
1.1材料 细胞:人肾近曲小管细胞HK-2来源于北京北纳创联生物技术研究院。主要试剂:细胞培养用试剂均来源于美国HyClone公司、浙江天杭生物科技股份有限公司、上海碧云天生物技术有限公司;CCK-8细胞增殖及毒性检测试剂盒和XAV939〔β-连环蛋白(catenin)抑制剂〕、甘露醇、D-半乳糖均来源于大连美仑生物技术有限公司;α-平滑肌肌动蛋白(SMA)鼠抗人多克隆抗体,波形蛋白(Vimentin)、E-钙黏蛋白(cadherin)、β-catenin、组蛋白(Histone)、β-肌动蛋白(actin)兔抗人多克隆抗体均来源于Affinity Biosciences公司;辣根过氧化物酶标记的山羊抗兔IgG和山羊抗鼠IgG均来源于武汉博士德生物工程有限公司;Western印迹及蛋白提取所用相关试剂均来源于上海碧云天生物技术有限公司和武汉博士德生物工程有限公司;cSN50.1多肽由吉尔生化(上海)有限公司合成。
1.2细胞培养 把HK-2细胞置于5%CO2,37℃的培养箱,用含15%胎牛血清和1%青-链霉素双抗(100×)的DMEM培养液进行培养。当细胞生长至密度80%~90%时,用胰蛋白酶消化,按1∶3进行传代。
1.3CCK-8细胞增殖实验 将处于对数生长期的HK-2细胞消化后调整浓度至1.0×105个/ml,按100 μl/孔接种至96孔板,待其完全贴壁后,随机分为0、10、30、50 μmol/L组,弃去培养液,分别给予相应浓度cSN50.1进行干预48 h,再加入CCK-8溶液10 μl/孔,培养箱中继续孵育4 h;全自动酶标仪检测各孔的光密度值(450 nm 波长)。
1.4细胞形态观察实验 将HK-2细胞消化后分为6组:对照组、HO组、HG组、cSN50.1各剂量组(10、30、50 μmol/L),对照组采用正常DMEM培养液进行培养,HO组采用含24.5 mmol/L甘露醇的DMEM培养液进行培养,HG组采用含高糖的DMEM培养液(25 mmol/L D-半乳糖)进行培养,cSN50.1各剂量组分别采用含10、30、50 μmol/L cSN50.1的高糖培养液进行培养48 h,再于倒置显微镜下观察记录各组HK-2细胞的形态变化情况。
1.5Western印迹实验 将HK-2细胞分为5组:对照组、HO组、HG组、XAV939组和cSN50.1组。对照组、HO组、HG组培养条件同前,XAV939组采用含1 μmol/L的XAV939高糖DMEM培养液进行培养,cSN50.1组采用含30 μmol/L cSN50.1的高糖DMEM培养液进行培养(cSN50.1剂量由前述实验结果选出),培养48 h后,采用Western印迹技术检测各组HK-2细胞的蛋白表达情况。细胞总蛋白采用含1 mmol/L PMSF的RIPA裂解液提取后用于检测α-SMA、Vimentin和E-cadherin蛋白表达情况;采用亚细胞结构胞核与胞质蛋白抽提试剂盒分别提取HK-2细胞的胞质和胞核蛋白后检测其β-catenin蛋白的表达情况。二喹啉甲酸(BCA)法检测已提取蛋白的浓度,95℃5 min进行蛋白加热变性。按照每孔20 μg蛋白上样,12%分离胶行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);恒流200 mA进行湿转;室温条件下用5%的脱脂奶粉封闭1 h,再加入适宜比例的一抗,4℃过夜孵育。次日,用TBST洗液洗膜3次,室温孵育相应的二抗1 h;再次TBST洗膜3次,电化学发光(ECL)显影,采用凝胶成像分析系统曝光、拍摄和分析。细胞中α-SMA、Vimentin和、E-cadherin蛋白和胞质β-catenin蛋白的表达结果以目的蛋白与β-actin灰度值的比值来表示其相对含量,胞核β-catenin蛋白的表达结果以目的蛋白与Histone灰度值比值来表示其相对含量。
1.6统计学分析 采用SPSS22.0统计软件进行t检验。
2 结 果
2.1cSN50.1对HK-2细胞增殖的影响 与0 μmol/L组(3.72±0.03)相比,10 μmol/L组和30 μmol/L组OD值(3.73±0.06、3.77±0.11)均无明显变化(P>0.05),而50 μmol/L组(2.34±0.24)明显降低(P<0.05)。
2.2cSN50.1对高糖诱导HK-2细胞形态的影响 对照组和HO组均呈“铺路石”样的典型上皮样细胞形态;无明显差异;HG组细胞变为长梭形,且大小和形态不一;给予cSN50.1干预后,10、30、50 μmol/L组长梭形细胞均明显减少,但50 μmol/L组细胞数量有所减少。见图1。

图1 各组细胞形态(×100)
2.3cSN50.1对高糖诱导HK-2细胞中α-SMA、Vimentin和E-cadherin蛋白表达的影响 与对照组相比,HO组细胞中α-SMA、Vimentin和E-cadherin蛋白表达均无明显变化(P>0.05),HG组α-SMA和Vimentin蛋白表达均明显增高,而E-cadherin蛋白表达明显降低(P<0.05)。给予XAV939干预后,与HG组相比,XAV939组α-SMA和Vimentin蛋白表达均明显降低,E-cadherin蛋白表达明显增高(P<0.05);给予cSN50.1干预后,与HG组相比,cSN50.1组细胞中α-SMA和Vimentin蛋白表达均明显降低、E-cadherin蛋白表达明显增高(P<0.05)。见表1,图2。
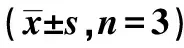
表1 各组细胞中α-SMA、Vimentin、E-cadherin和β-catenin蛋白表达
图2 各组细胞中α-SMA、Vimentin和 E-cadherin蛋白表达
2.4cSN50.1对高糖诱导HK-2细胞中胞核内外β-catenin蛋白表达的影响 与对照组相比,HO组胞质和胞核中β-catenin蛋白表达无明显变化(P>0.05),而HG组表达均明显增高(P<0.05)。与HG组相比,给予XAV939干预后,胞质和胞核中β-catenin蛋白表达明显降低(P<0.05);而给予cSN50.1干预后,β-catenin蛋白表达在胞质中无明显变化(P>0.05),但在胞核中明显降低(P<0.05)。见表1,图3。
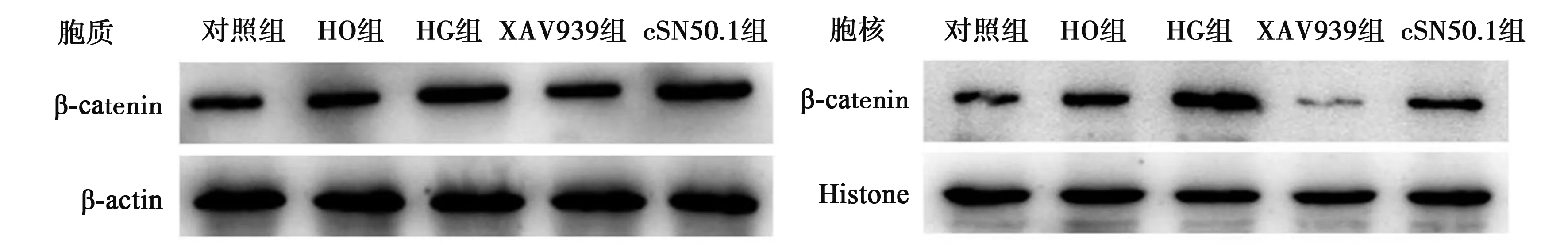
图3 各组细胞中β-catenin蛋白的表达
3 讨 论
肾小管间质纤维化(TIF)是早期糖尿病肾脏病的病理变化之一,当糖尿病患者尿白蛋白排泄率还处于正常范围内时,作为早期肾小管间质病变的敏感生物标志物的肾损伤分子(KIM)-1就已经显著升高,且增高程度与肾小管病变程度呈正相关〔5〕。肾小管间质纤维化不但在糖尿病肾脏病的发病时间和机制上均具有独立性〔6,7〕,还是所有肾脏疾病发展至终末期肾衰竭的共同特征之一。且其发生发展过程中的最关键环节是肾小管上皮细胞-间充质转分化(EMT),此时的小管上皮细胞已丧失了黏附特性,其表皮黏附分子E-cadherin的表达降低〔8〕,而间充质细胞表型蛋白α-SMA和Vimentin的表达则上升〔9〕,导致细胞外基质(ECM)大量堆积,细胞因子出现异常表达。本研究发现高糖诱导HK-2细胞中的α-SMA和Vimentin蛋白表达增高,E-cadherin蛋白表达降低,与相关研究报道一致〔10〕。
β-catenin是一种细胞骨架蛋白,是Wnt/β-catenin信号转导通路中的关键性分子,在多种病因诱发的肾间质纤维化中均发挥重要作用〔11~13〕。β-catenin可与E-cadherin在细胞膜上结合形成细胞黏附连接复合体,通过介导同型细胞之间的黏附,来维持正常上皮细胞的完整性和极性,从而防止细胞迁移发生。当Wnt信号转导通路被异常激活时,E-cadherin/β-catenin复合体将发生解聚,使细胞的黏附能力降低;同时胞质内游离的β-catenin则因为不能被及时磷酸化降解,大量在胞质内积聚,并被转运入胞核内与TCF/LEF转录因子(TCF/LEF)结合,引起下游的致EMT和纤维化的靶基因表达增强,继而肾小管上皮细胞基底膜被破坏,细胞发生转分化和迁移,进而导致肾小管间质纤维化的发生和发展〔14,15〕。本研究结果表明Wnt/β-catenin信号转导通路可能参与了高糖诱导的HK-2细胞转分化。
cSN50.1是一种人工合成的细胞核转运调节肽(NTM),为26 或28 个氨基酸片段连接的多肽,由人类成纤维细胞生长因子-4 疏水区信号序列(SSHR)和人核因子(NF)-κB1核定位序列组成。核转运蛋白(importin)能识别胞质内中大分子量蛋白中的核定位信号(NLS),与之结合后形成复合物,再经核孔复合体(NPC)把其运输到细胞核内,家族成员包括importin α和importin β,可以单独或联合起来完成核转录因子的入核转运〔16,17〕。有文献报道,cSN50.1能与importin α5和importin β1结合,竞争性抑制importin对核转录因子的入核转运〔18,19〕。而importin β1又可以调控胶质瘤细胞中β-catenin的入核转运〔20〕。本研究结果提示,cSN50.1能够改善高糖诱导HK-2细胞转分化,且该作用可能是通过调控β-catenin入核转运,进而影响EMT相关因子表达实现的。
