高剂量维生素D3对进展期胃癌术后合并营养风险患者营养状态、肠道菌群和应激炎性反应的影响
2022-08-25刘艳玲杨玉霞杨玉敬
刘艳玲 杨玉霞 杨玉敬
1 河南省鹤壁市人民医院急诊科 458030; 2 河南省肿瘤医院疼痛康复与姑息医学科; 3 河南省肿瘤医院普外科
我国胃癌患者中有60%~80%处于进展期,一经确诊,绝大多数需手术治疗。手术是一种强烈应激,其通过心理上的惧怕、生理上的创伤直接影响身心和肠道组织功能重建,进而降低蛋白质、矿物质及维生素的吸收和代谢,最终导致患者营养不良,严重影响患者术后康复效果。术后给予患者维生素D3治疗,维生素D可充分与维生素D3结合调节细胞的增殖、分化、存活、凋亡等多种生物功能,可有效预防胃癌进一步发生发展。本文旨在观察标准剂量、高剂量维生素D3对进展期胃癌术后合并营养风险患者的疗效。
1 资料与方法
1.1 一般资料 选取我科2019年10月—2020年5月收治的97例进展期胃癌术后合并营养风险患者,按随机数字表法分为对照组和观察组。对照组48例,男27例,女21例,平均年龄(51.01±4.79)岁;观察组49例,男29例,女20例,平均年龄(51.53±4.82)岁。两组一般资料对比差异无统计学意义(P>0.05)。纳入标准:所有患者均符合胃癌诊断标准[1],具备胃癌根治术手术指征,NRS-200评分≥3分,患者知情。排除标准:伴有风湿免疫系统疾病、甲状腺功能亢进疾病,对本研究药物过敏者。
1.2 方法 两组患者均给予术后短期肠外营养支持,术后第1天开始全肠外营养支持,连续治疗5d,以“全合一”方式经过颈内静脉置管进行输注,输注时间为12~16h,脂肪乳占30%~40%,蛋白质以1.5~2.0g/(kg·d)补充,非蛋白热量为30kcal/(kg·d),热氮比为150∶1。对照组在此基础上给予标准剂量维生素D3(国药控股星鲨制药有限公司,H35021450)口服治疗,400IU/次,1次/d。观察组在营养支持基础上给予高剂量维生素D3口服治疗,4 000IU/次,1次/d。两组均治疗3个月。
1.3 观察指标 (1)营养状态:采集患者空腹静脉血,用酶联免疫吸附法(ELISA)检测25羟维生素D[25(OH)D],采用免疫比浊法检测白蛋白(Alb)、血钙(Ca)水平,采用全自动血细胞分析仪检测血红蛋白(Hb)水平。(2)肠道菌群:采集两组患者粪便标本,采用细菌三级鉴定法对细菌鉴定至菌属水平,比较两组患者双歧杆菌、肠球菌、大肠杆菌数量。(3)应激炎性反应:抽取患者空腹静脉血,采用免疫层析法检测血清C反应蛋白(CRP),采用ELISA检测白细胞介素-6(IL-6)、皮质醇(Cor)水平。

2 结果
2.1 两组治疗前后营养状态对比 治疗后观察组25(OH)D、Alb、Ca、Hb水平高于对照组(P<0.05)。见表1。
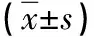
表1 两组营养状态对比
2.2 两组治疗前后肠道菌群对比 治疗后观察组双歧杆菌数量略高于对照组,肠球菌、大肠杆菌数量略低于对照组,但差异无统计学意义(P>0.05)。见表2。

表2 两组肠道菌群对比
2.3 两组治疗前后应激炎性指标水平对比 治疗后观察组CRP、IL-6、Cor水平低于对照组(P<0.05)。见表3。
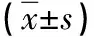
表3 两组应激炎性指标水平对比
3 讨论
进展期胃癌患者机体在肿瘤的负荷作用下,三大营养物质代谢吸收均会发生异常变化,再加上外科手术治疗后对机体的创伤及术后禁食、胃肠减压等均会增大患者机体的分解代谢,进而加重其营养不良状况,增大术后发生营养风险。本文结果显示,治疗后两组肠道菌群数量均有改善,但组间无明显差异,提示经标准剂量维生素D3或高剂量维生素D3联合短期肠外营养支持治疗纠正患者肠道菌群紊乱效果相当。短期肠外营养支持通过静脉输注给予脂肪、矿物质、碳水化合物、蛋白质等营养物质,可分解出大量脂肪酸被肠道黏膜细胞利用,发挥降低肠道pH值、保护肠道黏膜屏障的作用,防止肠道内细菌移位,进而调节肠道菌群紊乱,促进肠道功能恢复。维生素D3是人体必需的营养素,其通过维生素D受体相结合可诱导胃癌肿瘤细胞信号传导和基因调控的瀑联效应,进而抑制肿瘤细胞增殖,刺激其自噬和凋亡,在抗肿瘤机制中发挥重要作用。维生素D对维持患者正常肠道功能具有重要作用,通过补充不同剂量维生素D3可增大肠道内乳酸杆菌和双歧杆菌等有益菌的表达,增强肠道黏膜上皮细胞间相连的蛋白稳定性,降低肠球菌、大肠埃希菌数量,有效纠正肠道菌群失调现象,有助于胃肠功能恢复。经标准剂量维生素D3治疗仍存在血钙降低现象[2],相较于高剂量维生素D3,其使大量蛋白尿丢失造成血液中CABP、DBP等相关载体蛋白随尿液排出体外,进而使肠道对钙的吸收降低并出现低蛋白症,影响进展期胃癌患者预后效果。
本文结果显示,治疗后观察组25(OH)D、Alb、Ca、Hb水平优于对照组,提示经高剂量维生素D3联合短期肠外营养支持可改善营养状态,提高机体内25(OH)D水平。短期肠外营养支持通过静脉系统输注营养物质,可增大患者机体摄入大量的氮和热量,纠正机体负氮平衡状态,降低了手术创伤后高代谢和应激反应,促进肠道对营养物质的充分吸收,进而改善患者营养状态。在患者术后给予标准剂量维生素D3治疗,可促进营养物质的吸收,提高营养状态,而钙敏感受体(CASR)是调节血钙的关键因素,胃癌患者机体内血钙水平轻微的波动均会被CASR感知,并对其产生调节作用,当血钙水平降低时,CASR可经减低自身活性促使改调定点上移,但其对血清游离钙难以调节,并当血液钙水平降到一定程度CASR的调节作用会受到严重损害,进而影响患者对营养物质的吸收,营养状态改善效果不显著[3]。进展期胃癌术后患者给予高剂量维生素D3治疗,其代谢产物主要包含骨化三醇[1,25(OH)2D3]和阿法骨化醇[1α-(OH)D3],通过与维生素D受体相结合,维生素D3可增加患者胃肠道对钙、镁、铁和磷酸盐等营养素的吸收,可提高抵抗力,减低血液内铁调素浓度调节铁循环,进而缓解贫血症状,提升25(OH)D水平,有效改善营养状态[3]。
本文结果显示,观察组CRP、IL-6、Cor水平均低于对照组,提示经高剂量维生素D3与短期肠外营养支持联合治疗,可有效降低进展期胃癌术后患者机体应激炎症反应。维生素D缺乏在胃癌患者中非常普遍,而对于给予标准剂量维生素D3治疗的患者而言,通过作用于维生素D受体上,可调节巨噬细胞、T淋巴细胞、树突细胞等免疫细胞的分化、增殖过程,减少了炎症因子的释放与分泌,但人体细胞在维生素D3的激素刺激作用下会产生明显的耐受性,特别是T细胞分泌多种白细胞介素的功效不足,促使细胞功能下降,对降低患者机体炎症应激反应效果欠佳。相较于标准剂量维生素D3,高剂量维生素D3可通过减少Nephrin蛋白的丢失,减少足细胞的脱落等作用来减少尿蛋白的生成,并抑制炎症细胞浸润、减少炎性因子分泌、下调肾素—血管紧张素系统(RAS)等机制来保护胃肠道功能;同时长时间服用高剂量维生素D3其生成的代谢产物1,25(OH)2D3可调节肠道基因和生理稳态环境,进而提高宿主对病原微生物的防御能力,减少有害菌的大量滋生,减低机体炎症应激反应[4]。
综上所述,高剂量维生素D3联合短期肠外营养支持治疗进展期胃癌术后合并营养风险患者,可有效降低机体应激炎症反应,调节肠道菌群,改善营养状态。
