丁二酸和4-氨基安替吡啉构筑的Co(II)配合物与DNA之间的相互作用
2022-08-25李小芳冯小强马金霞
李小芳,冯小强,马金霞
(天水师范学院 化学工程与技术学院,甘肃 天水 741001)
1 前 言
DNA 是抗癌试剂中的主要靶向分子,抗肿瘤药物、抗疟疾药物以及抗菌素都是以DNA 为作用标靶来设计的[1]。药物分子发挥药效的能力与嵌插结合DNA 的作用方式及作用程度有关。为了克服顺铂类抗癌药物毒副作用大、易产生耐药性等缺点,研发新型、高效和低毒副作用的金属配合物类抗肿瘤药物受到了国内外学者的广泛关注[2-3],金属配合物在临床、分析和工业上有着广泛的应用,并在许多领域发挥着重要的作用。
钴元素是许多生理活动的基本元素,在许多金属蛋白中都存在。钴配合物的设计合成、生物活性以及与DNA 之间的作用方式研究,对明确配合物的生物效应及某些抗肿瘤药物机理都具有十分重要的意义[4-5]。卢静等[6]以8-氨基喹啉、钴离子为原料,合成的配合物[Co L2](ClO4)3CH3CH2OH (L=8-(2-甲基吡啶)-氨基喹啉)具有较好的化学核酸酶活性;郑德论等[7]以羟基乙酸(GA)和1,10-邻菲咯啉(phen)作为配体,合成的Co(GA)2(phen)·2 H2O 具有化学核酸酶活性,能对质粒体超螺旋DNA 产生切割作用;宋玉民等[8]合成的配合物[Co(phen)3]3+与DNA 之间存在插入作用;张永坡等人合成了喹啉类单核钴配合物[Co L(H2O)3]·H2O 与CT-DNA 之间存在嵌插键合,以H2O2作为诱导剂能切割DNA,切割机理为氧化切割[9]。
考虑到丁二酸的良好配位功能,及4-氨基安替吡啉衍生配体及其金属配合物的结构表征数据尚鲜见报道,本研究以丁二酸、4-氨基安替吡啉为配体,合成了一种Co(II)为中心离子的三元配合物,以鲱鱼精DNA 为靶点,通过紫外吸收光谱、循环伏安法和DNA粘度滴定实验,探讨了该配合物与鲱鱼精DNA 之间相互作用的方式,并测试了配合物对金黄色葡萄球菌(St.aureus)的抑菌性能。
2 实 验
2.1 材料与仪器
AAP(分析纯);CoCl2·6 H2O(分析纯);SA(分析纯);鲱鱼精DNA(Sigma产品);金黄色葡萄球菌(St.aureus,ATCC 26113),牛肉膏蛋白胨培养基,琼脂培养基。
UV-2450紫外可见光谱仪;CHI660B型电化学工作站;FTIR-650傅里叶变换红外光谱仪。
2.2 配合物的合成
用30 m L 无水乙醇溶解0.30 g SA,并加入NaOH 溶液调节其p H 值至5.0~6.0。用15 m L 无水乙醇溶解0.52 g AAP,然后将上述SA 和AAP混合后在60 ℃水浴中恒温搅拌10 min,少量多次加入0.60 g CoCl2·6 H2O 继续恒温回流6h,抽滤,用无水乙醇洗涤沉淀数次,干燥至恒重,得到丁二酸-4-氨基安替吡啉-钴配合物。将Co(II)配合物溶于N,N-二甲基甲酰胺(NMF)中,测得其摩尔电导率Λm=0.154 S·m2·molˉ1,说明配合物在NMF中不电离,是以中性分子形式存在,属于非电解质;元素分析理论值:C 56.32,H 5.71,N 8.57;实测值:C 56.64,H 5.63,N 8.62;UV-Vis(DMF),λmax/nm:209,254,293;IRmax:3387cmˉ1(υO-H/H2O),1636 cmˉ1(υC=N),1383 cmˉ1(υC-O),547 cmˉ1(υM-O),466 cmˉ1(υM-N)。
2.3 配合物与鲱鱼精DNA之间的相互作用表征
紫外吸收光谱测定:在参比池和样品池中分别加入等体积的N,N-二甲基甲酰胺和配合物溶液,扫描测定其紫外吸收光谱,之后,用等量的1 mg/m L DNA分别滴定参比池和样品池,作用5 min后,再扫描测定其紫外吸收光谱。
粘度测定:固定DNA 浓度为0.5 mg/m L,以不同的比例R(Ccomplex/CDNA)加入配合物,恒定温度25 ℃,反应24 h,测定混合溶液的粘度,得到(η/η0)1/3与配合物浓度的关系。其中η为加入配合物后DNA溶液的粘度,η0为加入配合物前DNA 溶液的粘度。
采用循环伏安法表征“相互作用”:采用三电极体系,工作电极为玻碳电极,对电极为Pt片电极,辅助电极为甘汞电极,以Na Ac-HAc(p H=6.0)缓冲溶液为底液,在ˉ0.6~1.2 V 电位范围内扫描。
2.4 抑菌活性测定
先将受试菌种St.aureus接种于固体琼脂培养基,活化后用接种环挑取菌苔于生理盐水中,制成O.D610nm=0.2的菌悬液备用。同时,将受试菌种接种于固体琼脂培养基,37 ℃下St.aureus活化48 h后,用接种环挑取菌苔于生理盐水中,制成O.D610=0.224的菌悬液备用。接着取直径为6 mm 已灭菌的圆滤纸片分别浸泡在浓度为0.2 mg/m L的SA、AAP及配合物溶液中。最后将上述0.1 m L菌悬液涂布在培养基平板上,用无菌镊子取处理过的滤纸片,贴于培养基上,每皿贴3片。以DMF 作为空白对照。37 ℃恒温培养,测定圆滤纸片的抑菌圈直径。
3 结果与讨论
3.1 配合物与鲱鱼精DNA之间的相互作用
3.1.1 紫外吸收光谱表征 当小分子中加入DNA 后,倘若吸收光谱出现减色效应和红移现象,则说明小分子与DNA 之间发生了嵌插作用,且减色程度能反映插入试剂与DNA 结合的强度与能力[11]。如图1所示:配合物原位于209.5 nm 和254 nm 处的吸收峰,吸光度分别为1.575 和1.215,在加入500μL DNA 后吸收峰波长分别蓝移至204.8 nm 和241.2 nm处,吸光度下降至1.285和1.069。但是,原位于283 nm 处的吸收峰红移至288.6 nm 处,红移了5.6 nm,吸光度由0.903下降至0.674,减色25.4%。根据紫外吸收光谱的变化,初步推断配合物与DNA之间发生了相互作用。

图1 DNA 加入前后配合物的紫外-可见吸收光谱Fig.1 UV absorption spectra of complex addition DNA before and after
根据摩尔比法,以DNA 的浓度对254nm 处的吸光度作图,得图2。图2(a)所示结合比n(DNA)∶n(配合物)=1∶1。为了定量比较配合物与DNA 的结合力,以1/(A0ˉA)~1/CDNA作图,得线性拟合方程1/(A0ˉA)=0.882+2.21/(CDNA),在室温下配合物与DNA 的结合常数为3.770×103L·molˉ1,如图2(b)所示。
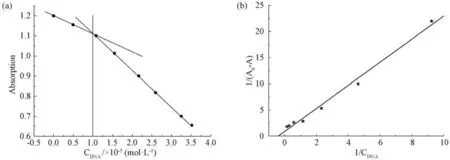
图2 配合物-DNA 体系的摩尔比图(a)和双倒数曲线(b)Fig.2 Molar ratio plots(a)and double reciprocal plots(b)of complex-DNA system
3.1.2 循环伏安法表征 在ˉ0.6~1.2 V 电位范围内扫描,发现配合物在玻碳电极上有电化学行为,如图3(a)所示。当扫描速率为1.8 V/s时,在配合物0.5867 V 和ˉ0.0461 V 处出现两个氧化峰,峰电流分别为ˉ3.084×10ˉ4A 和ˉ1.918×10ˉ4A。通过改变扫描速率,发现氧化峰电流随扫描速度的不断增大而增大,氧化峰电位也随之发生正移。在实验设定的扫描范围内(ˉ0.6~1.2 V),通过绘制Ipa~υ图,发现氧化峰电流与扫描速度呈现良好的线性关系,线性回归方程为:Ipa=ˉ0.839ˉ1.434υ(R=0.976),如图3(b)所示,表明配合物在玻碳电极上的电化学行为主要是由吸附过程控制的[10]。
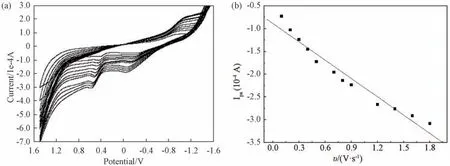
图3 扫描速率对配合物循环伏安曲线的影响(a)及Ipa~υ曲线(b)Fig.3 Effect of scan rate on the CV curves of complex(a)and Ipa~υrelationship curve(b)
固定扫描速率为0.5V/s,以Fe(CN)63ˉ/4ˉ为电化学活性物质,在ˉ0.6~1.6 V 范围内扫描其循环伏安曲线,结果如图4所示。Fe(CN)63ˉ/4ˉ在0.515 V/ˉ2.822×10ˉ4A 处出现了氧化峰,加入一定量的DNA 后,氧化峰正移,还原峰负移至0.231 V/3.384×10ˉ4A,往DNA/Fe(CN)63ˉ/4ˉ体系中加入400μL配合物后,其氧化峰正移至0.612 V,还原峰负移至0.1304 V,电流分别下降至ˉ2.431×10ˉ4A 和3.086×10ˉ4A。Bard[12]提出,当小分子与DNA 发生作用时,如果峰电位向负方向偏移,说明小分子与DNA 之间存在静电作用;反之,如果峰电位向正方向偏移,说明小分子与DNA 之间存在嵌插结合作用。由图4可知,在加入DNA 后配合物的氧化峰电位不断正移,还原峰电位不断负移,电位差逐渐增大,即ΔEp增大,表明配合物与DNA 是以嵌插方式发生相互作用。

图4 含配合物的Na Ac-HAc缓冲溶液中的K 4 Fe(CN)6在DNA 电极上的循环伏安图Fig.4 CV curves of K4 Fe(CN)6 in Na Ac-HAc buffer solution containing complex
3.2 抑菌活性测定
3.1.3 DNA粘度法表征 已有相关文献报道[13],当具有适当大小平面结构的配合物与DNA之间发生嵌插结合作用后,能使DNA 解螺旋,从而增加了DNA 螺旋链的长度,最终表现为DNA黏度的增大;当两者以静电、沟面结合等非插入方式产生相互作用时,溶液的粘度无明显变化;以部分插入方式与DNA 产生相互作用时,则可能使双螺旋发生扭结,使其粘度减小。配合物对DNA粘度的影响如图5所示,随配合物的加入及其浓度的增加,导致DNA的相对黏度增大,表明配合物以嵌插方式与DNA 相结合,这与上述的紫外光谱法以及循环伏安法表征结果相一致。

图5 配合物对DNA 粘度的影响Fig.5 Influence of complex on DNA viscosity
通常以抑菌圈直径的大小作为抑菌效果的评定指标,抑菌圈直径越大,则抑菌剂对供试细菌的抑制效果越好,反之则抑制效果越差。以DMF 作为空白对照样,其对St.aureus没有任何抑菌效果。配体和配合物对St.aureus的抑菌圈照片如图6所示,可以看出,SA、AAP和配合物分别作用于St.aureus后,均具有明显的抑菌圈,并且配合物的抑菌圈直径大于单一的两种配体。实验数据说明了配合物对St.aureus的生长具有较好的抑制作用,与金属络合可以增强配体的活性。金属钴离子可称为“超级酸”,与有机物SA 和AAP配位后,金属的正电荷部分与配体中的供体原子共享,并且在配体上方有一个电子离域整个螯合环,分子表面的正电荷密度增加,增强了将聚阳离子吸附到带负电荷的细菌表面的能力,从而显示出较强的抑菌效果。

图6 AAP(a)、SA(b)和配合物(c)作用于St.aureus的抑菌照片Fig.6 Inhibition zone of SA,AAP and complex against St.aureus
4 结 论
配合物中加入DNA 后,其吸收峰出现明显的减色和红移,且减色和红移程度与DNA 加入量呈正相关,配合物与DNA 形成1∶1的复合物,结合常数为3.77×103L·molˉ1;配合物中加入DNA 后,其氧化还原峰的峰电位也发生正移,峰电流减小;DNA 的粘度随配合物的加入而增大。因此,可以判断配合物以嵌插方式与DNA 发生了相互作用,采用抑菌圈法研究发现配合物的抑菌活性大于单一的两种配体。其体内、体外抗肿瘤活性以及药效学性质尚待进一步研究。
