太子参参须多糖对小鼠OVA蛋白的免疫佐剂作用研究
2022-08-24甘思言杜蓥蓥张炎达黄一帆王全溪马玉芳
曾 丽,甘思言,杜蓥蓥,乔 石,张炎达,黄一帆,王全溪*,马玉芳*
(1.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002;2.福建省兽医中药与动物保健重点实验室(福建农林大学),福建 福州 350002;3.福建贝迪药业有限公司,福建 宁德 355399)
中药含有多种免疫调节成分,具有较好的免疫调节作用。随着研究的深入,越来越多的植物提取物被应用于疫苗中作为佐剂,其成分包括多糖、皂苷、黄酮和异黄酮、多酚等[1-2]。太子参参须多糖(Radix pseudostellariae fibrous roots polysaccharide,RP-FRP)是从太子参(Pseudostellaria heterophylla)参须中提取的活性成分,已有研究表明,RPFRP 能够提高动物机体的免疫功能[3-6],本研究室前期实验也证明了RPFRP 具有良好的免疫调节作用[4,7],由此推测其具有增强机体对抗原的免疫应答潜力。卵清白蛋白(Ovalbumin,OVA)作为一种模式抗原常被以注射方式免疫机体用于检验疫苗的佐剂效力[8]。有研究表明植物提取物通过口服方式给药可增强模式抗原特异性抗体效价,起到免疫佐剂的作用[9]。
目前关于RPFRP 协助抗原免疫机体的佐剂效果研究鲜见报道,因此本实验将不同剂量的RPFRP 以口服方式给药后再以注射的方式将OVA 模式抗原免疫小鼠,通过检测免疫小鼠相关的免疫学指标,探究RPFRP 对模式抗原OVA 的免疫佐剂作用及可能的作用机理,为进一步寻找高效、无毒、安全的中药免疫佐剂提供实验参考。
1 材料与方法
1.1 主要实验材料60 只20±2g 清洁级雌性ICR 小鼠购自福建医科大学实验动物中心。太子参参须(柘荣县所产)由福建贝迪药业有限公司提供。 采用水提醇沉法提取RPFRP,经纯化后测得多糖含量为62.7%。金标级OVA 购自上海酶联生物科技有限公司;RPMI 1640 培养基购自Gibco 公司;胎牛血清购自CellMax 公司;PBS 购自美国Hyclone 公司;红细胞裂解液、刀豆蛋白A(ConA)、脂多糖(LPS)购自美国Sigma 公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)购自北京鼎国昌盛生物技术有限责任公司;细胞因子ELISA 检测试剂盒、特异性IgG 抗体及其亚类ELISA 检测试剂盒购自上海邦奕生物有限公司;APC Anti-Mouse CD3e、 FITC Anti-Mouse CD4、 PE Anti-Mouse CD8a 购 自Tonbo Biosciences 公 司。
1.2 小鼠免疫实验设计60 只3 周龄~4 周龄ICR 小鼠,适应性饲养7 d 后随机分成对照空白组(CK 组)、OVA 免疫对照组(OVA 组)、OVA+RPFRP 低、中、高剂量组(50 mg/kg、100 mg/kg、200 mg/kg,即D、Z、G 组)共5 组,12 只/组。本实验免疫程序参考文献[10-11] 方法改进,在实验开始的第1 d~第5 d 和第16 d~第20 d,除CK 组和OVA 组小鼠灌胃双蒸水之外,其他组分别灌胃对应剂量RPFRP。第6 d 和第21 d,除CK 组小鼠经腹股沟皮下注射0.2 mL/只无菌PBS 外,其余各组小鼠均经腹股沟皮下注射0.2 mL/只即100 μg/只OVA 溶液,抗原含量≥99.9%。饲养期间各组小鼠自由采食、饮水。第36 d 将各组小鼠摘眼球采血,分离血清,采用ELISA 法检测各组小鼠血清中细胞因子(IL-2、IL-4、IL-10、IFN-γ)、特异性IgG 抗体及其亚类(IgG1、IgG2a 和IgG2b)含量,经颈椎脱臼法迫杀各组小鼠,采用MTT 法检测小鼠脾淋巴细胞增殖指数及NK 细胞活性、qRT-PCR 法检测各组小鼠脾淋巴细胞中的细胞因子以及转录因子的转录水平,以及采用流式细胞术检测各组小鼠脾细胞中CD3+、CD4+、CD8+T 淋巴细胞亚群数量及CD4+/CD8+T 细胞比值。
1.3 脾淋巴细胞悬液制备小鼠迫杀后无菌取脾,置于研钵中研磨,加入3.75 mL PBS 缓冲液后混匀,过滤,各组标记清楚,参考文献[12]制备脾淋巴细胞悬液,台盼兰法计数活细胞≥95%,用RPMI 1640 完全培养液调到所需浓度。
1.4 各组小鼠脾淋巴细胞增殖水平的测定在96孔板里加入5×106个/mL 脾细胞悬液100 μL,空白组孔只加100 μL RPMI 1640 完全培养液,实验孔分别加入4 μg/mL ConA 稀释液(用于刺激T 淋巴细胞增殖)、10 μg/mL LPS 稀释液(用于刺激B 淋巴细胞增殖)、10 μg/mL OVA 稀释液(用于刺激淋巴细胞增殖)各100 μL,各重复3 孔。于37 ℃、5% CO2培养44 h 后,各孔再分别添加5 mg/mL 的MTT 20 μL,继续培养4 h 后,2 000 r/min 离心5 min,弃上清,加入150 μL 酸性DMSO,低速遮光震荡10 min,空白孔调零后测定其余各孔OD492nm值。参照文献[12]公式计算小鼠脾淋巴细胞刺激指数(SI),SI=实验孔OD492nm值/空白孔OD492nm值。
1.5 各组小鼠脾NK 细胞的活性测定于96 孔板中加入100 μL 浓1×107个/mL 的脾细胞悬液作为效应细胞,另再取浓度为2×105个/mL YAC-1 肿瘤细胞悬液作为靶细胞(效应细胞与靶细胞体积比为50:1)100 μL加入上述含脾细胞的孔中,作为实验孔;另做效应细胞对照孔(只加脾细胞)、靶细胞对照孔(只加YAC-1 细胞)和空白对照孔(不加任何细胞)。于微量震荡仪上震荡片刻,置于37 ℃、 5% CO2培养4 h,各孔再加入5 mg/mL 的MTT,20 μL/孔,继续培养4 h;2 000 r/min 离心5 min,去上清,按150 μL/孔加入酸性DMSO 溶液(含4% 1N HCl),避光,低速遮光震荡10 min,空白孔调零后测定其余各孔OD492nm值,根据公式算NK 细胞杀伤活性:NK 细胞活性=[靶细胞对照OD492nm值-(实验组OD492nm值-效应细胞对照组OD492nm值)]/靶细胞对照OD492nm值×100%。
1.6 各组小鼠血清细胞因子、特异性抗体及其亚类含量的检测小鼠麻醉后摘眼球取血分离血清,-20 ℃保存。利用相应ELISA 试剂盒检测血清细胞因子(IL-2、IL-4、IL-10 和IFN-γ)以及特异性IgG 及其亚类(IgG1、IgG2a、IgG2b)抗体的水平。
1.7 各组小鼠脾细胞因子及转录因子mRNA 转录水平检测取1.3 制备的脾细胞悬液,采用TRIzol 法提取RNA,反转录为cDNA 后作为模板,采用参考文献[12-13]中qRT-PCR 方法检测小鼠脾脏细胞因子(IL-2、IL-4、IL-10 和IFN-γ)及转录因子(T-bet、GATA-3)mRNA 转录水平。计算公式参照文献[14]:相对表转录水平=2-ΔΔCt,ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。引物序见表1。

表1 基因及引物序列Table 1 Gene and primer sequences
1.8 各组小鼠脾脏T 淋巴细胞亚群分析取第36 d的各组小鼠脾脏,参照文献[12]制备脾细胞悬液,各组小鼠脾细胞各取100 μL,分别加入CD3、CD4 和CD8 抗体各10 μL(0.05 μg/μL)后混匀,同时分别设CD3、CD4 和CD8 抗体标记管各1 支(共3 支,均不加细胞)、1 支空白管。4 ℃避光孵育15 min 后,各管分别加入1 mL 红细胞裂解液,混匀避光静置15 min,1 500 r/min 离心5 min,弃上清。分别各用1 mL pH值呈中性的PBS 沉淀两遍,最后用300 μL 的PBS 将沉淀重悬后置于冰上,采用流式细胞术检测小鼠脾脏中的CD3+、CD4+和CD8+T 细胞的数量及CD4+/CD8+T 细胞的比例。
1.9 数据统计所有数据均利用SPSS Statistics 24.0软件进行单因素方差分析(One-way ANOVA),利用LSD 法进行多重比较,P<0.05 表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 RPFRP 对小鼠脾淋巴细胞增殖水平影响的测定结果本实验开始的第36 d(后同),迫杀各组小鼠取脾细胞制备悬液,采用MTT 法检测RPFRP 对小鼠脾淋巴细胞增殖的影响。结果显示,与CK组相比,各剂量RPFRP 均能够显著提高T 细胞和淋巴细胞的SI值(P<0.05);与OVA 组比,各剂量RPFRP 均能够显著提高T细胞的SI值(P<0.05),其中低、中剂量的RPFRP能够显著提高淋巴细胞的SI 值(P<0.05);各剂量RP-FRP 组之间的T 细胞和淋巴细胞的SI 值均差异不显著(P>0.05);各组之间B 细胞的SI 值均差异不显著(P>0.05)(图1)。表明RPFRP 能够提高小鼠脾脏T 细胞及淋巴细胞的增殖,从而在一定程度上促进小鼠对OVA 的体液免疫反应。
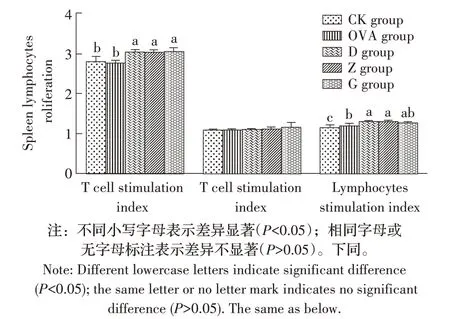
图1 RPFRP对小鼠脾淋巴细胞增殖水平影响的检测结果Fig.1 Results for the effect of RPFRP on the proliferation level in spleen lymphocytes in experimental mice
2.2 RPFRP 对小鼠NK 细胞杀伤活性影响的检测结果采用MTT 法检测RPFRP 对小鼠NK 细胞杀伤活性的影响。结果显示, CK 组小鼠NK 细胞对YAC-1肿瘤细胞的杀伤活性最低,与OVA 免疫组小鼠差别不显著(P>0.05),虽然各剂量RPFRP 组小鼠NK 细胞的杀伤活性与CK 组和OVA 组差异不显著(P>0.05),但均对NK 细胞的杀伤活性有一定的促进作用,且以高剂量的RPFRP 效果较好(图2)。表明RPFRP 能够在一定程度上促进小鼠脾脏NK 细胞对YAC-1 肿瘤细胞的杀伤活性。
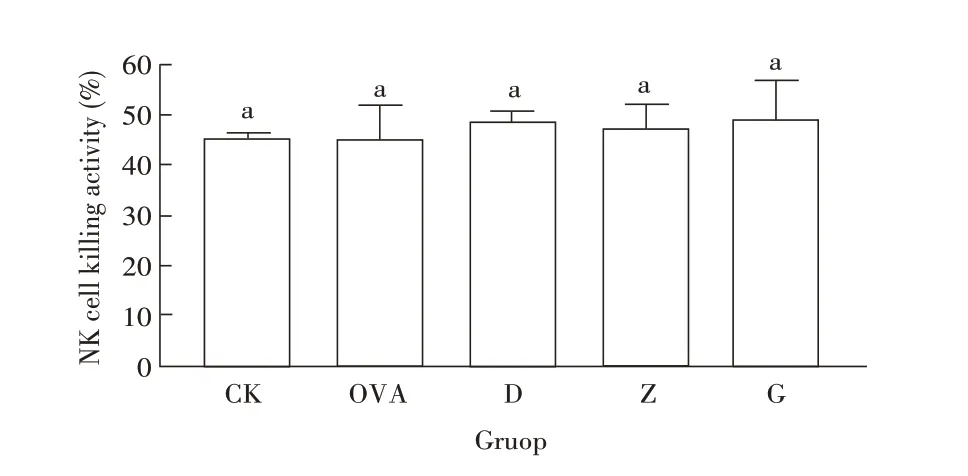
图2 各组小鼠脾脏NK细胞杀伤活性的检测结果Fig.2 Results for the killing activity of NK cell in spleen of experimental mice
2.3 RPFRP 对小鼠血清中细胞因子含量影响的检测结果采用ELISA 试剂盒检测各组小鼠血清中的细胞因子(IL-2、IL-4、IL-10、IFN-γ)含量,分析RPFRP 对小鼠血清中IL-2、IL-4、IL-10、IFN-γ 含量的影响。结果显示,各剂量RPFRP 组小鼠血清中IL-2 含量与CK 组和OVA 组差异均不显著(P>0.05);Z、D 组小鼠血清中的IL-4 含量较CK 组显著升高,较OVA 组差异不显著(P>0.05);各组小鼠血清中的IL-10 含量均差异不显著(P>0.05);G 组小鼠血清中的IFN-γ 含量较CK 组显著提高(P<0.05),其余RP-FRP 组IFN-γ 含量较OVA 免疫组虽有一定升高,但均差异不显著(P>0.05)(图3)。表明RPFRP 能够通过刺激机体分泌IL-4 和IFN-γ 来提高细胞的免疫反应能力,从而在一定程度上增强机体对OVA 的免疫应答。
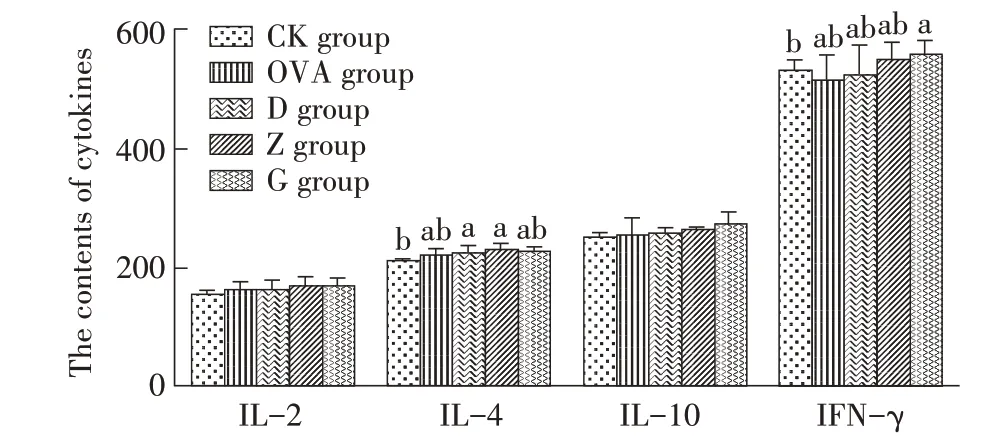
图3 RPFRP对小鼠血清中细胞因子含量影响的检测结果Fig.3 Results for the effect of RPFRP on cytokines in serum of experimental mice
2.4 RPFRP 对小鼠血清中特异性IgG 抗体及其亚类水平影响的检测结果采用ELISA 试剂盒检测各组小鼠血清中特异性IgG 抗体及其亚类(IgG1、IgG2a、IgG2b)水平,结果显示,与CK 组相比,其余各组小鼠血清中的特异性IgG 及各亚类抗体水平均显著上升(P<0.05),且RPFRP 高剂量组IgG 抗体水平比OVA 免疫组显著提高(P<0.05);与OVA 组相比,各剂量RPFRP 组小鼠血清中的特异性IgG1 抗体水平均有所提高,但均差异不显著(P>0.05);G、Z组IgG2a 抗体水平比OVA 组显著升高(P<0.05);与OVA 组相比,各剂量RPFRP 组小鼠血清中的IgG2b抗体水平均有升高的趋势,但以高剂量RPFRP 组的IgG2b 抗体水平升高显著(P<0.05)(图4)。表明RP-FRP 可以增强小鼠机体对OVA 的免疫应答,促进相应抗体分泌,提高机体的体液免疫应答。
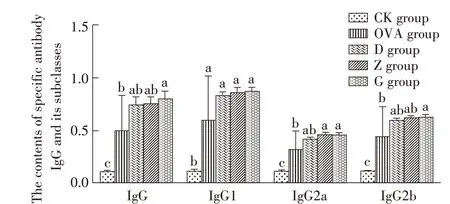
图4 RPFRP对小鼠血清中特异性IgG抗体及亚类含量影响的检测结果Fig.4 Results for the effect of RPFRP on the specific antibody in serum of experimental mice
2.5 RPFRP 对小鼠脾脏细胞因子及转录因子mRNA 转录水平影响的检测结果采用qRT-PCR 方法检测各组小鼠脾淋巴细胞因子(IL-2、IL-4、IL-10 和IFN-γ)及转录因子(T-bet、GATA-3)mRNA 的转录水平。结果显示,本实验开始的第36 d,与CK组相比,OVA 组、各剂量RPFRP 组小鼠脾淋巴细胞IL-2 mRNA 的转录水平均显著升高(P<0.05);而与OVA 免疫组比,G、Z 组小鼠脾淋巴细胞IL-2 mRNA转录水平均显著升高(P<0.05)(图5A)。与CK 组比较, G、Z 组小鼠脾淋巴细胞IFN-γ mRNA 转录水平显著升高(P<0.05),而与OVA 组相比,各剂量RP-FRP 组IFN-γ mRNA 转录水平均有所升高,但差异均不显著(P>0.05)(图5A)。与CK 组相比,各剂量RP-FRP 组和OVA 组的IL-4、IL-10 mRNA 转录水平 均显著升高(P<0.05),但与OVA组相比,各剂量RPFRP组IL-4、IL-10 mRNA 转录水平差异均不显著(P>0.05)(图5A)。各组小鼠脾细胞中T-bet、GATA-3 mRNA转录水平均差异不显著(P>0.05),T-bet/GATA-3 比值各组间的差异也不显著(P>0.05)(图5B、5C)。表明RPFRP 能够不同程度提高免疫小鼠机体IL-2 和IFN-γ、IL-4 和IL-10 两类细胞因子的转录水平,虽然T-bet、GATA-3 mRNA 转录水平在各组间无明显差异,但高剂量RPFRP 一直保持在最高水平。
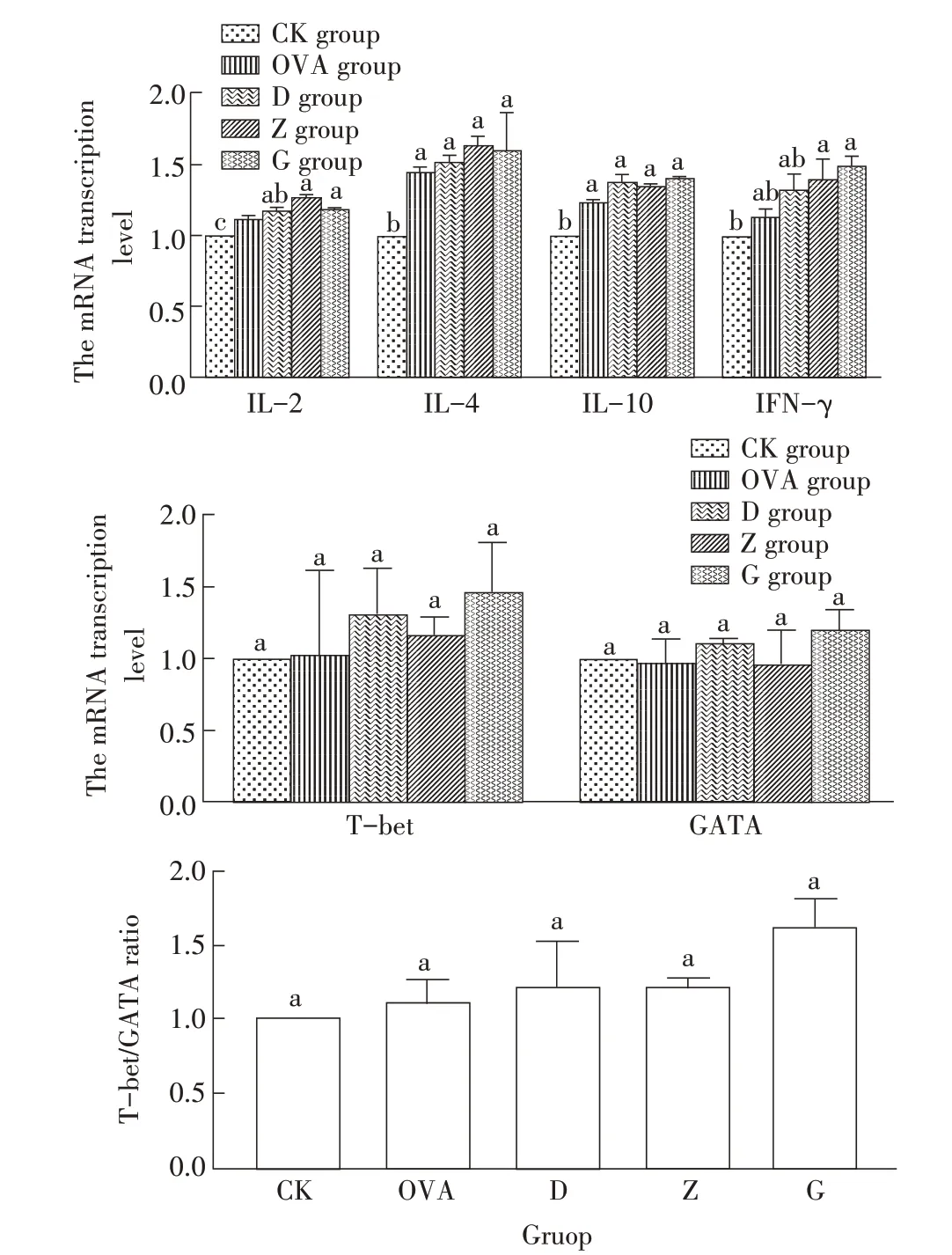
图5 RPFRP对小鼠脾脏细胞因子(A)、转录因子(B)mRNA转录水平及T-bet/GATA-3比值(C)影响的检测结果Fig.5 Results for the effect of RPFRP on mRNA transcription level of cytokines(A),transcription factors(B),and the ratio of T-bet/GATA-3(C)in splenic lymphocyte of experimental mice
2.6 RPFRP 对小鼠脾脏T 淋巴细胞亚群影响的检测结果以流式细胞术检测各组小鼠脾细胞中T 细胞亚群的含量以及及CD4+/CD8+T 细胞数量的比值,以分析RPFRP 对小鼠脾T 细胞亚群的影响。结果显示,G、Z 组和小鼠脾细胞中的CD3+T 细胞数量较CK 组显著升高(P<0.05),而OVA 组CD3+T 细胞数量较CK 组显著升高(P<0.05)。各剂量RPFRP 组CD4+T细胞数量较CK 组显著升高(P<0.05),G 组小鼠脾细胞中的CD4+T细胞数量较OVA组显著升高(P<0.05)。Z、D 组小鼠脾细胞中CD8+T 细胞数量较CK 组显著降低(P<0.05),而G、Z 组的CD8+T 细胞数量较OVA 组显著升高(P<0.05)。OVA 组的CD4+/CD8+T 细胞比值较CK 组显著升高(P<0.05),G、Z 组CD4+/CD8+T 细胞比值较OVA 组明显降低(P<0.05),更接近CK 组的CD4+/CD8+T 细胞比值(图6)。表明各剂量的RPFRP均能不同程度的调节小鼠脾脏T 细胞亚群含量及CD4+/CD8+T 细胞比值,以加强T 细胞的免疫应答。
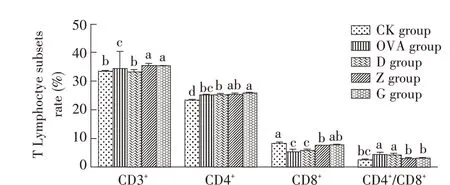
图6 RPFRP对小鼠脾脏T淋巴细胞亚群及CD4+/CD8+T细胞比值影响的检测结果Fig.6 Results for the effect of RPFRP on spleen T cell subpopulation and CD4+/CD8+T cells in experimental mice
3 讨 论
淋巴细胞体外转化及增殖能力体现机体细胞免疫功能的强弱,对脾淋巴细胞体外增殖的效果研究是研究机体免疫功能强弱的重要方式[15]。有研究表明,口服黄芪多糖[16]以及OVA 联合新疆栽培一枝蒿粗多糖免疫小鼠[17]均可提高小鼠脾细胞的增殖能力,后者还可提高机体对OVA 的免疫应答。本实验结果表明3 种剂量的RPFRP 能够明显促进T 细胞的增殖,虽然其促进B 细胞增殖的效果并不显著,但也有一定的促进作用,表明RPFRP 在一定程度上能够协同OVA 促进小鼠脾淋巴细胞的增殖提高其的细胞、体液免疫反应从而达到增强机体免疫力的期望。
NK 细胞具有天然的杀伤功能,机体固有免疫系统的激活能促使NK 细胞的分泌,在自身免疫疾病中起重要作用。有研究报道OVA 联合多糖能够提高小鼠脾NK 细胞的活性[11],乔石等发现RPFRP 促进了ConA或LPS 诱导的脾脏T、B 淋巴细胞的增殖反应,增强了其脾脏NK 细胞的活性,提高了CD4+/CD8+T 细胞的比值[18]。Oh 等发现,将小鼠的脾细胞与YAC-1 肿瘤细胞的共培养比例从12.5:1 增到50:1,YAC-1 细胞的凋亡率增加了约3 倍多[19]。本实验采用50:1 的比例共培养小鼠脾脏细胞和YAC-1 细胞,结果表明各剂量的RPFRP 均可在一定程度上提高NK 细胞对YAC-1 细胞的杀伤活性,说明RPFRP 能够刺激小鼠脾细胞的,使机体细胞免疫功能得到提升,进一步增强机体对OVA 的免疫应答水平,这与相关研究报道类似[18-19]。
Th1 免疫反应主要与细胞免疫有关,而Th2 免疫反应主要介导体液免疫反应[20],Th1/Th2 免疫反应的平衡对机体保持健康尤为重要,前者主要产生IL-2、IFN-γ 等细胞因子,后者主要产生IL-4 和IL-10 等。Feng 等的研究结果显示,口服川牛膝多糖可促使小鼠机体加强对OVA 的免疫应答,其可在体外促进小鼠脾细胞中IL-4 和IFN-γ 的分泌,以及CD4+T 细胞中的IL-2、IFN-γ 和IL-4 的分泌量,表明川牛膝多糖能通过促进小鼠脾细胞因子的分泌提高其细胞免疫应答的能力[21];Lin 等发现灵芝多糖作为佐剂时能够极大提高小鼠脾脏中的CD4+和CD8+T 细胞分泌IFN-γ 和IL-17 的能力[22]。本研究结果显示,G 组小鼠血清中的IFN-γ 含量上升,Z、D 组小鼠血清中的IL-4 含量上升,说明RPFRP 能够刺激机体分泌相应的Th1 和Th2 细胞因子来提高其体液及细胞免疫能力,在一定程度上增强机体对OVA 的免疫应答反应。T-bet 和GATA-3 与Th1/Th2 的分化密切相关,二者可通过调节细胞因子的分泌而影响Th1/Th2 免疫反应的平衡[23]。本研究结果显示,G、Z 组小鼠脾淋巴细胞中IL-2、IFN-γ mRNA 的转录水平较CK 组显著上升;与OVA 组相比,各剂量RPFRP 组小鼠脾淋巴细胞中IL-4、IL-10 的相对转录水平明显上升,Tbet/GATA-3 比值虽然无显著升高,该值仍有一定程度的升高,说明RPFRP 可以通过同时提高Th1 和Th2细胞因子、转录因子的转录水平来提高机体的细胞免疫反应。本研究结果中小鼠血清细胞因子含量与其脾细胞mRNA 转录水平的结果不尽一致,其二者之间的调节关系有待进一步深入研究。
常用IgG2a 和IgG1 来分别体现机体的免疫反应是偏向于Th1 还是Th2 型。在小鼠中,Th1 型免疫反应产生IgG2a 亚类,Th2 型免疫反应产生IgG1 亚类以及IgE[11]。Liu 等利用立方脂质体联合黄精多糖制备成免疫佐剂与OVA 一起免疫小鼠,结果显示免疫后该免疫佐剂可以促使小鼠特异性IgG 的分泌,提高其体液免疫反应,表明被修饰的黄精多糖具有很好的佐剂作用[24];张爱莲等研究发现新疆栽培一枝蒿粗多糖可作为小鼠OVA 蛋白的免疫佐剂增强其的体液和细胞免疫应答[16]。本研究结果表明,3 种剂量的RPFRP 均能够提高OVA 特异性IgG1 和IgG2a 抗体水平,其中高中剂量的RPFRP 比OVA 更能促进IgG2a、IgG2b 抗体的分泌,且3 种剂量RPFRP 组小鼠血清中IFN-γ 的含量及其脾脏中IFN-γ mRNA 转录水平均升高,表明RPFRP 可诱导小鼠机体Th1 和Th2 反应促进IgG1 和IgG2a 抗体分泌,且由于IFN-γ 可促进CD4+T细胞向Th1 细胞分化[25],表明RPFRP 可能更趋向于诱导小鼠产生Th1 型免疫反应,提高细胞免疫反应,调动机体T 细胞的活化,上调小鼠机体对OVA 的免疫应答,其中以中高剂量RPFRP 的免疫效果最强。
作为维持免疫功能最重要的细胞群之一,T 淋巴细胞亚群间通过相互协调,保证机体免疫功能的正常运行[26],其主要包括CD3+、CD4+和CD8+T 细胞,各亚群细胞的数量及CD4+/CD8+T 细胞的比值可表示机体的免疫情况[26]。张爱莲等研究发现,新疆栽培一枝蒿粗多糖可以上调小鼠免疫OVA 后脾脏CD3+、CD4+、CD8+T 细胞数量,同时提高CD4+/CD8+T 细胞的比值,增强T 细胞的免疫应答[16]。本研究结果表明,低、中剂量的RPFRP 能够提高小鼠脾淋巴细胞中CD4+T 细胞数量,中、高剂量的RPFRP 能够显著提高CD3+T 细胞数量,且各剂量RPFRP 均可降低CD4+/CD8+T 细胞的比值,从而提高小鼠的免疫反应,增强机体对OVA 的应答过程。但RPFRP 如何通过口服途径发挥免疫调节作用仍需进一步探究。
RPFRP 在一定程度上能够提高小鼠脾淋巴细胞的增殖水平,提高NK细胞的杀伤活性,提高OVA特异性IgG抗体及其亚类的含量,促进相关细胞因子的分泌及提高细胞因子、转录因子mRNA 转录水平等从而提高小鼠的免疫功能,增强小鼠机体对OVA 的免疫应答,起到一定佐剂的作用。本研究既可丰富太子参参须的免疫学内容,又可为节约太子参资源,为进一步寻找高效、无毒、安全的中药免疫佐剂提供一定参考。
