表达O型FMDV衣壳蛋白重组腺病毒的构建及其对小鼠免疫效力的研究
2022-08-24刘彦玲裴艳艳李敏杰杨德成王海伟田志军周国辉
刘彦玲,裴艳艳,李敏杰,杨德成,王海伟,于 力,田志军,周国辉
(中国农业科学院哈尔滨兽医研究所猪病综合防控创新团队,黑龙江 哈尔滨 150069)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(FMDV)感染引起的偶蹄动物共患的急性、热性、高度接触性传染病[1]。鉴于FMD 对世界经济造成的严重危害,国际兽疫局(OIE)和联合国粮农组织(FAO)将其列为A 类传染病,我国也将其列为一类动物传染病。疫苗接种是特异性预防FMD 的有效手段,因此安全有效的疫苗是预防、控制乃至最终消灭FMD 的先决条件。虽然OIE 推荐的FMDV 灭活疫苗在消灭欧洲的FMD 以及控制世界其他国家的FMD 过程中发挥了重要作用,但其存在一些不足之处,如:疫苗生产过程中存在病毒灭活不彻底导致FMD 暴发可能性;不能鉴别诊断感染动物和免疫动物等。因此急需一种更加安全有效的FMD 疫苗。目前利用缺陷型腺病毒活载体构建的FMDV 衣壳蛋白疫苗已逐渐成为研究的热点,有望成为第二代FMD 疫苗。
FMDV 衣壳蛋白前体P1-2A 含有FMDV 的主要抗原决定簇,可诱导机体产生体液免疫应答,从而保护动物免受FMDV 的攻击[2-3]。目前,国内外有关利用不同活载体构建FMDV 衣壳蛋白活载体疫苗的报道较多,所用的病毒载体有鸡痘病毒、伪狂犬病病毒、腺病毒和杆状病毒。其中以缺陷型腺病毒5 型构建的FMDV 衣壳蛋白活载体疫苗的研究最为深入,也取得了很好的免疫效果。
FMD 防控的艰巨性,在很大程度上源自病毒本身的结构和流行特点。FMDV 是高度变异的病毒,在迄今已鉴定的7 种血清型病毒之间无交叉保护,意味着要针对性制备相应疫苗;同一血清型的病毒株又可分成若干基因型,如O 型FMDV 目前分为8 个基因型(或称拓扑型),这些基因型之间的病毒株可能不能提供交叉保护。目前国内外多用腺病毒载体构建A 型(A12 和A24)和O 型(O1 Campos)FMDV 衣壳蛋白用于免疫动物,并取得了一定的免疫保护效果[4-6]。但尚未见到有关O 型新发泛亚谱系FMDV 衣壳蛋白的报道。而根据O 型新发泛亚谱系FMD 在我国的流行趋势,有关该谱系FMD 疫苗的研究显得尤为重要。基于此,本研究构建了表达O 型新发泛亚谱系FMDV P1-2A-3C 基因的重组腺病毒,并在BALB/c 鼠体内评价了该O 型新发泛亚谱系FMDV 衣壳蛋白的免疫原性,为表达O 型FMDV 衣壳蛋白重组腺病毒活载体疫苗的研究奠定了基础。
1 材料与方法
1.1 主要实验材料腺病毒骨架载体pAdEasy-1、腺病毒穿梭载体pShuttle-CMV、大肠杆菌BJ5183 感受态细胞以及AD-293 细胞均购自Stratagene 公司;大肠杆菌JM109、DH5 α 感受态细胞和pOK 质粒由本实验室保存;PmeI 购自NEB BioLabs 产品;转染试剂Effectene Transfection Reagent 购自QIAGEN 公司;FMDV VP2 MAb 10B10 由本实验室制备及保存;206佐剂购自Seppic 公司;HRP 标记兔抗鼠IgG,FITC-标记羊抗鼠IgG 购自Sigma 公司;无外源基因表达的野生型腺病毒(wtAdv)由本实验室构建并保存;O 型FMDV 灭活疫苗(内含146S 蛋白)购自杨凌金海技术有限公司;O 型FMDV VP1 抗体ELISA 试剂盒购自北京标驰泽惠公司。
1.2 重组腺病毒穿梭载体的构建与鉴定由吉林省库美生物科技公司合成FMDV 泛亚型O/YS/CHA/05 株(HM008917)P1-2A-3C 基 因,分 别 引 入Hind Ⅲ、EcoR V 酶切位点,并且在起始密码子ATG 前引入ko-zak 序列,克隆至pOK 载体,构建重组质粒pOK-P1-2A-3C。将质粒pOK-P1-2A-3C 和腺病毒穿梭载体pShuttle-CMV 分别经Hind III 和EcoR V 双酶切后回收纯化并连接,转化至JM109 感受态细胞构建重组腺病毒穿梭载体,经酶切鉴定正确的质粒命名为pShut-tle-P12A3C。
1.3 重组腺病毒质粒的构建、传代及PCR 鉴定将pShuttle-P12A3C 用PmeI 线性化,电转化至含有腺病毒骨架载体AdEasy-1 的BJ5183 感受态细胞中,构建重组腺病毒质粒,经测序鉴定正确的重组质粒命名为pAdV-P12A3C。将5 μg 质粒pAdV-P12A3C 利用Effectene Transfection Reagent 试剂转染到293 细胞中,9 d 后收获上清液,即为初代重组腺病毒(命名为rAdV-P12A3C)。将其反复冻融后,离心取上清,接种于293 细胞,连续传8 代,观察细胞病变情况;取4、6 和8 代重组腺病毒,用蛋白酶K 处理后提取DNA 作为模板,利用引物P12A3CF:5'-CTTAAGCT TCCACCATGGGTGCCGGGCAATCCAGCCCGGCGAC-3'/P12A3CR:5'-CTCGATATCTTACTCGTGGTGTGGTTCG GGATC-3'进 行PCR 鉴定。
1.4 不同代次rAdV-P12A3C 遗传稳定性的鉴定取2、4、6、8 代rAdV-P12A3C,分别以MOI 15 接种于96 孔板中长至90%单层的293 细胞,24 h 后弃去培养基,PBS 洗涤细胞3 次后,用预冷的无水乙醇固定15 min,以FMDV VP2 的MAb 10B10[7](1:1 000)为一抗, FITC 标记的羊抗鼠IgG(1:200)为二抗,以wtAdV 感染的293 细胞和正常的293 细胞作为对照,通过间接免疫荧光试验(IFA)鉴定rAdV-P12A3C 外源蛋白表达的稳定性。
同时,收集2、4、6、8 代感染rAdV-P12A3C 的293 细胞,以VP2 MAb 10B10(1:1 000)为一抗,HRP标记兔抗鼠IgG(1:10 000)为二抗,通过western blot进一步鉴定重组腺病毒的稳定性,设FMDV 疫苗146S 蛋白作为阳性对照,野生型腺病毒感染的293细胞作为阴性对照。
1.5 rAdV-P12A3C 生长曲线的测定分别用MOI 10 剂量的第8 代重组腺病毒(rAdV-P12A3C)和野生型腺病毒(wtAdV)接种293 细胞,在接种后12 h、24 h、36 h、48 h、60 h 和72 h 收取上清液,参照文献[8]方法进行病毒效价测定,并绘制重组腺病毒与野生型腺病毒的一步生长曲线。
1.6 BALB/c 小鼠的免疫试验及VP1 抗体检测取7周龄BALB/c 小鼠20 只,采用IFA 检测Ad5 抗体为阴性后随机分成4 组,每组5 只。A 组接种本研究制备的重组腺病毒(5×107TCID50/mL),200 μL/只,在首免后第4 周以相同剂量加强免疫;B 组接种O 型FMDV 灭活疫苗,200 μL/只,在首免后第4 周以相同剂量加强免疫;C 组接种与等体积206 佐剂乳化后的重组腺病毒(5×107TCID50/mL),200 μL/只,在首免后第4 周以相同剂量加强免疫;D 组接种同剂量的Ad5 野生型腺病毒,200 μL/只。各组小鼠均采用后腿肌肉注射免疫。将上述BALB/c 小鼠从首免后开始每间隔一周经断尾采血并分离血清,采用O 型FMDV VP1 抗体ELISA 试剂盒检测BALB/c 小鼠血清中的抗体水平。
2 结 果
2.1 重组腺病毒穿梭载体的鉴定结果将质粒pOK-P1-2A-3C 和腺病毒穿梭载体pShuttle-CMV 双酶切后连接转化至JM109 感受态细胞,构建重组腺病毒穿梭载体质粒。酶切鉴定结果显示,在约7 500 bp和2 500 bp 处有两条目的条带(图1),与重组腺病毒穿梭载体预期大小相符,初步表明重组腺病毒穿梭载体构建正确。

图1 重组腺病毒穿梭载体的酶切鉴定结果Fig.1 Restriction enzyme digestion result of recombinant adenovirus pShuttle vector
2.2 重组腺病毒的构建、传代及PCR 鉴定结果将重组腺病毒穿梭载体用限制性内切酶PmeI 线性化,电转化至含有腺病毒骨架载体AdEasy-1 的BJ5183 感受态细胞中,构建重组腺病毒质粒pAdVP12A3C。将质粒pAdV-P12A3C 转染至293 细胞中,转染后9 d 细胞开始出现变圆、变大、脱落等细胞病变(CPE)。第9 d 收获上清液传代,每代均出现CPE,当传至第5 代时,细胞于接种病毒后24 h~48 h 均出现CPE(图2B)。取第4、6 和8 代重组腺病毒,提取重组病毒DNA,经PCR 鉴定结果显示,每代均能扩增到3.5 kb 的目的条带,与重组腺病毒rAdV-P12A3C预期相符;而野生型腺病毒无该目的条带(图3)。初步表明获得了重组腺病毒rAdV-P12A3C。
图2 重组腺病毒rAdV-P12A3C感染293细胞引起的CPEFig.2 CPE of rAdV-P12A3C infected 293 cells
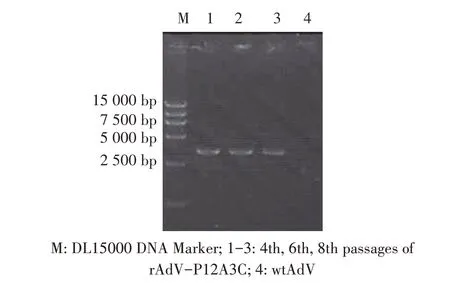
图3 不同代次重组腺病毒rAdV-P12A3C的PCR鉴定结果Fig.3 PCR identification results of recombinant adenovirus rAdV-P12A3C
2.3 rAdV-P12A3C 遗传稳定性鉴定结果将2、4、6、8 代rAdV-P12A3C 分别以MOI 15 接种于293 细胞后经IFA 检测,结果显示,2、4、6、8 代重组腺病毒感染的细胞均出现明显的绿色荧光,而对照组无该荧光(图4)。表明获得了能够稳定表达FMDV-VP2蛋白的重组腺病毒rAdV-P12A3C。

图4 重组腺病毒rAdV-P12A3C遗传稳定性的IFA检测Fig.4 Detection of genetic stability of recombinant adenovirus rAdV-P12A3C by IFA
对不同代次重组腺病毒感染的293 细胞进行western blot 分析,结果显示:感染2、4、6、8 代重组腺病毒的293 细胞在约24 ku 和37 ku 处均出现VP3、VP0 目的条带,与FMDV 疫苗146S 蛋白结果一致,而野生型腺病毒感染的293 细胞无目的条带(图5)。进一步表明rAdV-P12A3C能够稳定表达FMDV衣壳蛋白。
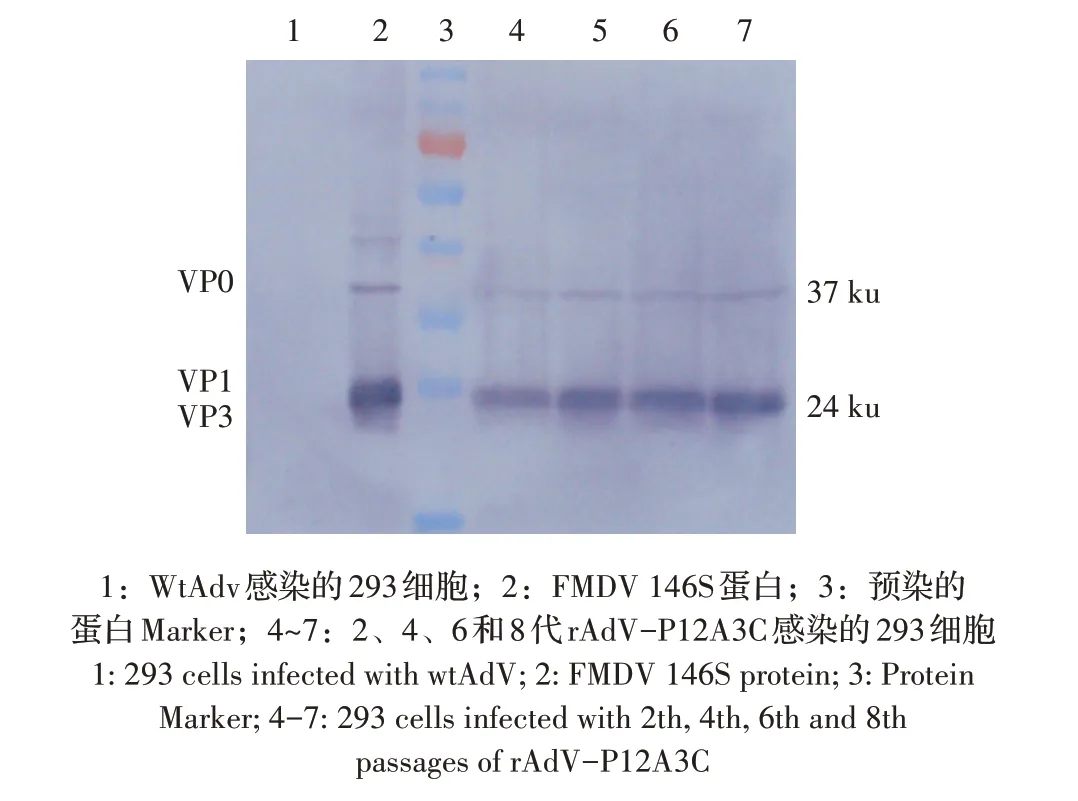
图5 重组腺病毒rAdV-P12A3C遗传稳定性的western blot检测Fig.5 Detection of genetic stability of recombinant adenovirus rAdV-P12A3C by western blot
2.4 rAdV-P12A3C 生长曲线的测定结果经测定不同时间点的病毒滴度,并绘制重组腺病毒rAdVP12A3C 与其亲本病毒wtAdV 的一步生长曲线。结果显示,随着感染时间的延长,重组腺病毒的病毒滴度逐渐升高,在60 h 时病毒滴度达到峰值7.2×108TCID50/mL,随后开始下降(图6);而亲本病毒wtAdV各时间点的病毒滴度均略高于重组腺病毒,但二者差异不显著。表明外源基因插入后对重组腺病毒的复制未造成明显影响。
图6 重组腺病毒rAdV-P12A3C的生长曲线Fig.6 The growth curve of recombinant adenovirus rAdV-P12A3C in 293 cells
2.5 BALB/c 小鼠的免疫试验及VP1 抗体检测结果分别采集接种重组腺病毒rAdV-P12A3C 免疫组(A 组)、O 型FMDV 灭活苗组(B 组)、重组腺病毒rAdV-P12A3C 与等体积206 佐剂乳化组(C 组)和Ad5 野生型腺病毒组(D 组)BALB/c 小鼠血清,采用间接ELISA 试剂盒检测各组BALB/c 小鼠血清抗体水平。结果显示,A 组、B 组和C 组BALB/c 小鼠均在接种后3 周出现FMDV 特异性VP1 抗体,随后抗体水平逐渐升高,在二免后3 周(一免后7 周)抗体水平达到峰值,到一免后24周抗体水平接近阴性;并且C 组 抗 体 水 平 极 显 著 高 于A 组(P<0.01)和B 组(P<0.01);而D 组未产生任何针对FMDV 的抗体(图7)。表明重组腺病毒能够刺激BALB/c 小鼠机体产生特异性抗体。

图7 各组BALB/c小鼠血清VP1抗体的动态变化Fig.7 Dynamic change of antibody levels in immunized mice
3 讨 论
FMDV 灭活疫苗具有良好的免疫原性,在预防和控制FMD 的过程中发挥着重要作用,但由于其免疫期较短、副作用较强、存在安全隐患、难以鉴别诊断感染动物和免疫动物等缺点,需要一种更加安全有效的FMD 疫苗。目前,FMDV 活载体疫苗研究是热点,而腺病毒载体疫苗是最有效的递呈外源抗原的表达系统,可诱导人和多种动物特异性体液和细胞免疫反应。FMDV 衣壳蛋白具有与完整病毒相同的免疫学特性,且不存在散毒的风险,因而利用各种表达系统表达FMDV 衣壳蛋白一直是国内外研究的热点。FMDV 活载体疫苗有望能克服FMD 传统疫苗的缺点,成为FMD 第二代新型疫苗。
与其他表达载体相比,腺病毒表达载体具有许多优点:腺病毒基因结构和功能研究比较清楚、感染谱广、病毒滴度高、可插入外源基因容量大、不用佐剂、不需要提纯、制作成本低、可折叠和修饰表达蛋白、表达蛋白活性良好[9];重组腺病毒免疫接种7 d 后攻毒即可诱导完全的保护性免疫,此时IgG抗体水平并不太高,说明有其他免疫因素参与,如细胞免疫、黏膜免疫、天然免疫等[10],这就使得与其他的活载体疫苗相比较,腺病毒表达载体的优势更加突出。因此本研究选择腺病毒表达载体构建rAdV-P12A3C,用于免疫小鼠,检测其免疫效果。
FMDV P1-2A-3C 基因序列的正确拼接,以及3C蛋白酶充分发挥裂解FMDV 前体蛋白作用,会对后期动物免疫试验的效果产生重要影响。Mayr 等构建了含A 型FMDV 基因组P1-2A-3C 的重组腺病毒,并对构建的一株重组腺病毒的3C 蛋白酶基因进行了突变,从而使3C 蛋白酶不能发挥裂解蛋白的作用,在后期的动物免疫试验中此株重组腺病毒就不能够诱导动物产生中和抗体[4]。本研究中重组腺病毒rAdVP12A3C 在体外通过IFA 和western blot 均鉴定了其正确的表达和裂解;免疫接种BALB/c 小鼠后再采用间接ELISA 检测小鼠血清中产生的较高水平的IgG 抗体。这些结果表明本研究中FMDV P1-2A-3C 基因在重组腺病毒中的正确表达,并且3C 蛋白酶发挥了其裂解作用。
真核核糖体RNA 对翻译起始位点序列的识别受到ATG 起始密码子两侧mRNA 序列的影响。如果在ATG 起始密码子的前面插入Kozak 序列会显著提高目的基因的表达水平。本研究设计目的基因时在ATG翻译起始位点引入了Kozak 序列,从而保证目的基因能够正确的起始翻译和提高表达水平。另外,在本研究中重组腺病毒rAdV-P12A3C 与等体积206 佐剂乳化组(C 组)的IgG 抗体水平略高于重组腺病毒rAdV-P12A3C 免疫组(A 组),可见商品化的油佐剂可增强重组腺病毒rAdV-P12A3C 免疫效果,具体机理需进一步研究。
复制缺陷型人腺病毒(5 型)由于缺失了与复制相关的E1 基因,构建的重组腺病毒只能在表达E1 的细胞中复制,即需要293 细胞的辅助,因此该重组病毒在动物体内或自然环境中不能生长复制,不会散毒污染环境,并且在动物体内不存在人腺病毒抗体,因此不必考虑母源抗体的干扰问题。在本研究中BALB/c 小鼠加强免疫后诱导的抗体水平明显升高,这也表明不存在腺病毒载体抗体干扰的问题。
本研究首次构建了表达O 型FMDV 衣壳蛋白的重组腺病毒rAdV-P12A3C,免疫一定剂量的重组腺病毒后BALB/c 小鼠产生了较高水平的体液免疫应答,为FMD 活载体疫苗的研究奠定了基础。
