牛病毒性腹泻病毒单克隆抗体的制备及其在该病毒检测中的应用
2022-08-24王以欣姜晓霞孙晓波韩美婧张晓梅乔薪瑗徐义刚
王以欣,姜晓霞,孙晓波,韩美婧,张晓梅,乔薪瑗,贾 烁*,徐义刚
(1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.浙江省畜禽绿色生态健康养殖应用技术研究重点实验室浙江农林大学动物科技学院动物医学院,浙江 杭州 311300)
牛病毒性腹泻-黏膜病(Bovine viral diarrhea-mu-cosal disease,BVD-MD)又称牛病毒性腹泻病(BVD),是由BVD 病毒(BVDV)感染牛引起的一种接触性、热性传染病,该病在世界范围内广泛分布,是造成全球养牛业经济损失的主要疫病之一[1]。BVD 的临床症状主要表现为腹泻、高热、白细胞减少、急性或慢性黏膜病、免疫抑制、持续性感染(Persistent infec-tion,PI)、母畜流产等[2]。其中,PI 牛是BVD 的主要传染源,持续排毒感染其他健康牛致其免疫抑制,PI 牛免疫力下降,易继发感染其他病原,从而造成更大的经济损失。BVDV 属于黄病毒科瘟病毒属成员,为单股正链RNA 病毒,基因组全长约12.3 kb~12.5 kb,由5'-非翻译区、3'-非翻译区和一个大开放阅读框组成,编码12 种蛋白,包括4 种结构蛋白和8种非结构蛋白[3]。
BVDV 致病机理非常复杂,给BVD 的防控和净化带来极大的困难和挑战。目前针对BVD 的防控,一方面通过疫苗接种预防,但由于PI 牛的存在,常常导致免疫失败;另一方面通过筛查和淘汰PI 牛的方式剔除传染源并切断传播途径以净化畜群[4],其中病原检测在防控BVDV 感染和畜群疫病净化方面发挥着重要作用。此外,BVDV 也是引起牛呼吸道疾病综合征(BRDC)的主要病原之一,在临床上,BVDV引起BRDC 的症状与牛传染性鼻气管炎病毒、牛副流感病毒3 型和牛呼吸道合胞体病毒引起BRDC 的症状相似,且常见混合感染,极大地增加了疫病诊断与防制难度[5]。因此,建立BVDV 快速准确的检测方法尤为重要。本研究利用BVDV 全病毒为免疫原制备BVDV 单克隆抗体(MAb),并初步用于该病毒检测,为BVDV 快速检测方法的建立提供物质基础。
1 材料与方法
1.1 病毒株、菌株、细胞和实验动物BVDV ZD-2018 株、牛细小病毒(BPV)、牛传染性鼻气管炎病毒(IBRV)、牛轮状病毒(BRV)、牛呼吸道合胞体病毒(BRSV)、牛副流感病毒3 型(BPIV3)、MDBK 细胞和骨髓瘤(SP2/0)细胞、pCold-TF 质粒均由本实验室保存;猪瘟病毒(CSFV)活疫苗株购自齐鲁动物保健品有限公司;大肠杆菌BL21 感受态细胞购自北京全式金公司;6 周龄~8 周龄BALB/c 小鼠购自哈尔滨医科大学实验动物中心;10 日龄健康新生犊牛购自黑龙江省双城市雀巢有限公司;实验动物的使用按照东北农业大学有关实验动物福利与伦理的规定进行。
1.2 主要试剂弗氏完全/不完全佐剂、聚乙二醇6000、HAT、HT、IPTG、辣根过氧化物酶(HRP)、3C Protease,均购自Sigma 公司;HiTrapTMProtein G HP 抗体纯化亲和柱购自GE 公司;HisPureTMNi-NTR Resin、LinKineTMHRP 标记试剂盒和MAb 亚类鉴定试剂盒购自Thermo Fisher 公司;FITC 标记山羊抗鼠IgG和HRP 标记山羊抗鼠IgG 购自北京中杉金桥公司;DMEM 培养基购自源培生物科技有限公司;胎牛血清购自浙江天杭生物科技有限公司。BVDV 结构蛋白C、E0、E1、E2 为本实验室前期原核表达纯化后保存备用。
1.3 动物免疫采用蔗糖密度梯度离心法纯化BVDV ZD-2018 株, 经超微量紫外分光光度计测定病毒总蛋白浓度,取400 μg 与等体积的弗氏完全佐剂混合,充分乳化后经腹腔注射免疫BALB/c 小鼠,剂量为100 μg/只;每间隔两周使用弗氏不完全佐剂乳化后进行第二次免疫和第三次免疫。第三次免疫后7 d 断尾采血,以纯化的BVDV 全病毒为包被抗原,以采集的待检小鼠血清为一抗,HRP 标记山羊抗鼠IgG(1:5 000)为二抗,采用间接ELISA 方法检测小鼠血清抗体效价,当抗体效价小于1:12 800 时,加强免疫一次。
1.4 MAb 的制备、稳定性及亚类的鉴定于加强免疫后第5 d,无菌取小鼠脾细胞与SP2/0 细胞融合,以纯化的BVDV 全病毒为包被抗原, 杂交瘤细胞上清液为一抗,HRP 标记山羊抗鼠IgG(1:5 000)为二抗,采用间接ELISA 方法筛选阳性杂交瘤细胞,经有限稀释法连续克隆纯化5 次后,当细胞上清阳性率为100%时,则表明获得了分泌MAb 的杂交瘤细胞株,将阳性杂交瘤细胞连续传20 代,并将细胞株冻存3 个月后复苏,采用间接ELISA 方法(方法同上)评价该杂交瘤细胞稳定性,并采用MAb 亚类鉴定试剂盒鉴定制备的MAb 亚类。
1.5 MAb 的特异性试验分别将BVDV、IBRV、BPV、BPV、BRV、BRSV、BPIV3 和CSFV 全病毒(103TCID50/0.1 mL)包被ELISA 反应板,以制备的杂交瘤细胞上清原液为一抗,HRP 标记山羊抗鼠IgG(1:5 000)为二抗,通过间接ELISA 法检测制备的MAb 的特异性。
1.6 MAb 与BVDV 反应性的间接免疫荧光试验(IFA)将BVDV ZD-2018 株接种于96 孔细胞板中长满单层的MDBK 细胞,同时设MDBK 细胞对照组,37 ℃、5%CO2培养30 h,弃培养液,每孔加入100 μL预冷的无水乙醇,室温固定30 min;每孔加入2%的Triton-X100,透膜10 min;然后加入0.3%的BSA 37 ℃封闭30 min。以杂交瘤细胞上清原液为一抗,以FITC 标记的山羊抗鼠IgG(1:200)为二抗,经IFA 检测MAb与BVDV 反应性。
1.7 MAb 用于检测BVDV 结构蛋白的western blot 方法将BVDV 病毒结构蛋白C、E、E1、E2 分别进行SDS-PAGE 后,分别以制备的6 株MAb(1:100)为一抗,以HRP 标记山羊抗鼠IgG(1:1 000)为二抗,通过western blot 分别检测制备的MAb 与BVDV 病毒结构蛋白C、E、E1、E2 的反应性。
1.8 MAb 4H6A6 腹水的制备及其效价的检测选择MAb 4H6A6 杂交瘤细胞经腹腔注射小鼠,当其腹部膨胀明显时抽取腹水,利用HiTrapTMProtein G HP 抗体纯化柱纯化MAb 4H6A6 腹水,经SDS-PAGE 检测后,以BVDV全病毒为包被抗原,以纯化的MAb 4H6A6腹水(10 倍倍比稀释)为一抗,HRP 标记山羊抗鼠IgG(1:5 000)为二抗,采用间接ELISA 测定纯化后的MAb 4H6A6腹水效价,设SP2/0制备的小鼠腹水为阴性对照。
1.9 利用HRP 标记的MAb 4H6A6 检测BVDV 的免疫组化试验将健康犊牛分为两组(实验组和对照组),每组1 头,实验组经口服途径感染2 mL 106TCID50/0.1 mL 的BVDV ZD-2018 株,对照组口服同体积的DMEM 培养液作为对照,逐日观察犊牛临床症状,当实验组犊牛出现腹泻症状时,将两组犊牛迫杀后采集肠道组织制备石蜡切片。利用LinKineTMHRP 试剂盒标记纯化的MAb 4H6A6 后,进行免疫组化检测,标准操作过程包括:石蜡包埋肠道组织、切片、脱蜡、抗原修复、3%过氧化氢孵育、山羊血清封闭、HRP 标记4H6A6 孵育(1:100)、DAB 显色、苏木素复染、透明、封片和镜检。
2 结 果
2.1 分泌BVDV MAb 阳性杂交瘤细胞的筛选、MAb稳定性及亚类鉴定结果以BVDV 免疫小鼠,取脾细胞与SP2/0 细胞融合,采用间接ELISA 方法(以纯化的BVDV 全病毒为包被抗原)筛选阳性杂交瘤细胞、有限稀释法进行亚克隆。结果显示,共获得6株分泌BVDV MAbs 的杂交瘤细胞株,命名为6D2F2、4H6A6、1D8C7、1GBD8、1C7E7 和3A8E1。将6 株 阳性杂交瘤细胞连续传20 代,采用间接ELISA 方法测定每代细胞上清的OD450nm值,同时将细胞株冻存3个月,复苏细胞后再检测其分泌MAb 能力。结果显示,阳性杂交瘤细胞分泌抗体的能力在连续传代(以F1、F2 和F20 代结果为例)和冻存后未见显著变化(表1),显示了其良好的稳定性。利用MAb 亚类鉴定试剂盒鉴定所制备的MAbs 亚类,结果显示,获得的6株MAb 均为IgG 类抗体,其中6D2F2、1G8D8、1C7E7和3A8E1 属 于IgG2α 亚 类,4H6A6 属 于IgG1 亚 类,1D8C7属于IgG2b亚类。

表1 杂交瘤细胞分泌MAb的稳定性检测结果Table 1 Stability test of hybridoma cells secreting MAbs
2.2 MAb 的特异性检测结果分别将CSFV、IBRV、BPV、BRV、BRSV、BPIV3 和BVDV 作为包被抗原,采用间接ELISA方法检测该6株MAb的特异性,结果显示,制备的MAb仅与BVDV发生特异性反应(图1),表明获得的6 株MAb 特异性良好。

图1 MAb特异性的ELISA检测结果Fig.1 Specificity of MAbs detected by ELISA
2.3 MAb 与BVDV 反应性的IFA 鉴定结果将BVDV ZD-2018 株接种至MDBK 细胞,采用IFA 分别鉴定各MAb 与BVDV 的反应性。结果显示,6D2F2、4H6A6、1D8C7、1G8D8、1C7E7 和3A8E1 均 能 特 异 性 识 别BVDV,感染病毒组细胞呈现特异性绿色荧光,而对照组未见荧光(图2),表明制备的6 株MAb 均能用于IFA 检测BVDV。
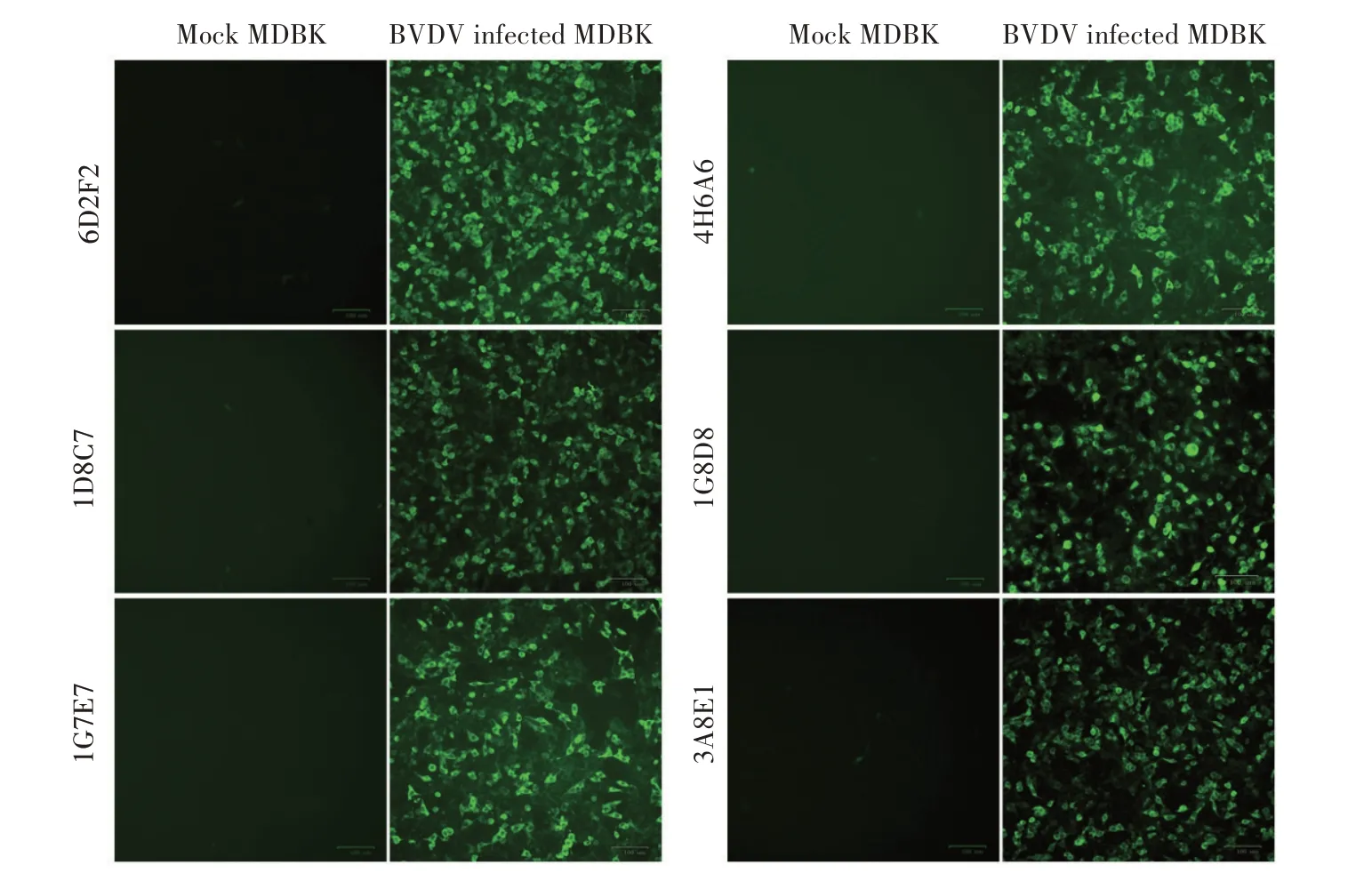
图2 MAb的IFA鉴定结果Fig.2 Identification of monoclonal antibodies by IFA
2.4 MAb 用于检测BVDV 结构蛋白的western blot鉴定结果通过western blot 鉴定制备的6 株MAbs 与BVDV 结构蛋白C、E0、E1、E2的反应性,结果显示,MAb 6D2F2、4H6A6、1D8C7和1G8D8能够特异性地识别BVDV E2 蛋白,MAb 1C7E7 和3A8E1 能够特异性地识别BVDV E0蛋白(图3),表明制备的各MAb 可用于建立western blot 方法鉴定BVDV 相应的结构蛋白。
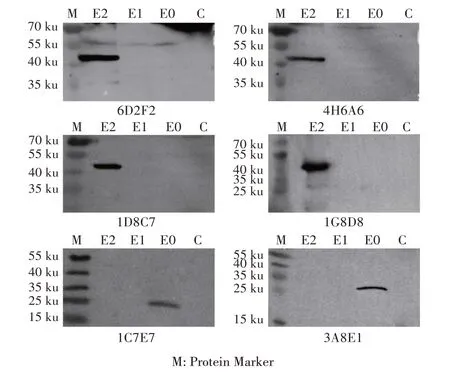
图3 MAb与BVDV结构蛋白反应的western blot鉴定结果Fig.3 Identification of monoclonal antibodiesagainst viral structure proteins by western blot
2.5 MAb 4H6A6 腹水的制备、纯化及效价的测定结果将4H6A6杂交瘤细胞经腹腔注射BALB/c 小鼠,制备腹水,经纯化获得总浓度为1.07 mg/mL 的腹水;SDS-PAGE 分析显示,抗体重、轻链清晰可见,且杂蛋白较少(图4),通过ELISA 方法测定MAb 4H6A6 腹水效价为1:106。
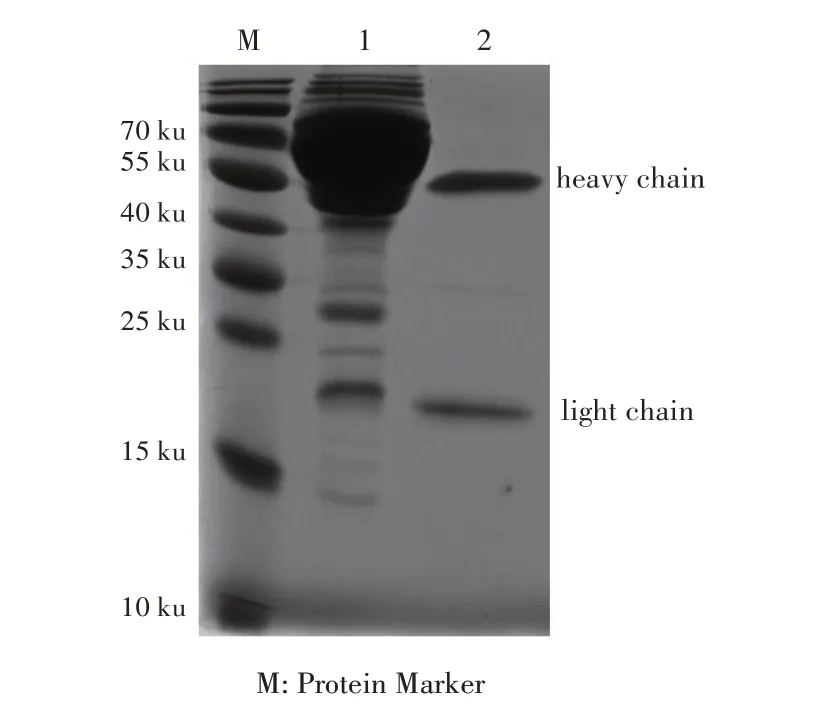
图4 MAb 4H6A6腹水纯化的SDS-PAGE检测Fig.4 Purification result of MAb 4H6A6 ascites analyzed by SDS-PAGE
2.6 HRP标记的4H6A6用于免疫组化试验检测BVDV的结果采集BVDV 感染的犊牛肠道组织样品,制作石蜡切片,利用HRP标记4H6A6腹水作为一抗,经免疫组化试验检测肠道组织中的BVDV,结果显示,HRP 标记的4H6A6 能够特异性识别组织中的病毒,呈现棕褐色,而正常对照组未见棕褐色(图5),表明HRP 标记MAb 4H6A6 可用于免疫组化试验检测组织中的VDV。
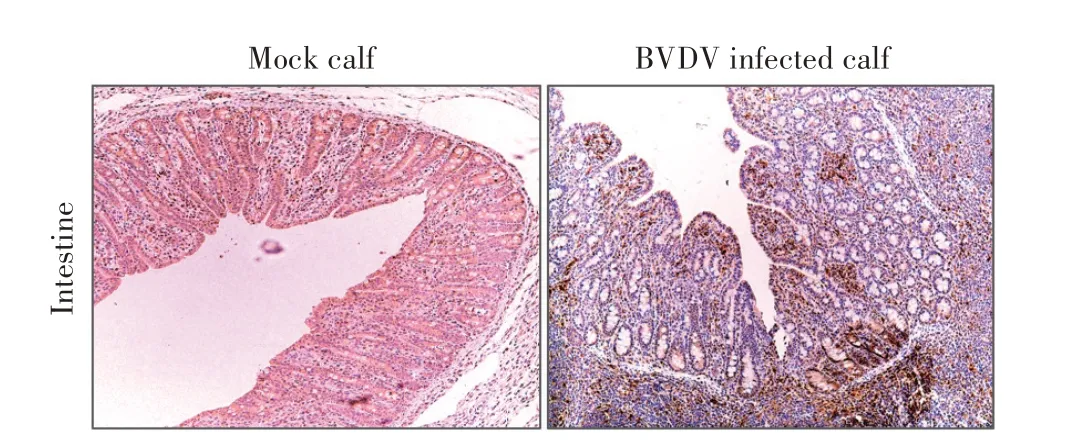
图5 肠道组织中BVDV的免疫组化检测结果Fig.5 Immunohistochemical result of BVDV infection in intestinal tissue
3 讨 论
BVDV 是危害养牛业健康发展的主要病原之一,其感染呈世界性分布。BVDV 可抑制牛免疫系统,使其易受其他致病微生物侵袭,导致牛群生产力、健康和繁殖效率降低,造成的经济损失巨大[6-7]。目前BVDV 感染在我国牛群中较为普遍,由于PI 牛的存在,其体内抗体滴度低以及母源抗体影响等因素,在生产实践中检测病原具有实际意义。国内外学者针对BVDV 遗传物质建立了多种检测方法,如RTPCR 方法、荧光定量RT-PCR 方法、等温核酸扩增技术(IAT)、重组酶聚合酶扩增技术(RPA)等[8],为疫病诊断和流行病学调查提供了必要的技术支持。此外,捕获ELISA 也是BVDV 最常使用的检测方法之一[9-10],而建立有效的捕获ELISA 方法需要制备能够特异识别病原的MAb。
BVDV、CSFV 和绵羊边界病毒(BDV)同为黄病毒科瘟病毒属成员,抗原表位存在相似性,制备出特异性良好的BVDV MAb 存在概率性。王新华等通过聚乙二醇浓缩法浓缩BVDV,免疫小鼠获得8 株BVDV 的MAb,均与CSFV存在交叉反应[11]。王富饶等用蔗糖密度梯度离心法纯化BVDV,免疫小鼠制得1 株MAb,与CSFV 和BDV 均不发生交叉反应[12]。聂明非等利用表达BVDV E2 蛋白的重组真核表达质粒获得2 株MAb,且与CSFV 和BDV 均无交叉反应[13]。杨立新等利用原核表达系统表达BVDV 非结构蛋白NS3,以此免疫小鼠获得8 株稳定分泌BVDV NS3 蛋白MAb 的杂交瘤细胞,均与CSFV无交叉反应[14]。以往研究结果显示,目前用于制备BVDV MAb 的免疫原主要有3 种形式,包括原核表达的蛋白、真核表达的蛋白和浓缩的BVDV 全病毒。其中,利用原核表达的蛋白制备MAb,优点是免疫原较为纯净,且获取方法相对简单,而且但原核表达的蛋白构象简单,与真实的蛋白结构存在明显差异,由其制备的MAb 与靶抗原结合力不强;用真核表达的蛋白制备MAb,虽然真核系统表达蛋白的构象接近于天然蛋白,但蛋白表达量相对较少;与利用重组蛋白制备MAb 的方法相比,利用全病毒免疫制备的MAb 更加接近病毒的天然结构,能更好地识别病毒,其敏感性更高和结合力更强[15]。因此,本研究选用BVDV 全病毒作为免疫原以制备BVDV MAb。本研究采用超速离心和蔗糖密度梯度离心法纯化BVDV,免疫小鼠,经过筛选获得6 株稳定分泌BVDV MAb的杂交瘤细胞,分别为6D2F2、4H6A6、1D8C7、1G8D8、1C7E7 和3A8E1。经IFA、ELISA 方法检测显示,所获6株IgG型MAb均能特异性识别BVDV,且与CSFV、IBRV、BPV、BRV、BRSV 和BPIV3 等均无交叉反应,显示了良好的特异性。制备的6 株MAb 可以用于IFA特异性检测BVDV。
目前常见以BVDV 全病毒免疫,在诱导机体免疫应答过程中,BVDV 囊膜蛋白E0 和E2 发挥了重要作用,这与病毒自然感染过程中,机体产生病毒抗体的规律相符;结构蛋白E0 和E2 是BVDV 主要的保护性抗原,含有中和表位,能够诱导机体产生中和抗体[16-18]。本研究获得的6 株MAb 中,6D2F2、4H6A6、1D8C7 和1G8D8 能够特异性识别BVDV E2 蛋白,1C7E7 和3A8E1 能够特异性识别BVDV E0 蛋白。所获得的可识别E0 和E2 蛋白的MAb 是否具有中和活性,需要后续评估,但本研究结果表明制备的MAb可用于western blot 实验检测相应BVDV 结构蛋白。为进一步开发利用制备的MAb,本研究利用HRP 标记MAb 4H6A6 经免疫组化方法检测感染组织中的BVDV,结果显示,HRP 标记4H6A6 能够特异性识别组织中的病毒,显示了较好的应用潜力。
综上所述,本研究制备的BVDV MAb 不仅可用于建立BVDV 的快速检测方法,也可用于病毒的基础研究,为BVDV 的快速检测及致病机制研究提供了物质基础。
