枳椇子抗肝纤维化作用网络药理学研究*
2022-08-24吾斯曼艾海提艾则孜江艾尔肯
吾斯曼·艾海提,艾则孜江·艾尔肯
(新疆医科大学第一附属医院药学部,新疆 乌鲁木齐 830054)
肝纤维化是因肝脏受到长期刺激时,细胞外基质分泌过多沉积导致,是慢性肝炎- 肝纤维化- 肝硬化发展过程中的重要中间环节[1-2]。肝病在我国的发病率呈持续升高趋势,其中慢性肝炎进展为肝硬化的发生率为2%~10%[3]。目前,有研究发现肝纤维化可逆,但临床尚无有效的治疗药物与方法[4]。近年来,中医药在抗肝纤维中显示出显著优势[5]。枳椇子为鼠李科植物北枳椇Hovenia dulcisThunb. 的干燥成熟种子,始载于《新修本草》,具有止渴除烦、清热利尿之功效。现代药理学研究显示,枳椇子可改善模型大鼠肝纤维化程度[6-7]。其能改善肝功能,下调基质金属蛋白酶抑制因子1(TIMP- 1)的表达,进而改善肝脏胶原的降解功能,逆转肝纤维化[8-9],但枳椇子抗肝纤维化的有效活性物质及作用机制尚待阐明。因此,本研究中基于网络药理学,通过预测分析枳椇子的活性成分及其治疗肝纤维化的靶点、信号通路,探讨其抗肝纤维化的作用机制,以期为临床防治肝纤维化提供理论依据。现报道如下。
1 资料与方法
1.1 活性成分及靶点获取
以枳椇子为关键词输入中医药系统药理学平台(TCMSP),设口服生物利用度(OB)≥30%,类药性(DL)≥0.18,检索枳椇子的活性成分,并获取成分靶点,同时借助蛋白质数据库(Uniprot,https://www.uniprot.org)标准化处理成分靶点。
1.2 肝纤维化靶点获取
以“hepatic fibrosis”为关键词,分别输入GeneCards、人类孟德尔遗传数据库(OMIM,http://www.omim.org)及疾病关联关系数据库(DisGeNET,https:// www. disgenet.org),检索肝纤维化的靶点并合并,剔除重复靶点后即得肝纤维化潜在靶点。
1.3 抗肝纤维化靶点获取及成分-靶点网络构建
将得到的成分靶点及肝纤维化靶点输入Venny 平台,取交集,即得枳椇子抗肝纤维化的潜在靶点。将枳椇子活性成分及枳椇子抗肝纤维化的潜在靶点一一对应导入Cytoscape 3.7.0 软件中,构建成分-靶点网络,并借助软件分析工具对网络进行拓扑参数分析,节点的节点度(Degree)值越大,代表节点越重要,最后根据Degree值排序筛选靠前的成分为核心成分。
1.4 蛋白-蛋白相互作用(PPI)网络构建
将枳椇子抗肝纤维化的潜在靶点导入String 数据库中,设置物种为Homo sapiens,最小交互打分值为0.7,隐藏离散的蛋白,得到PPI 关系。将结果导入Cytoscape 软件中构建PPI 网络,并借助软件分析工具对网络进行拓扑参数分析,根据Degree 值筛选靠前的靶点为核心靶点。
1.5 潜在靶点富集分析
利用R 语言软件对枳椇子抗肝纤维化的潜在靶点进行基因本体论(GO)富集分析和京都基因与基因组百科全书(KEGG)富集分析,其中GO 富集分析包括生物学过程(BP)、细胞成分(CC)及分子功能(MF)3个部分。根据P值筛选靠前的结果进行绘图分析。
2 结果
2.1 活性成分及靶点
共得活性成分7 个(见表1),靶点289 个,剔除重复及无标准名靶点后得187个靶点。
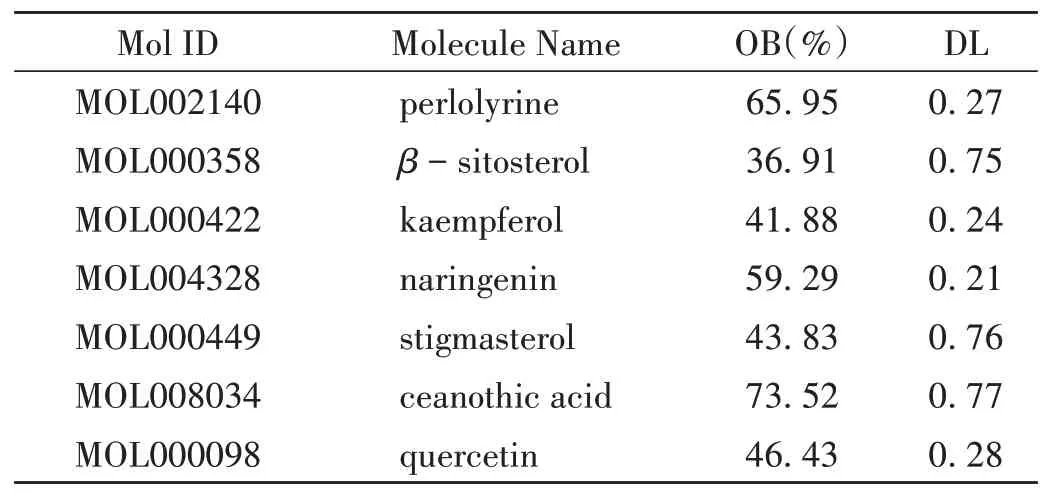
表1 枳椇子的活性成分Tab.1 Active components of Hovenia dulcis
2.2 肝纤维化潜在靶点
在 GeneCards,OMIM 及 DisGeNET 数据库分别检索得到6 241,28,63 个肝纤维化靶点,剔除重复靶点后再与上述枳椇子活性成分及靶点取交集,得到枳椇子抗肝纤维化的靶点,详见图1。

图1 活性成分-肝纤维化靶点维恩图Fig.1 Venn diagram of active component-hepatic fibrosis targets
2.3 活性成分-靶点网络
成分- 靶点网络包含172 个节点,258 条边,详见图2,图中红色为枳椇子活性成分,绿色为其抗肝纤维化潜在靶点。表明山柰酚、柚皮素、槲皮素等6个黄酮类化合物为参与抗纤维化过程的核心成分,其在抗肝纤维化过程中起关键作用。

图2 活性成分-靶点网络Fig.2 Active component-target network
2.4 PPI 网络
网络中包含152 个节点,892 条边,其中节点越大,蓝色越深,代表其Degree 值越大,连线越粗代表蛋白间的相互作用越强,详见图3。根据Degree 值得到AKT1,JUN及MAPK3等10个靶点为核心靶点,详见表2。

图3 蛋白-蛋白互作网络图Fig.3 PPI network
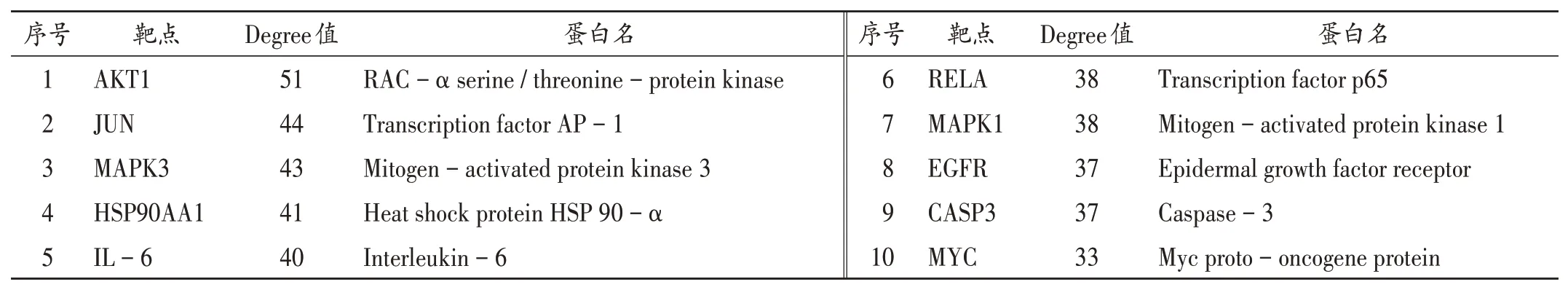
表2 核心靶点信息Tab.2 Information of key targets
2.5 富集分析
GO 功能富集分析结果涉及对金属离子的应答、对脂多糖的应答、药物应答、对细菌来源分子的应答、细胞对化学压力的反应等1 877条BP通路(图4 A);膜筏、膜微区、质膜筏、小窝及细胞器外膜等64个CC通路(图4 B);核受体活性、配体激活的转录因子活性、DNA 结合转录因子结合、RNA 聚合酶Ⅱ特异性DNA 结合转录因子结合及G 蛋白偶联受体活性等163 条MF 通路(图4 C)。KEGG 富集分析结果主要涉及肿瘤坏死因子(TNF)、白细胞介素17(IL-17)及晚期糖基化终末产物及其受体(AGE-RAGE)等177条通路(图4 D)。
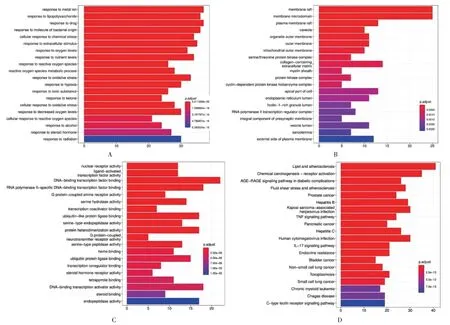
图4 富集分析结果Fig.4 Results of the enrichment analysis
3 讨论
肝纤维化为慢性疾病,长期刺激可使肝脏结构改变甚至导致肝功能丧失,多种细胞因子及细胞外基质(ECM)在肝纤维的发生发展中至关重要[10]。中医学中根据肝纤维化的病理特征,将其归属于“积聚”“胁痛”等范畴[3]。枳椇子可促进肝星状细胞(HSC)凋亡,减少ECM 的过量堆积,并减少转化生长因子-β1(TGF-β1)及TIMP-1的表达,进而阻滞肝纤维化的发展[11]。本研究中通过网络药理学分析发现,枳椇子主要通过β-谷甾醇、山柰酚、槲皮素及柚皮素等活性成分发挥疗效。β-谷甾醇能下调活化HSC 中胶原-1 和α-平滑肌肌动蛋白(α-SMA)mRNA 的蛋白表达水平,防止胶原积累,从而治疗肝纤维化[12]。山柰酚在体内外均能显著抑制胶原的合成和HSC 的活化,显著降低肝组织坏死炎症的评分,抑制激活素受体样激酶5 而减轻肝纤维化[13];其通过降低丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的活性,减少羟脯氨酸(HYP)的含量及炎性因子水平,进而阻止肝纤维化进展,保护肝组织,这可能与山柰酚抑制β-catenin的表达从而抑制β -catenin/Wnt 通路有关[14-15]。柚皮素可通过阻断氧化应激、炎性反应以及TGF-β-Smad 3和JNK-Smad 3通路,灭活HSC和抑制促纤维化途径减轻肝纤维化[16]。此外,柚皮素可通过抑制内质网应激和自噬改善四氯化碳(CCl4)诱导的大鼠肝损伤[17]。
GO 及KEGG 富集分析结果显示,枳椇子通过对金属离子、脂多糖、药物及细菌来源分子的反应等生物学过程,涉及 AKT1、JUN 及 MAPK3 等核心靶点,调控TNF、IL-17 及AGE-RAGE 等通路发挥抗肝纤维化作用。通过下调AKT1 及p - AKT1 的表达,能抑制PI3K/Akt信号通路的活化,进而促进HSC 凋亡起保护肝纤维化作用[18]。c - Jun 是AP1 激活蛋白(AP1)的一个组成部分,其可被PI3K/AKT 信号通路激活,从而参与HSC的活化和肝纤维化[19]。通过抑制丝裂原活化蛋白激酶(MAPK)和Akt信号通路的磷酸化而抑制LPS 诱导的炎性反应,进而保护大鼠免受肝轴异常引起的肝纤维化[20]。此外,通过下调MAPK,P-MAPK,P38 的蛋白表达水平,抑制MAPK 信号通路,可显著改善CCl4诱导的纤维化[21]。TNF 为一种免疫细胞因子,参与机体免疫功能的调节。通过降低TNF- α 和IL-1β 的表达水平,能抑制HSC 增殖及活化,减少ECM 的生成,增加其降解,进而改善肝纤维化[22]。IL-17作为炎性细胞因子,在各种肝脏疾病中起重要作用,可调节HSC 的活化和肝纤维化进展。3型细胞因子IL-17及IL-22可增强p38丝裂原激活蛋白激酶依赖的TGF-β 信号通路,进而参与肝纤维化[23]。晚期糖基化终末产物(AGE)受体(RAGE)阻断抗体及可溶性RAGE,可抑制AGE-RAGE 信号通路。RAGE 可降低AGE 诱导的HSC 的自噬和活化,进而促进丙型肝炎相关肝纤维化的形成,提示阻断AGE -RAGE 信号可缓解肝纤维化[24]。本研究中网络药理学预测结果与目前相关研究结果一致,提示枳椇子通过AKT1,JUN,MAPK3 调控TNF,IL - 17,AGE - RAGE 信号通路发挥抗肝纤维化作用。
综上所述,枳椇子抗肝纤维化是通过β- 谷甾醇、山柰酚、槲皮素及柚皮素等活性成分作用于AKT1,JUN及MAPK3等核心靶点,调控TNF,IL-17,AGE-RAGE信号通路参与到抗肝纤维化进程中。
