我国A 股上市规则改革对药物创新的推动成效与思考*
2022-08-24姚青,黄哲
姚 青 ,黄 哲
(1. 广州汉光药业股份有限公司,广东 广州 510308; 2. 沈阳药科大学工商管理学院,辽宁 沈阳 110016)
大力发展生物医药产业,推动生物医药创新,已成为当前我国的国家战略。生物医药创新离不开资本市场的支持,美国能保持技术创新的领先地位,重要的原因之一是其拥有一个支持风险投资用高新技术企业发展的纳斯达克市场。我国科创板创立前,创业板对标的是美国纳斯达克,但创业板上市条件与纳斯达克相比过于严格,让很多优质的创新企业只能“望板兴叹”,不得不选择赴美上市。2018 年以来,随着香港交易及结算所有限公司(简称港交所)18A 章上市规则(简称18A 条款)的设立,上海证券交易所(简称上交所)科创板的开设,以及深圳证券交易所(简称深交所)创业板注册制的改革,我国资本市场不断加强与国际资本市场接轨的改革力度[1]。三大证券交易所为创新药企业赋能,多元化的融资渠道成为国内创新企业发展的有力支撑,创新迎来了前所未有的蓬勃发展。港交所作为全球第二大生物医药科技融资中心,自18A 条款设立以来至2021 年 12 月的 3 年多时间,国内共有 48 家企业上市并融资约1 126亿港币[2]。上交所科创板的设立,对医药创新企业的影响更深远。对于根植中国、市场也主要在国内的企业,能在国内A 板上市是绝大多数企业的首选。即便是尚未盈利或存在累计未弥补亏损的企业,在科创板更包容的发行上市条件(市值达到40 亿和进入Ⅱ期临床试验,且核心产品有明显技术优势)下也可发行上市。可以说,我国的资本市场在“允许未盈利企业上市”这一政策最终落地后,才具备了一个真正对标纳斯达克的资本市场。自此,我国的生物医药创新企业才有机会更好地在纳斯达克、科创板、港交所之间进行选择。本研究中选择国内创新企业在科创板获得融资的情况、投入创新研发的强度、创新药的产出情况等多个角度,研究和剖析“允许未盈利企业上市”制度改革背后调动的积极因素,以从更深层次解读该制度的深远影响。
1 制度改革推动我国药物创新发展
1.1 提供充足资金支持
医药的研发投资时间长,投入成本高,但成功概率非常低。一个创新药的研发平均需经济成本10亿美元,时间成本为5~15 年;生物创新药研发的经济成本为8亿美元,时间成本为8~10年(数据来源于德勤金融服务行业研究中心)。小分子药物的研发成功概率为0.02%(从化合物筛选阶段开始),生物创新药的研发成功概率低于10%,这是典型的需要资本支持才能获得快速发展的领域。科创板开设前,仅有类似恒瑞、复星、齐鲁、正大天晴、豪森等已上市的大企业才有可能承担创新药物研发成本,而对于众多处于初创期和成长期的企业,仅靠自有资金维系举步维艰,即便有风险投资(VC)的支持,也很难维持下去。
在资本市场的支持下,成长期医药企业增加研发投入有了底气。贝达药业是科创板上市企业,董事长丁列明曾表示,通过上市募集资金,企业可有更多的资金投入到研发中去,尤其是上市以来,贝达药业的研发投入及其占营收的比例不断提高。生物医药行业企业是科创板第二大家族,截至2021年7月2日,我国共有69家,总市值超过1.3 万亿,累计IPO 融资约735.9 亿元人民币[3]。科创板 640 家公司 2020 年平均研发费用 1.41 亿元,以归属生物产业的先正达最高。640 家企业平均研发费用占比[总研发费用/(总销售收入 × 640)×100%]为711.04%。研发费用占比以神州细胞- U 最高。2020 年科创板企业研发费用排名及占比见表1(数据来源于Wind 数据,占比指该企业研发费用占其销售收入比例)。
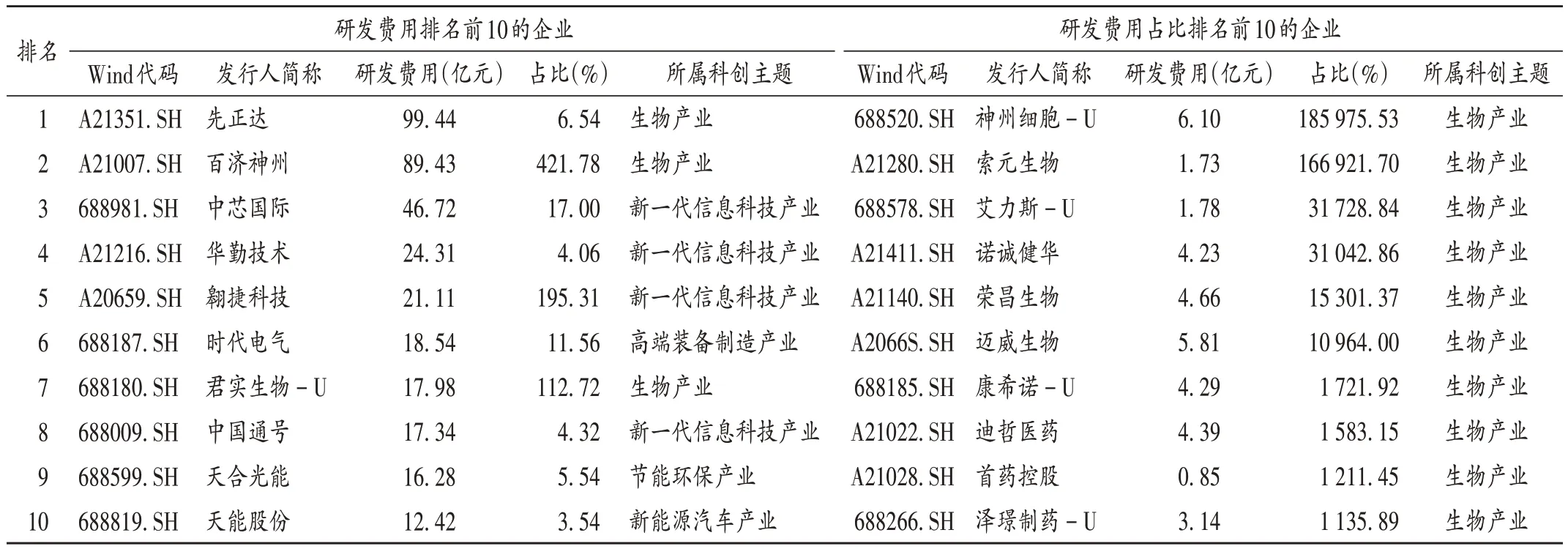
表1 2020年科创板研发费用及占比排名前10的企业Tab.1 Top 10 companies in the proportion of R & D expenses of Sci-Tech Innovation Board Companies in 2020
与研发投入比例相呼应的,是创新药投融资金额和数量均不断扩大的趋势和热情。以登陆科创板企业最多的江苏省为例,苏州生物医药产业园已成为创新药发展最快速的地区,且苏州的融资额屡创新高,从2020年1月至2021年8月,10家企业融资总金额约130亿元人民币。详见表2。
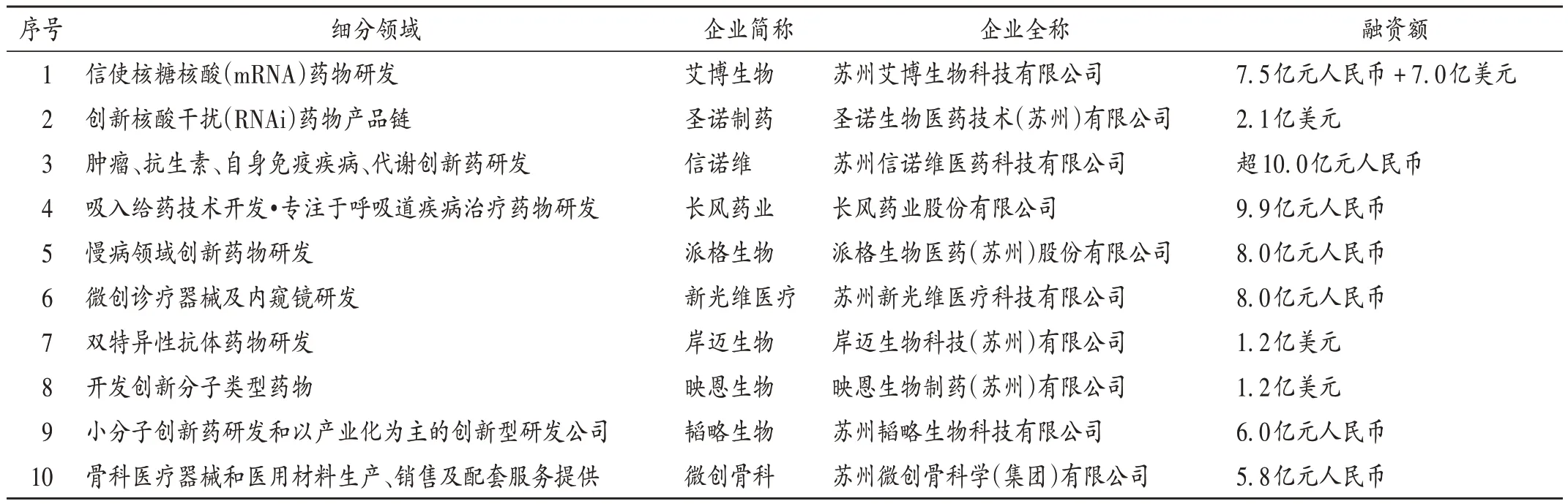
表2 苏州生物医药产业园2020年1月至2021年8月融资额排名前10的企业Tab.2 Top 10 companies in financing amount in Suzhou Biomedical Industrial Park from January 2020 to August 2021
A股上市规则的改革很好地解决了资本退出问题,点燃了众多的VC 机构和投资者的热情,令社会资本有强烈的意愿投入医药创新,让更多的初创企业及投资者对快速上市和获得丰厚回报产生了希望。以国内首家无收入、无盈利的企业苏州泽璟制药在科创板首次公开募股(IPO)为例,自 2018 年 12 月 12 日 IPO 立项到2020年1月23日正式上市,历时仅13个月,泽璟制药成为科创板未盈利企业上市第一股,成为中国资本市场一大标志性事件。
科创板的规则颠覆了A 股市场对企业价值判断的传统思维,我国暂未盈利但“值钱”的生物医药创新企业正在这里诞生。截至2021 年10 月15 日,科创板共有640家上市企业,其中80家企业的科创属性为生物医药产业(包括生物制品、化学药品、医疗器械设备、医疗耗材、技术服务及其他五大板块);640 家企业中以第5 套上市标准(即市值40 亿、未盈利企业)上市的有26 家,且均为生物医药企业(资料来源于Wind数据)。可见,科创板第5套上市标准是为成长期的生物医药企业“量身定制”的。
1.2 激发非上市企业创新力
上海交通大学特聘教授李斌曾表示,政府要有的放矢地让更多小企业有更多的勇气去做创新,让“万马奔腾”起来。传统模式下的创新药投资,常常是药品获批上市后才有可能获得回报,在漫长的研发周期中难以预测后续发展,失败的风险一直存在,大大削弱了企业研发创新药的积极性。虽然不少小型生物技术医药企业定位于创新药,但受制于无营业额、无利润,故无法上市,或仅能选择赴美上市。自2018 年港交所18A 条款推出,上交所科创板开设,创业板注册制落地,IPO 改革为这类企业敞开了大门,2020 年艾力斯、君实生物、百奥泰等多家未盈利的创新型医药企业成功登陆资本市场。
“人民金融·创新药指数”的701 个成分样本中,有91 家上市医药企业(包括在我国内地和香港特别行政区,以及在美国上市的企业)和249 家非上市企业的创新药[4]。众多的非上市企业存在巨大的上市潜力,大大提高了科技人才的研发积极性,吸引了越来越多的海外创新药人才归国,为创新药行业带来强大的技术支持。初创企业和新兴生物医药企业在全国雨后春笋般不断涌现,与此同时,顶级人才也逐渐从大型跨国制药企业投身本土创新企业,如在2018 年5 月,辉瑞前中国区总裁吴晓滨加入百济神州;2020 年,吉利德科学前全球副总裁、前中国区总经理罗永庆加入腾盛博药,赛诺菲前全球研究负责人刘勇军加入信达生物;2021年3月,默克前中国研发中心负责人Johannes Nippgen加入康宁杰瑞生物。
1.3 助力创新药研发VIC 模式开展
VIC 模式(即风险投资、知识产权和合同制研发服务机构)起源于美国,经过几十年的发展,已成为美国创新药研发的一条成功之路。绝大多数美国创新药企业充分利用该模式,成功开发出无数个创新药。VIC 模式是美国新药研发的基础和源泉,也是美国在医药研发领域占主导地位的决定性因素。
目前,中国创新药企业多采用VIC 模式,首先是风险投资资金到位;其次是知识产权,即产品,包含外部引进和自主研发;最后就是合同制研发服务机构。VIC模式加快了创新成果产出,使企业和投资者共同承担风险,共同获得收益。
VIC 模式正成为中国生物创新研发的兴起之路。以信达制药为例,该企业成立于2011年,2018年10月31日在港交所上市,是港交所18A条款设立后首批上市的生物创新企业之一。该企业从创建到上市经历了4 轮融资,共获得高达4.1 亿美元的投资,营造了生物医药企业融资的新格局,这与其研发管线、发展理念、国际化合作战略密不可分,也与资金退出渠道畅顺,给投资者(包括中途撤资者)带来了投资收益,同时增强了投资者的投资信心有关[5]。
科创板的设立和港股18A 条款均能惠及制药研发领域的上游。风险投资机构已经看到,投资早期医药企业,变现和风险投资退出可以提早,风险投资者可选择在不同的阶段介入和退出,形成“接力式”投资方式,保障了研发投资资金链条的完整性[6]。
1.4 加速创新药物上市并提升研发效率
随着A 股上市规则的改革,我国1 类创新药的研发和注册申请自2018 年以来也明显呈不断上升趋势。我国生物1 类创新药的研发和注册申请自2018 年以来也呈迅猛发展趋势[7-12]。详见图 1 至图 4(其中 IND 为新药临床试验申请,NDA为新药上市申请)。
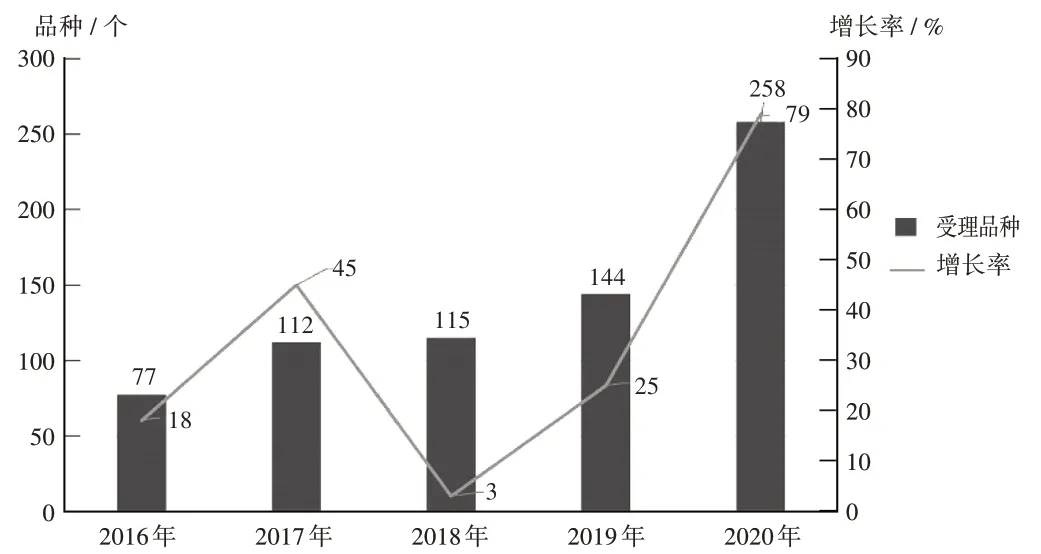
图1 2016年至2020年国产化学药1类创新药注册申请受理情况Fig.1 Application and acceptance status of domestic innovative chemical drugs(category 1) from 2016 to 2020
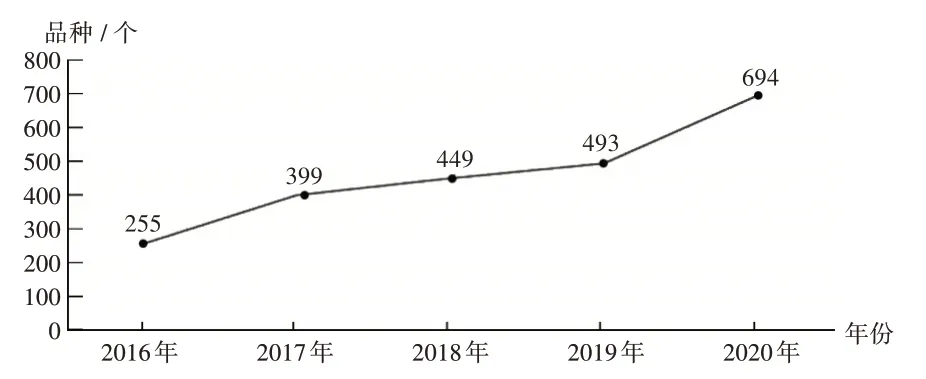
图2 2016年至2020年1类创新化学药IND批准审评通过情况Fig.2 The status of IND applications of innovative chemical drugs(category 1)approved through the review from 2016 to 2020
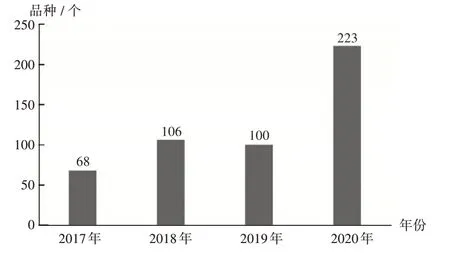
图3 2017年至2020年生物制品1类创新药注册申请受理情况Fig.3 Application and acceptance status of biological products(category 1)from 2017 to 2020
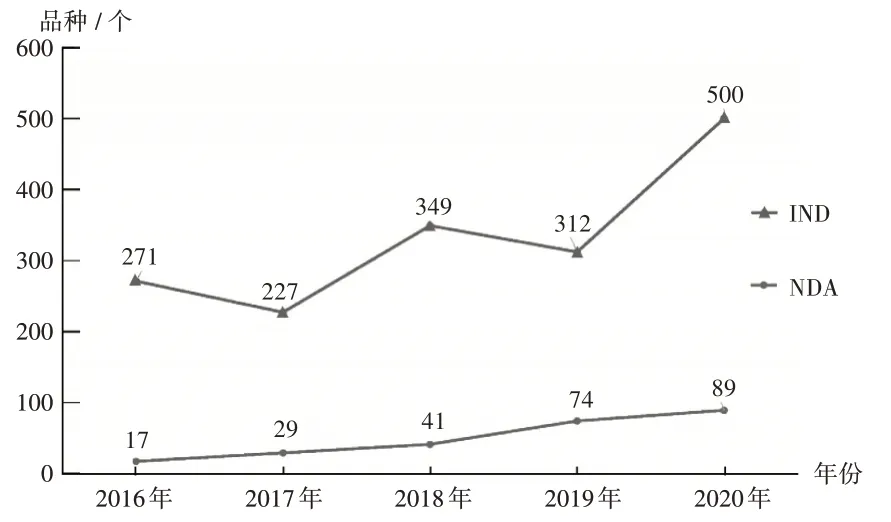
图4 2016年至2020年生物制品IND和NDA审评通过情况Fig.4 The status of IND applications and NDA applications of biological products approved through the review from 2016 to 2020
1.5 带动专利许可
随着我国创新的崛起和自身地位的提高,产品也越来越国际化,不单以专利引进为主,专利许可也已成为趋势。通过比较美国和中国历年生物创新药的批准上市数量,发现其均呈增长态势,而我国的获批数量在2019 年超越美国,2020 年持续超越,且2021 年有望继续维持。详见图5(数据来源于医药魔方网,由德勤金融服务行业研究中心整理)。
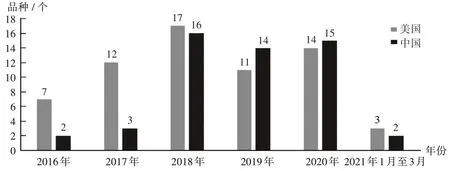
图5 中美2016年1月至2021年3月生物创新药获批数量比较Fig.5 Comparison of the number of biological innovative drugs approved between China and the United States from January 2016 to March 2021
借助资本的力量,随着一批我国本土创新企业的蓬勃发展,越来越多的自主研发创新药被全球其他企业认可,“出海潮”将带动中国产品的国际化,增强影响力,让本土企业在全球创新中更有话语权。中国2021年医药跨境交易排名前10的企业见表3(数据来源于美柏医健网[13],截至2021年8月31日。- 为未披露)。
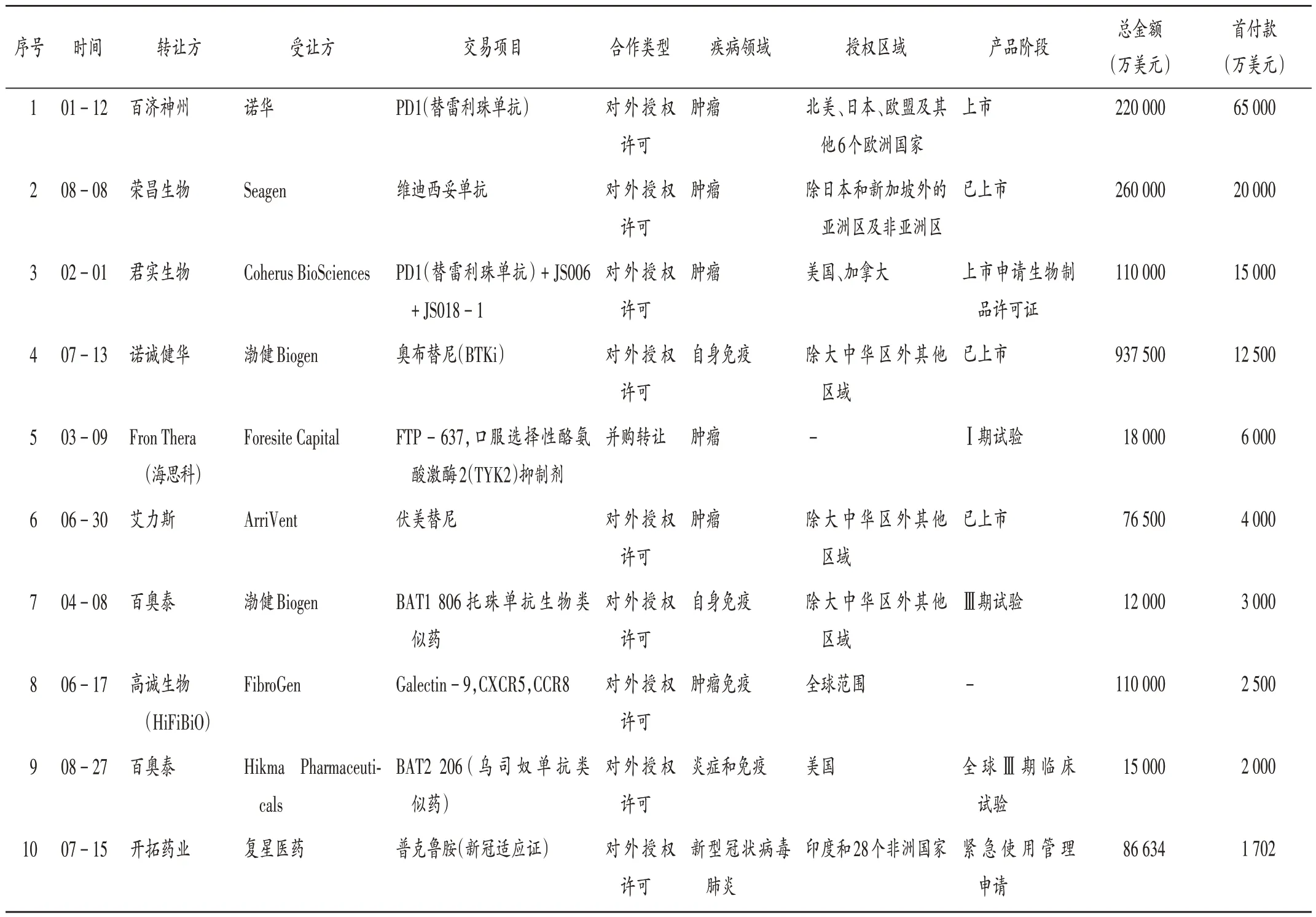
表3 中国2021年医药跨境交易资产买入排名前10的企业Tab.3 Top 10 enterprises in the asset purchase of pharmaceutical cross - border transactions in China in 2021
2 思考与建议
2.1 创新药产品应围绕疾病的临床需求
《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44 号)指出,鼓励以临床价值为导向的药物创新。国际人用药品注册技术协调会(ICH)在2020 年11 月通过了以患者为核心的药物研发(PFDD)议题文件。研发创新生物药时,要关注到肿瘤患者对延长生命及对生活质量提高的期望。从以前的无药可医,到有药可用,再到有药可选,这就需要从业者身在产业,心在患者。新药研发应以“为患者提供更优的治疗选择”为最高目标。
现在不少企业专注于“资本”,关注点集中于如何满足资本的需求、降低研发风险、获得更高的研发成功率、投入更低的研发和临床试验成本,以及能否快速IPO、资本如何获得更高的投资回报率。须知,一旦背离了临床价值,产品即便上市也难有商业价值。
2.2 仿制药行业也需要资本的大力支持
在临床领域,创新药和仿制药均大有可为。目前,国家药品集采政策背景下,资本纷纷“逃离”仿制药,涌向创新药,这很可能面临产品不被批准或临床应用价值低的风险。
2019 年 9 月 17 日和 2021 年 2 月 20 日,国家卫生健康委员会分别公布了两批鼓励仿制药品目录,说明有些仿制药仍是临床所需甚至急需的。同时,临床急需药品或短缺药品(名单由国家药监局等国家部门制定),先进的药物传输系统、靶向给药、缓控释等仿制药领域也需资本的大力支持。
3 结语
“允许未盈利企业上市”政策的股市制度改革极大地激发了资本对创新药领域的配置,成为我国创新药快速发展的重要推手。创新药领域的发展,资本应是支持者、助力者,企业才是创新的引领者。紧密围绕临床需求的创新药研发,一定能获得巨大成功,成就我国的“重磅炸弹”药物,为企业和投资者创造巨大财富。同时,仿制药和创新药是医药领域的双翼,高端仿制药和改良新药同样具有重要的临床和商业价值。
