印度块菌成熟期菌塘土壤营养与微生物多样性变化的研究*
2022-08-23曾维军王晶杨彝华和耀威刘琼波康超杨玲
曾维军,王晶,杨彝华,和耀威,刘琼波,康超,杨玲
(1.贵州省生物研究所,贵州 贵阳 550025;2.楚雄州林业与草原研究所,云南 楚雄 675005)
中国野生食用菌在国内的市场占有率逐年增高,同时在国外市场上的需求也不断上升,在整个国际市场上具有巨大的潜力,其中,印度块菌是市场重要的贸易商品物种。印度块菌(TuberindicumCooke et Massee),属于子囊菌门(Ascomycota)、子囊菌纲(Ascomycetes)、盘菌目(Pezizales)、块菌科(Tuberaceae)、块菌属(Tuber)[1],主要分布于我国云南、四川,与松科(Pinaceae)、壳斗科(Fagaceae)等树木共生[2],其子囊果埋生于地下,直径3~5 cm,球形至近球形,咖啡色、棕褐色至黑褐色[3]。从1988年我国发现印度块菌以来,其形态特征、生态习性及产地分布、生长发育过程方面的研究取得显著进步[4]。前人研究表明,印度块菌的菌塘土壤主要为石灰岩土,pH在6.0~6.8之间,土层疏松、干燥、透气性好,有机质含量高[4]。印度块菌是典型的外生菌根真菌,外生菌根真菌与林木形成共生体,不仅是当地居民收入的重要组成部分,其菌丝体与林木根系密切连结起来,还能够增强植物对氮、磷、水分以及矿质元素的汲取能力,提高植物在干旱、高温、病虫害、盐渍化、重金属等逆境下的抵抗力,增强植物在胁迫中的耐受性。大多数树木依靠菌根真菌(Mycorrhizalfungal)共生来获得营养,印度块菌的菌丝会选择性地与树木根系结合并穿透根系皮层进入皮层组织内部,在细胞间隙中蔓延生长,产生专门的“吸器”与植物直接进行营养交换,土壤养分下降会使印度块菌子囊果变小[5]。块菌属的发育过程可以简单的分成3个阶段:① 子囊孢子萌发形成菌丝;② 菌丝与宿主植物的根系形成外生菌根;③ 最终形成地下生的可食用的子囊果。块菌的共生机制比较复杂,在生活史的不同阶段皆受环境因素的影响,但块菌与宿主植物间的根部及根际微生物之间的共生机制尚不清楚。块菌菌根共生机制及子囊果形成和发育的分子机制是后基因组时代的2个重要的研究方向。印度块菌子囊果为1 a生,每年10月开始进入成熟期,12月到次年1月,达到成熟的全盛时期[6],进入成熟期后,其营养交换是否随时间的改变呈规律性变化,菌塘土壤营养变化是否与其微生物多样性改变有相关性,均未见相关研究报告。
因此,本研究以云南省楚雄州的野生印度块菌的菌塘土壤为研究对象,通过原位土壤营养成分测定和基于Illumina Miseq平台的高通量测序,从分析印度块菌成熟期不同阶段菌塘土壤营养变化规律和其真菌、细菌多样性为切入点,探讨互作关系,为揭示共生机制奠定基础,进而为印度块菌人工仿生态栽培提供理论依据。
1 材料与方法
1.1 试验材料及采样点概况
试验材料为云南省楚雄紫溪山(101.47°E、25.05°N)海拔1 896.52 m处的块菌菌塘土壤,土壤类型为红黄壤,块菌子囊果由贵州省生物研究所鉴定为印度块菌,共生树种为云南松(Pinusyunnaensis)。从10月块菌开始成熟到次年2月完全成熟,每月在预先确定已采集到子囊果的菌塘定位取土样1次,每个菌塘5点取深度为5~20 cm的土壤,然后混合均匀,整个取土过程采取避免生物污染的措施。混合土壤分成2份,其中一份自然风干、碾磨、过筛后用于测定土壤营养指标,另一份-70 ℃冷藏,用于高通量测序,检测均设置3次重复。
1.2 试验方法
1.2.1 DNA 抽提和 PCR 扩增
1.2.2 Illumina Miseq 测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用Axy Prep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA) 进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer (Promega,USA) 对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE 300平台进行测序(上海美吉生物医药科技有限公司)。
1.2.3 土壤养分指标测定
分别按照国家林业局现行行业标准LY/T 1228—1999、LY/T 1232—1999、LY/T 1234—1999、LY/T 1233—1999、LY/T 1236—1999检测土壤全氮、全磷、全钾、有效磷、有效钾含量[7-11];分别按照国家农业农村部现行行业标准NY/T 1121.2—2006、NY/T 1121.6—2006测定土壤pH和有机质含量[12-13];按照现行地方标准DB51/T 1875—2014测定土壤碱解氮[14]。
1.3 数据处理
采用方差分析确定处理之间的差异,使用邓肯法进行多重比较。使用Uparse(version 7.0.1090)进行OTU分析,其中按最小样本序列数进行样本序列抽平。使用mothur ( version v.1.30.2)计算Alpha多样性中的Chao1、Shannon指数,反映土壤中真菌、细菌群落的丰富度和多样性。基于测序数据,使用R语言工具作群落Bar图。使用R语言vegan包中rda或者cca进行冗余分析和作图。
2 结果与分析
2.1 土壤养分变化
由表1可知,块菌成熟期菌塘土壤的各养分指标除了全钾以外,其余均在次年1月达最大值,其中有效磷、全氮、碱解氮的变异系数较大,分别为88.46%、79.78%、75.38%,速效钾变异系数最小,为46.53%。菌塘土壤中碱解氮、有效磷、速效钾的变化趋势为先降后升,均在1月达最大值后降低,其中速效钾含量较高,为295.15 mg/kg,有效磷含量较低,为22.68 mg/kg。菌塘土壤的pH呈递增变化,由弱酸土变成弱碱土。
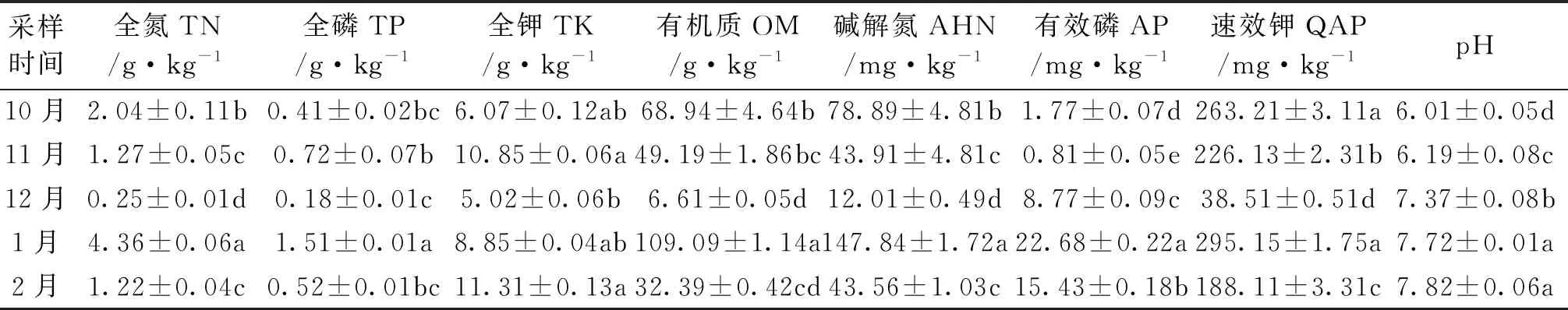
表1 土壤养分指标方差分析
2.2 菌塘土壤微生物多样性与土壤营养相关分析
由表2可知,菌塘土壤的OTU没有呈规律性变化,其中真菌的OTU最大值是在10月(546)和次年1月份(541),两者差异不显著。细菌的OTU最大值是在次年2月份(1716);真菌与细菌的Shannon指数变化趋势为先减后增,其中2月份菌塘土壤细菌、真菌的Shannon指数最高,均值分别为4.24、3.58;12月的Shannon指数最低,均值分别为1.42、1.31;11月的菌塘土壤真菌和细菌的Chao1指数菌最低,均值分别为102.01、68.01;10月和次年1月的Chao1指数均较高,两者差异不显著;11月的Chao1指数显著较低,均值分别为102.01、68.01。由图1可知,土壤中真菌、细菌的Shannon指数与QAP的相关系数较大,分别为0.81、0.83,但相关性检验不显著。
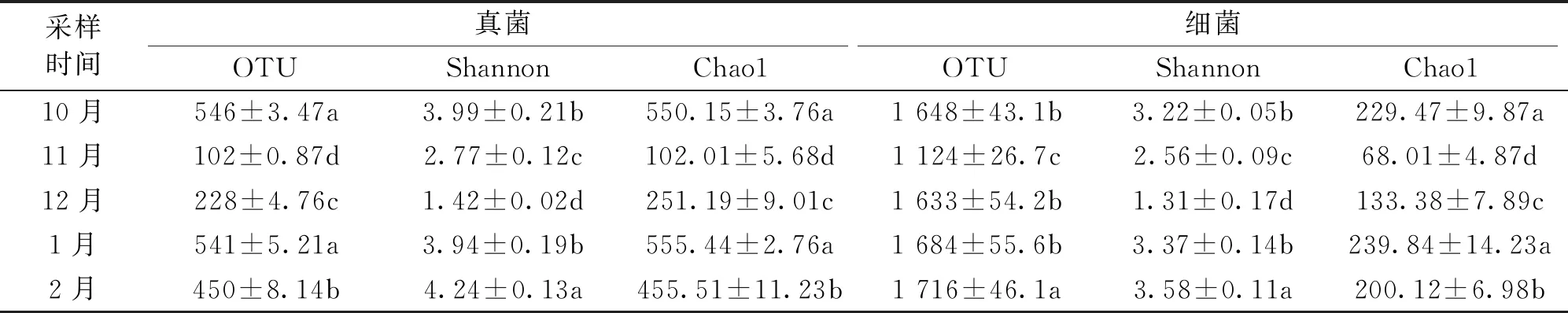
表2 不同海拔菌塘土壤微生物的丰富度和多样性指数
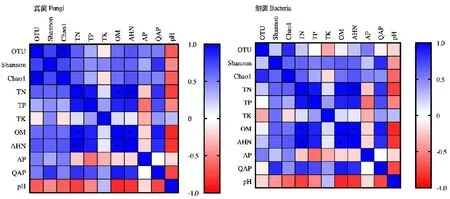
图1 土壤微生物多样性与土壤理化特性的 Pearson相关矩阵
2.3 菌塘土壤真菌门和属分类水平下群落组成分析
整个成熟期的块菌菌塘土壤真菌共检测出266 456个序列,其中10月到次年2月,每月采集的样土对应真菌序列数在41 477~57 378个之间,平均值为53 291个。由图2a可知,块菌成熟期内菌塘土壤中真菌的优势菌门为子囊菌门,基因丰度为69.52%,显著高于担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota);菌塘土壤中真菌的优势菌属为块菌属和被孢霉属(Mortierella),基因丰度分别为17.37%、13.82%,并且有10.24%的真菌不包含在现有的真菌属分类体系中。
由图2b可知,块菌成熟期的菌塘土壤担子菌门的基因丰度12月达到最高,变化范围在48.94%~94.85%之间,变异系数为24.19%;块菌属的基因只有在12月和次年1月的菌塘土壤中检测出,12月的基因丰度最高,为84.52%;土壤中被孢霉属的基因丰度11月达到最高,变化范围在2.41%~26.55%之间,变异系数为56.95%。

图2 块菌菌塘土壤真菌群落组成
2.4 菌塘土壤细菌门和属分类水平下群落组成分析
整个成熟期的块菌菌塘土壤细菌共检测出152 108个序列,其中10月到次年2月。每月采集的样土对应细菌序列数在25 056~35 555个之间,平均值为30 422个。由图3a可知,块菌成熟期内菌塘土壤中细菌的优势菌门分别是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria),基因丰度分别为31.68%、24.73%、19.99%;菌塘土壤中细菌的优势菌属为Vicinamibacteraceae菌群的细菌属,丰度为9.11%,但未知属的其他细菌丰度为41.28%。由图3b可知,块菌成熟期的菌塘土壤变形菌门的基因丰度呈明显的递减规律,丰度范围在23.28%~36.09%之间,优势菌门中变形菌门的变异系数最小,为17.46%。由图3c可知Vicinamibacteraceae菌群的细菌属的基因丰度在次年2月达最高,为18.05%。

图3 块菌菌塘土壤细菌群落组成
2.5 菌塘土壤真菌和细菌门和属分类水平下群落组成与土壤养分的相关性分析
由图4a、图4b可知,块菌成熟期菌塘土壤全磷、速效钾、pH与块菌属Tuber微生物数量呈正相关,其中pH与块菌属微生物数量的正相关性最大,全氮、有机质、有效磷、碱解氮与其呈负相关,其中同有机质的负相关性最大,同时,块菌作为优势真菌属与菌塘土壤中其他丰度较高的属(被孢霉属Mortierella、Knufia属、Saitozyma属、青霉属Penicillium)呈负相关,其中与Saitozyma属的负相关性最大。由图4c、图4d可知,块菌成熟期菌塘土壤除了pH与酸杆菌RB41呈负相关以外,其余土壤营养指标均与酸杆菌RB41呈正相关,其中速效钾与其正相关性最大;块菌成熟期内菌塘土壤中慢生根瘤菌Bradyrhizobium与有机质、全氮、碱解氮呈正相关,与有机质的相关性较大;慢生根瘤菌与全钾、pH呈负相关,与全钾的相关性较大。
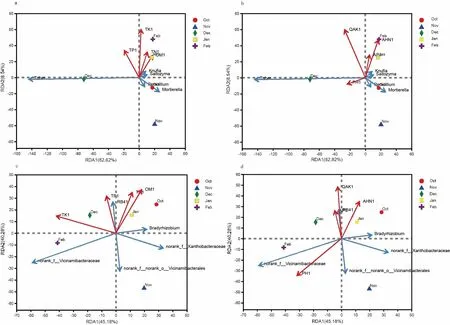
图4 属分类水平下块菌菌塘土壤真菌、细菌群落组成与养分指标的RDA
2.6 菌塘土壤真菌和细菌属分类水平下物种数目分析
由图5可知,块菌成熟期内,其菌塘土壤真菌和细菌属的数目为显著正相关(P<0.05),均呈先减后增的规律,成熟前期(11月)最少,成熟后期达到最大,物种数目变异系数分别为28.27%、7.79%。各月均没有出现独立新属,真菌的共有属类为11种,细菌的共有属类为152种。
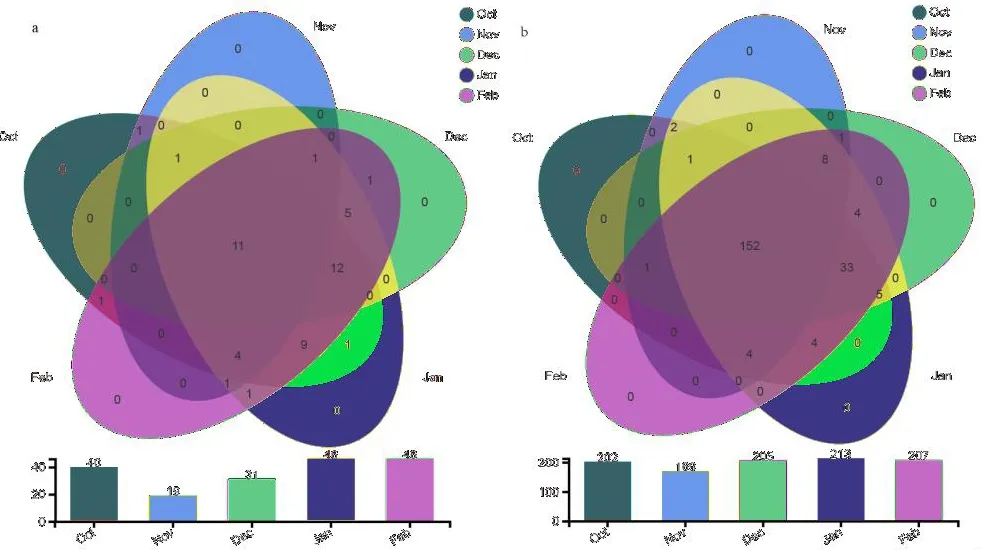
图5 菌塘土壤真菌和细菌属分类水平下物种Venn
3 讨论与结论
3.1 讨论
自然条件下适宜黑孢块菌生长的土壤 pH 值大于7.5,在匈牙利地区所分布的多个块菌种类同样是在偏碱性的土壤中生长[15-16]。本研究发现成熟期印度块菌菌塘土壤的pH呈递增变化,由弱酸变成弱碱,说明块菌生长过程中能把土壤pH改变成利于自我生长的能力。清源等[17]研究发现,全氮含量在2.29~3.70 g/kg更有利于块菌生长。本研究发现成熟期块菌菌塘土壤全氮含量在0.25~4.36 g/kg,变异度较大,变异系数为75.91%,土壤有效磷含量与土壤中真菌、细菌多样性的相关较强,相关系数为0.81。由此说明,土壤中的氮素营养对块菌成熟期生长发育影响较大,磷素可能具有通过影响土壤真菌、细菌菌群从而调节块菌生长发育的作用,作用机理有待进一步研究。本研究发现,成熟期内菌塘土壤的真菌与细菌的多样性指数——Shannon指数变化趋势为先减后增,成熟中期(12月)较低,成熟后期(2月)较高。
本研究发现在属分类水平下,块菌成熟期内的菌塘土壤真菌物种数和细菌物种数显著正相关(P<0.05),真菌的物种数目的变异系数大于细菌;块菌菌塘土壤中真菌的优势菌门为子囊菌门,优势菌属为块菌属和被孢霉属,其中被孢霉属与块菌属呈负相关,是竞争关系;细菌的优势菌门是变形菌门,其中慢生根瘤菌与酸杆菌RB41的基因丰度较高,为块菌的主要土壤伴生细菌。酸杆菌RB41是土壤碳和添加到土壤中的营养物质的高效利用者[18-22]。其除与pH呈负相关外,同其余土壤营养指标均呈正相关,说明酸杆菌RB41的含量增加可以给菌塘土壤营养带来增效作用从而促进成熟期块菌的生长发育。同时发现慢生根瘤菌含量与土壤有机质、全氮、碱解氮含量呈正相关,验证了慢生根瘤菌的固氮作用[23-24],其对菌塘土壤营养有增效作用,有利于成熟期块菌的生长发育。成熟期内菌塘土壤全磷、速效钾、pH与块菌属数量呈正相关,理论上补充土壤磷、钾含量,调节pH为弱碱性利于块菌生长,作用机理需在后续仿生栽培试验中进一步验证。
3.2 结论
在块菌成熟期,通过对菌塘土壤营养成分和真菌、细菌多样性的原位监测可得,成熟期块菌菌塘土壤的真菌、细菌多样性先降后升,次年2月达到最高,表明块菌对其他真菌、细菌有抑制作用,且与土壤中的有效磷有较高的相关性;菌塘土壤中真菌的物种数目变异系数大于细菌,真菌的优势菌门为子囊菌门,优势菌属为块菌属和被孢霉属,两者是竞争关系,其中块菌属与全磷、速效钾、pH呈正相关;细菌的优势菌门是变形菌门,基因丰度前五的酸杆菌RB41除与pH负相关以外,同其余土壤营养指标正相关,慢生根瘤菌含量与有机质、全氮、碱解氮含量正相关。所以,在块菌成熟期为了更好促进其生长,仿生栽培中理论可以补充土壤磷、钾含量,调节pH为弱碱性,加强酸杆菌RB41和慢生根瘤菌在土壤菌群中的优势,但其增效程度有待进一步验证。
