东革阿里不定根粗提物对枯草芽孢杆菌呼吸抑制及生物膜清除的影响研究
2022-08-23刘亮亮安晓丽叶玮琦朴炫春
刘亮亮, 安晓丽, 王 淼, 叶玮琦, 于 硕, 朴炫春
(延边大学 农学院,吉林 延吉 133002)
芽孢杆菌属于食品中难以杀灭的一类微生物,特别是枯草芽孢杆菌,需要极高温度才能将其杀灭,目前已作为食品杀菌的微生物衡量标准[1-2]。枯草芽孢杆菌(Bacillussubtilis)属于一种革兰氏阳性菌,常在土壤中或者空气中腐生,可用于克隆载体或生产α-淀粉酶以及蛋白酶,被认为是有益菌[3-5];但同时它也是一种条件致病菌,在人体免疫力低下时会引起各种疾病,如咽喉脓肿、败血症等;在新生儿机会菌败血症中,约20%由枯草杆菌引起,甚至其中有约40%引发了并发化脓性脑膜炎[6];并且在眼球受到穿通伤时会引发严重的外伤性枯草杆菌性眼内炎[7]。
细菌呼吸代谢是指菌细胞在呼吸作用中将体内糖类、脂类氧化代谢产生的能量供给自身生命活动的过程[8]。细菌细胞主要通过糖酵解途径(EMP)、三羧酸循环途径(TCA)、戊糖磷酸途径(HMP)等进行呼吸代谢[9-10]。若菌细胞呼吸代谢过程受抑制,菌细胞的新陈代谢过程也将受到抑制,最终导致菌体死亡。因此,通过抑制菌体的呼吸代谢过程,可以有效达到抑菌效果。另外,细菌可通过分泌胞外聚合物形成生物膜的方式保护菌体并黏附在物体表面,当细菌形成完整的生物膜后,抗生素等抗菌药物无法起到有效的杀菌作用,并且还会不断地有细菌从生物膜中逸出导致长期的感染[11-12]。目前普遍应用于抑菌、杀菌的物质是抗生素,然而由于抗生素的长期使用及滥用促使细菌对抗生素产生耐药性[13-15]。大量研究表明,植物源抑菌物质具有较强的抑菌、杀菌、抗生物膜效果,可以解决耐药问题,且具有无毒无害、对环境友好、无副作用等优势[16-18]。
东革阿里(EurycomalongifoliaJack)为苦木科东革阿里属的多年生木本植物,又称马来参、乡土人参,主要分布在东南亚国家,如马来西亚、印度尼西亚、柬埔寨、缅甸等,生长在潮湿的环境中,喜酸性砂质土壤[19]。东革阿里有多年的药用历史,根部为主要的应用部分,含有多种生物活性物质,如苦木素类、生物碱类、类固醇化合物等,有缓解疲劳、抗疟疾、抗肿瘤、抗菌、改善男性性功能障碍等功效[20]。有研究表明,东革阿里不定根提取物可通过影响枯草芽孢杆菌的细胞通透性起到抑菌作用[21],但其影响菌呼吸代谢的抑菌机制尚未报道;同时,东革阿里不定根提取物对枯草芽孢杆菌抑制生物膜的作用也不清晰。因此,该试验用东革阿里不定根粗提物对枯草芽孢杆菌的呼吸抑制作用及其所影响的呼吸代谢途径,以及清除枯草芽孢杆菌生物膜的作用进行了研究,为今后相关产品的开发奠定基础[22]。
1 材料与方法
1.1 植物材料及提取
参照Fan等[23]方法对东革阿里不定根进行培养,将培养40 d后的不定根收获、洗净、烘干。取烘干后的不定根干品,加入70%乙醇溶液,以20 mL/g的液料比,于60 ℃条件下进行超声提取,经过滤烘干获得的粗提物用于该研究的试验。
1.2 供试菌种及培养
试验所应用的枯草芽孢杆菌(Bacillussubtilis,CGMCC 1.3358),购自中国微生物菌种保藏管理委员会普通微生物中心,将供试菌种在无菌条件下用无菌接种环将其接种于牛肉膏蛋白胨固体培养基(牛肉膏3 g/L+蛋白胨10 g/L+氯化钠5 g/L+琼脂15~20 g,pH值调节至7.0~7.2),于37 ℃下培养。
1.3 方法
1.3.1 东革阿里粗提物对枯草芽孢杆菌呼吸抑制率的测定
参照Liu等[24]的方式进行试验,通过测定溶氧计算菌体呼吸速率。取2 mL菌液以及10 mL PBS于15 mL离心管,静置5 min后,将溶氧电极(DO 30,上海振脉仪器设备有限公司)插入离心管中,将离心管管口密封,静置1 min后测定其溶氧量,从而获得初始呼吸速率R0。另取15 mL离心管,加入2 mL菌液以及10 mL PBS,各加入1 mL呼吸抑制剂作为对照组,加入粗提物使其浓度达到1 mg/L作为试验组,呼吸抑制剂分别为碘乙酸(IDA)、丙二酸(MAL)、十二水合磷酸三钠(SOP),最终浓度为500 mg/L。将溶氧电极插入离心管后,密封离心管管口,测定其溶氧量,获得呼吸速率R1,测定呼吸抑制率IR。
式中,IR表示呼吸抑制剂以及提取物对枯草芽孢杆菌的呼吸抑制率;R0表示枯草芽孢杆菌的初始呼吸速率;R1表示经过呼吸抑制剂以及粗提物处理后的呼吸速率。
1.3.2 粗提物对枯草芽孢杆菌呼吸叠加率的测定
为了明确提取物抑制菌呼吸代谢的具体途径,测定菌呼吸代谢的叠加率。取2 mL菌液和10 mL PBS于15 mL离心管中,加入1 mL粗提物使其浓度达到1 mg/L,再加入3种不同的典型呼吸抑制剂0.5 mL并测定其溶氧量R2。计算叠加率SR。
式中,SR表示粗提物与典型呼吸抑制剂的叠加率;R1表示粗提物处理后的菌呼吸速率;R2表示经过粗提物和呼吸抑制剂处理后的菌呼吸速率。
1.3.3 呼吸代谢途径关键酶活性的测定
首先将1 mL菌密度为109CFU/mL和1 mL提取物加入到盛有98 mL菌培养液的锥形瓶中,菌液最终浓度107CFU/mL。提取物最终浓度1 mg/L。将上述菌液于37 ℃以转速130 r/min震荡培养4 h,离心机离心4 min转速调节至5 000 r/min,弃上清液,用无菌PBS洗涤3次,进行冰水浴超声10 min,再于离心机以5 000 r/min离心4 min,取上清液待测。
三羧酸循环(TCA)途径关键酶主要有α-酮戊二酸脱氢酶(α-KGDH)、柠檬酸合酶(CS)和胞浆异柠檬酸脱氢酶(ICDHc)。通过试剂盒测定3种酶活性,酶活性测定试剂盒购自上海源叶生物科技有限公司(中国)。根据酶活性测定试剂盒操作步骤进行操作后测定其吸光值,通过测定412 nm处吸光值确定CS的酶活性,测定340 nm处吸光值确定α-KGDH和ICDHc的酶活性。公式如下:
α-KGDH酶活性/[nmol·min-1(104cell)-1] =△A/min× 0.65
CS酶活性/[nmol·min-1(104cell)-1]=△A/min× 0.047 5
ICDHc酶活性/[nmol·min-1(104cell)-1]=△A/min× 4.285
己糖二磷酸(EMP)途径关键酶主要有磷酸果糖激酶(PFK)、己糖激酶(HK)和丙酮酸激酶(PK)3种。通过酶活性测定试剂盒测定3种酶活性,酶活性测定试剂盒购自上海源叶生物科技有限公司(中国)。根据酶活性试剂盒操作,测定340 nm处吸光值,公式如下:
PFK酶活性/[nmol·min-1(104cell)-1]=△A/min×0.225
HK酶活性/[nmol·min-1(104cell)-1]=△A/min×2.226
PK酶活性/[nmol·min-1(104cell)-1]=△A/min×5.226
1.3.4 东革阿里粗提物对枯草芽孢杆菌生物膜清除能力的测定
通过结晶紫染色法测定粗提物对枯草芽孢杆菌生物膜的清除作用,参照李小宁等[25]方法并稍作改动。具体步骤如下:将浓度为108CFU/mL的菌液200 μL加入96孔板中,于37 ℃恒温培养48 h,形成生物膜后,在每孔加入提取物,使其在孔内最终浓度为0.5~8 mg/mL,另有3孔中加入100 μL无菌培养液作为对照组,最终每孔内含有300 μL液体。于37 ℃恒温培养24 h,弃培养液以及游离细菌,用PBS进行3次洗涤,再用100 μL无水甲醇进行固定。弃掉多余甲醇后,用100 μL 1%的结晶紫染液进行染色,15 min后弃上层结晶紫染液,用无菌水清洗去浮色,待其干燥后用30%醋酸溶液脱色,取孔中液体于550 nm处测其吸光值,所得结果用于计算粗提物对生物膜的清除率。公式为:
式中,OD对照为未加粗提物的对照组经染色后测定的吸光值;OD处理为经粗提物处理后经染色后测定的吸光值。
1.3.5 枯草芽孢杆菌生物膜内蛋白质以及多糖含量的测定
根据Liu等[26]的方法测定生物膜内蛋白质及多糖含量,通过BCA蛋白定量试剂盒测定蛋白质含量,并通过苯酚硫酸法测定多糖含量。首先在96孔板中加入200 μL浓度为108CFU/mL的菌液,于37 ℃恒温培养48 h,待其形成生物膜后,加入100 μL粗提物,使总浓度为清除生物膜最低浓度,对照组加入100 μL无菌培养液。将96孔板于37 ℃恒温培养24 h。弃掉上层培养液,用PBS洗涤3次,再加1 mL PBS打散,经4 ℃离心20 min后,弃上层液体,将沉淀加入1 mL质量分数为0.85%氯化钠,于80 ℃加热30 min,再于4 ℃离心30 min,取上清液,根据BCA蛋白定量试剂盒步骤操作测得蛋白质含量,通过苯酚硫酸法在波长490 nm处测定多糖含量。
1.4 数据分析
试验均进行6次重复,数据分析使用GraphPad Prism 8软件,SPSS 25.0软件,邓肯氏新复极差测验和Studentt检验,显著水平为0.05。
2 结果与分析
2.1 东革阿里粗提物对枯草芽孢杆菌呼吸抑制率
细菌通过呼吸代谢过程产生能量,抑制细菌的呼吸代谢过程,会使细菌迅速凋亡,从而达到抑菌的目的。IDA、MAL、SOP是典型的呼吸抑制剂,IDA是TCA途径的典型呼吸抑制剂,MAL为EMP途径的典型呼吸抑制剂,十二水合磷酸为HMP途径的典型呼吸抑制剂[27]。图1为粗提物和3种典型呼吸抑制剂对枯草芽孢杆菌呼吸抑制率,由图1可以看出,MAL、SOP以及粗提物均具有较高的呼吸抑制率,说明粗提物可以抑制枯草芽孢杆菌细胞的呼吸代谢作用,从而起到抑菌作用。

图1 东革阿里不定根粗提物以及3种典型呼吸抑制剂对枯草芽孢杆菌的呼吸抑制率
2.2 东革阿里粗提物与典型呼吸抑制剂抑制枯草芽孢杆菌呼吸作用的叠加率
叠加率是衡量药物参与细菌呼吸代谢抑制途径重要指标,为探明粗提物抑制枯草芽孢杆菌呼吸作用的具体途径,测定了粗提物与典型呼吸抑制剂共同对枯草芽孢杆菌呼吸抑制作用,叠加率越低,表明其与对应的典型呼吸抑制剂在抑制枯草芽孢杆菌的呼吸代谢的途径越相似[28]。结果表明,粗提物与IDA和MAL的叠加率最低,可以确定粗提物是通过TCA和EMP途径抑制枯草芽孢杆菌的呼吸代谢(图2)。

图2 东革阿里不定根粗提物与3种典型呼吸抑制剂对枯草芽孢杆菌的呼吸抑制的叠加率
2.3 粗提物对呼吸代谢途径关键酶活性的影响
2.3.1 粗提物对TCA途径关键酶活性的影响
为进一步确定粗提物抑制枯草芽孢杆菌TCA途径的具体关键酶,测定了不同关键酶在经粗提物处理4 h后的酶活性。与对照组相比,CS和α-KGDH两种酶活性没有显著变化,而对于ICDHc来说,粗提物处理后导致其酶活性降低为0,粗提物使其完全失活。由此可以说明在TCA途径中,粗提物主要是作用于ICDHc导致其失活,从而影响TCA途径的呼吸代谢过程(表1)。
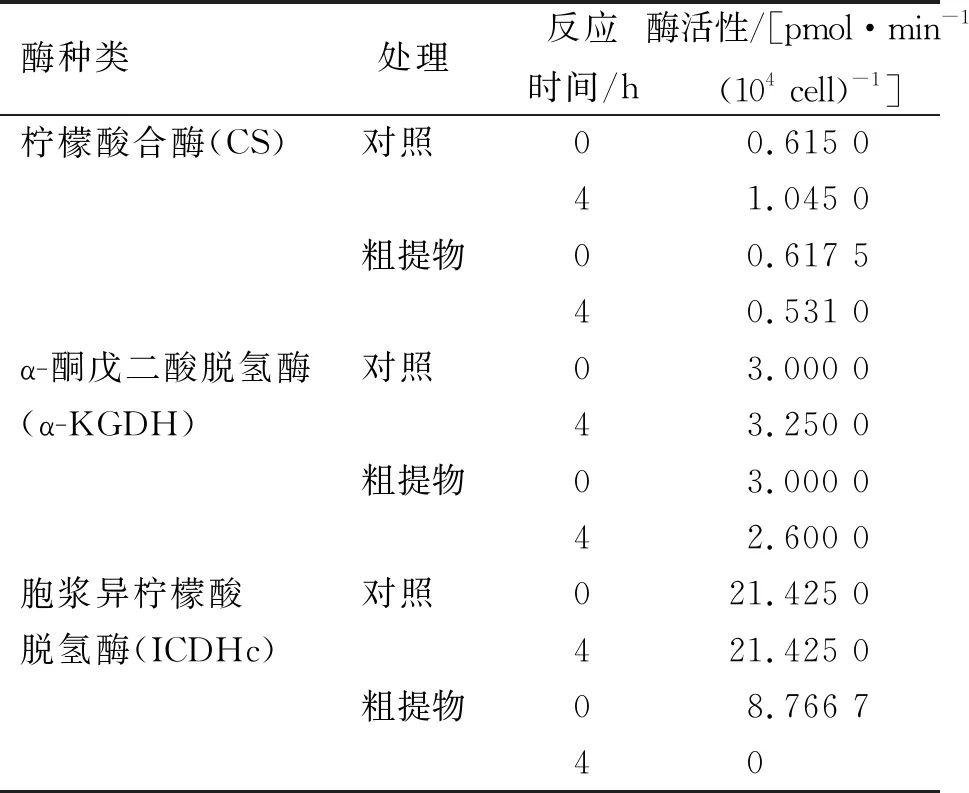
表1 粗提物对TCA途径关键酶的酶活性影响
2.3.2 粗提物对EMP途径关键酶活性的影响
为明确粗提物影响EMP途径的关键酶活性,测定了该途径不同关键酶经处理前后的酶活性。结果表明,与对照组相比,3种酶活性都有不同程度的降低,证明该粗提物可以显著抑制这3种关键酶活性,从而抑制EMP途径的呼吸代谢作用(表2)。

表2 粗提物对EMP途径关键酶的酶活性影响
2.4 粗提物对枯草芽孢杆菌生物膜的清除作用
2.4.1 粗提物对枯草芽孢杆菌生物膜的清除能力
为探究东革阿里不定根粗提物对枯草芽孢杆菌生物膜的清除作用,通过结晶紫染色法测定了粗提物对枯草芽孢杆菌的清除能力。由图3可以看出,粗提物浓度为4 mg/mL时,粗提物对枯草芽孢杆菌生物膜的清除能力达到最强。

图3 东革阿里不定根粗提物对枯草芽孢杆菌生物膜的清除能力
2.4.2 东革阿里粗提物对枯草芽孢杆菌生物膜内蛋白质以及多糖浓度的影响
为探究粗提物对枯草芽孢杆菌生物膜内物质的影响,该试验测定了生物膜中蛋白质以及多糖在经粗提物处理与未经粗提物处理的含量。结果表明,无论是蛋白质还是多糖,在经过粗提物处理后的浓度水平显著低于未处理的浓度水平,由此可以得出,粗提物可以减少生物膜内细菌分泌蛋白质以及多糖类物质,从而减少生物膜(图4)。

图4 东革阿里不定根粗提物对枯草芽孢杆菌生物膜内蛋白质及多糖含量影响
3 讨论与结论
东革阿里中含苦木素类、生物碱类等多种活性物质,可以缓解疲劳、抗疟疾、抗肿瘤、抗菌等[29],在东北亚民间常被用作药材以及滋补品。目前有研究发现,东革阿里具有良好的抑菌效果,范明智等[21]研究发现,生物反应器培养的东革阿里不定根能够通过破坏细菌生物膜的完整性,从而对包括枯草芽孢杆菌在内的多种细菌起到有效的抑制作用,在此基础上,该试验从呼吸代谢角度探究东革阿里不定根对枯草芽孢杆菌的呼吸代谢方面的影响。试验结果显示,东革阿里不定根对枯草芽孢杆菌呼吸抑制作用较强,主要通过TCA和EMP途径抑制枯草芽孢杆菌的呼吸作用,并且对两种通路的大部分关键酶都有明显的抑制作用,甚至使TCA途径的关键酶ICDHc完全失活。
据统计,有超过6成的细菌感染与生物膜相关,生物膜治理已成为医疗卫生领域的重中之重,相较于传统的物理清除及生物清除法,以植物源为材料的抗生物膜技术如今颇受关注,张恩恩等[30]发现土荆芥提取物对于幽门螺旋杆菌的生物膜形成具有抑制作用;Liu等[23]探究东革阿里不定根对金黄色葡萄球菌的抑制作用发现,东革阿里对金黄色葡萄球菌预先形成的生物膜有较好的清除作用。该试验在探究东革阿里不定根对枯草芽孢杆菌生物膜也具有较强的清除作用,并且探究其抑菌机制发现,东革阿里不定根粗提物处理后,显著降低了生物膜中的蛋白质以及多糖含量。
在抑菌研究中,东革阿里粗提物对东革阿里的呼吸代谢具有较强的抑制作用,抑制率达53.85%,通过测定粗提物与3种代谢途径典型抑制剂的叠加率发现,粗提物通过TCA和EMP途径抑制枯草芽孢杆菌的呼吸作用,通过测定这两种通路关键酶活性,发现在TCA途径中,粗提物主要是作用于ICDHc导致其活性降至0,影响TCA途径的呼吸代谢过程;在EMP途径中,粗提物对PFK、PK、HK 3种关键酶均有显著的抑制作用。在抗生物膜研究中,东革阿里不定根粗提物对枯草芽孢杆菌生物膜的清除能力较强,在4 mg/mL时,生物膜清除率达到了约67%的效果。通过对其抗生物膜的机制研究中发现,粗提物可以有效减少生物膜中的蛋白质以及多糖的浓度,从而破坏生物膜的内部结构。
综上所述,东革阿里不定根可以广泛地用作一种良好的抑菌及抗生物膜药物,为东革阿里的资源合理开发利用提供新途径,具有广泛研究和开发的价值。
