中药提取物纯化工艺的研究及应用
2022-08-22黄光伟刘文佳梁雪松
黄 静 黄光伟 刘文佳 梁雪松
(柳州两面针股份有限公司,广西 柳州 545001)
引言
本文研究的中药提取物,主要是两面针和川芎两味君药,辅以其他几味辅药[1,2]。其中两面针[Zanthoxylum nitidum(Roxb.)DC.]系芸香科花椒属藤本植物,资源丰富,应用广泛,为我国历代民间常用药,可用于治疗牙痛、神经痛、咽喉肿痛,具有祛风、通络、消肿、止痛的功效[3]。研究发现,两面针具有较好的抗肿瘤、抗炎镇痛等药理活性[4,5]。川芎为伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎,主要活性成分为苯酞类和酚酸类化合物,具有止痛、活血化淤的功效,还可以治疗心脑血管疾病[6]。
该中药提取物(以下简称MBF提取物)在提取过程中会引入药材本身的色素和杂质,导致中药提取物颜色较深、药味较重,如果将中药提取物直接应用于口腔清洁护理用品中,会直接影响产品的色泽、气味及口感,降低消费者的使用体验,无法满足一些消费者想使用中药提取物牙膏却不喜欢色泽较深的膏体的需求。因此,研究MBF提取物纯化工艺,对开发色泽较浅甚至是无色牙膏,满足消费者需求,进一步拓宽市场具有重要意义。
目前,有关中药提取物纯化的方法主要有化学和物理两种方法。化学方法一般是通过化学物质本身所具有的强氧化性破坏色素结构来达到纯化的目的,如双氧水等,但同时也会破坏功效物质,降低中药提取物功效[7];物理方法则是通过吸附剂对色素的吸附来达到纯化目的,常见的吸附剂有活性炭、活性白土、大孔树脂、氧化铝等[8-10]。本试验选择活性碳、Ca(OH)2混合物作为纯化剂,对MBF提取物进行纯化,以纯化率和指标成分阿魏酸以及异阿魏酸的保留率作为指标,考察纯化温度、纯化时间、纯化剂用量和搅拌速度四种因素对纯化效果的影响,找出较为理想的纯化工艺条件。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
MBF提取物;氢氧化钙(分析纯,天津市大茂化学试剂厂);活性碳(天津市大茂化学试剂厂);阿魏酸对照品,中国食品药品检定研究所(含量以99.0%计);异阿魏酸对照品,中国食品药品检定研究所(含量以99.2%计);盐酸(分析纯,廉江市爱廉化试剂有限公司);甲醇(色谱纯,Fisher chemical);超纯去离子水。
1.1.2 主要仪器
TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);RE52-98型旋转蒸发器(上海亚荣生化仪器厂);SHZ-D(Ⅲ)循环水式多用真空泵(河南省予华仪器有限公司);Agilent 1260 Infinity Ⅱ高效液相色谱仪系统(G7129A 1260 Vialsampler,g7111 1260 Quat Pump VL,g7114A 1260VWD);梅特勒-托利多ML204型电子天平;RCT B S25型磁力加热搅拌器(德国IKA公司);GT10-1型高速台式离心机(北京时代北利离心机有限公司);梅特勒-托利多FE20型实验室pH计;天津奥特赛恩斯仪器有限公司AS3120型超声波清洗器。
1.2 方法
1.2.1 对照品溶液的制备
分别精密称取阿魏酸与异阿魏酸对照品10.5 mg置100mL容量瓶中,加入适量甲醇,振荡溶解,再加甲醇至刻度,摇匀。制成浓度为105.00 μg/mL的阿魏酸与异阿魏酸混合标准溶液。
1.2.2 供试品溶液制备
精密称取0.2g提取液置于10mL容量瓶中,用甲醇定容至刻度,摇匀后,用0.45 μm滤膜过滤,滤液为供试品溶液。
1.2.3 吸光度的测定及纯化率的计算
从纯化前提取液和纯化后提取液中各取300μL置于10mL容量瓶中,用甲醇定容至刻度,摇匀后,用双光束紫外可见分光光度计在480 nm处测定其吸光度。
根据式(1)计算纯化率。
(1)
式中:
T——纯化率,单位为%;
A1——纯化前提取液在480 nm处的吸光度;
A2——纯化后提取液在480 nm处的吸光度。
1.2.4 指标成分的检测及保留率的计算
以MBF提取物中的阿魏酸和异阿魏酸的含量作为指标成分,采用高效液相色谱法测定纯化前后提取液中阿魏酸和异阿魏酸的含量,计算其保留率。色谱条件:DIKMA Diamonsil C18(250mm×4.6mm, 5μm);流动相:甲醇(B)-0.05%磷酸水溶液(A)为流动相,流动相梯度见下表1;流速为1.0mL/min;柱温40℃;检测波长为320 nm;进样体积为20 μL。
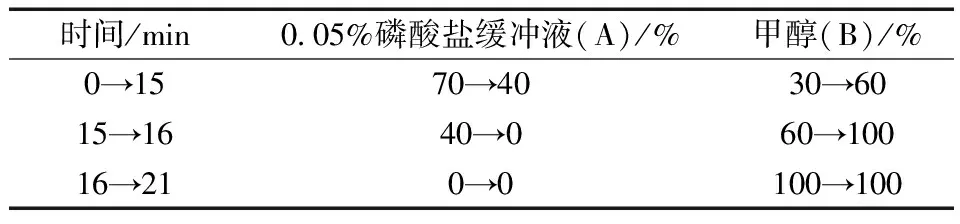
表1 流动相梯度
根据式(2)计算阿魏酸和异阿魏酸的保留率。
(2)
式中:
B——阿魏酸或异阿魏酸的保留率,单位为%;
R1——纯化前阿魏酸或异阿魏酸的含量;
R2——纯化后阿魏酸或异阿魏酸的含量。
1.2.5 纯化工艺单因素试验
(1)纯化温度:准确称取MBF提取物50g,加入0.35%的活性碳、Ca(OH)2混合物,分别在30℃、40℃、50℃、60℃、70℃条件下搅拌30min,转速为800 rpm,之后按上述方法制备供试品溶液,进样测定,计算纯化率以及阿魏酸和异阿魏酸的保留率。
(2)纯化时间:准确称取MBF提取物50g,加入0.35%的活性碳、Ca(OH)2混合物,在30℃条件下分别搅拌10min、20min、30min、40min、50min、60min、70min,转速为800 rpm,之后按上述方法制备供试品溶液,进样测定,计算纯化率以及阿魏酸和异阿魏酸的保留率。
(3)纯化剂用量:准确称取MBF提取物50g,分别加入0.15%、0.35%、0.50%、0.75%、1.0%、1.5%的活性碳、Ca(OH)2混合物,在30℃条件下搅拌30min,转速为800 rpm,之后按上述方法制备供试品溶液,进样测定,计算纯化率以及阿魏酸和异阿魏酸的保留率。
(4)搅拌速度:准确称取MBF提取物50g,加入0.35%的活性碳、Ca(OH)2混合物,在30℃条件下搅拌30min,转速分别为600 rpm、800 rpm、1000rpm、1200rpm,之后按上述方法制备供试品溶液,进样测定,计算纯化率以及阿魏酸和异阿魏酸的保留率。
2 结果与分析
2.1 纯化温度的影响
由图1可知,随着纯化温度的升高,MBF提取物中阿魏酸和异阿魏酸的保留率先逐渐增大再趋于平稳,但纯化率逐渐减小。综上考虑选取30℃、40℃、50℃为正交试验纯化温度因素的三个水平。
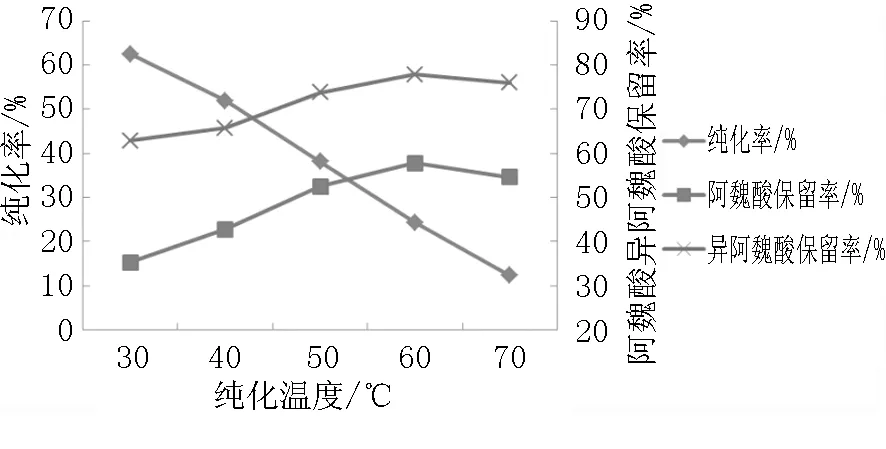
图1 不同纯化温度对纯化率以及阿魏酸和异阿魏酸保留率的影响
2.2 纯化时间的影响
由图2可知,随着纯化时间的增加,MBF提取物的纯化率呈先增加后趋于平稳再减小的趋势,同时阿魏酸和异阿魏酸的保留率先逐渐减小再趋于平稳最后再减小。综上考虑选取10min、20min、30min为正交试验纯化时间因素的三个水平。
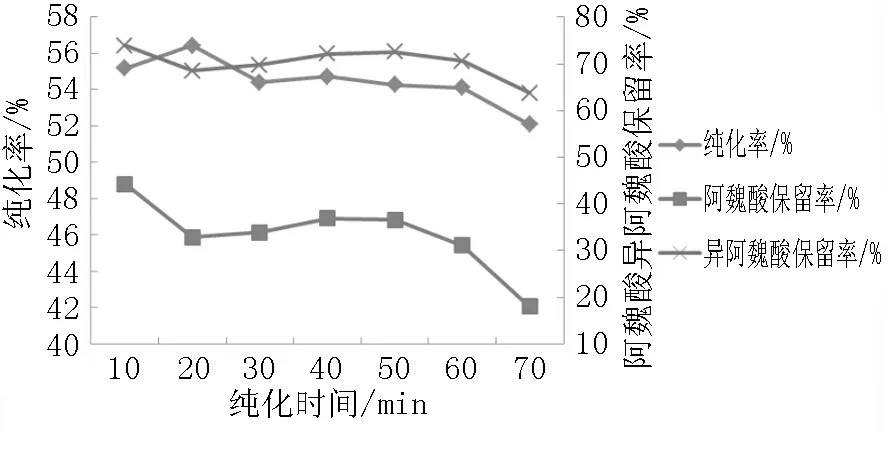
图2 不同纯化时间对纯化率以及阿魏酸和异阿魏酸保留率的影响
2.3 纯化剂用量的影响
随着纯化剂活性碳、Ca(OH)2混合物用量的增加,MBF提取物的纯化率逐渐增大,但阿魏酸和异阿魏酸的保留率逐渐较小。综上考虑,选取0.35%、0.50%、0.75%为正交试验纯化剂用量因素的三个水平。
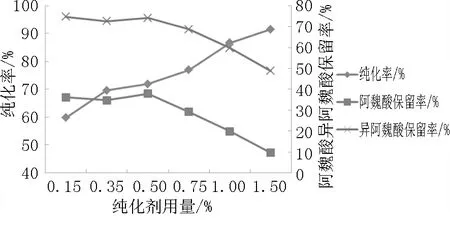
图3 不同纯化剂用量对纯化率以及阿魏酸和异阿魏酸保留率的影响
2.4 搅拌速度的影响
由图4可知,随着搅拌速度的增大,纯化率逐渐增大,而阿魏酸和异阿魏酸的保留率逐渐减小。综上考虑,选取800 rpm、1000 rpm、1200 rpm为正交试验搅拌速度因素的三个水平。
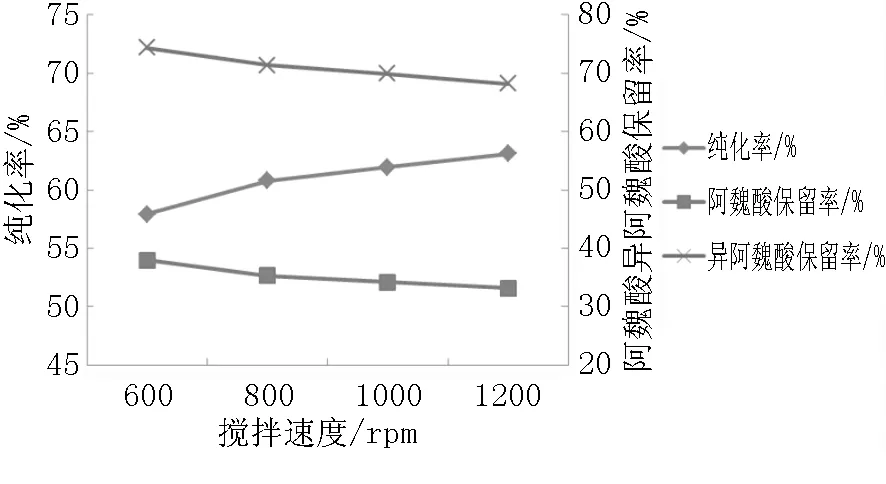
图4 不同搅拌速度对纯化率以及阿魏酸和异阿魏酸保留率的影响
2.5 正交试验
在单因素实验的基础上,以纯化温度、纯化时间、纯化剂用量、搅拌速度作为考察因素,各取3个水平,以纯化率、阿魏酸和阿魏酸的保留率作为考察指标,进行正交试验。考察因素和水平见表2,正交试验结果见表3。

表2 正交试验影响因素
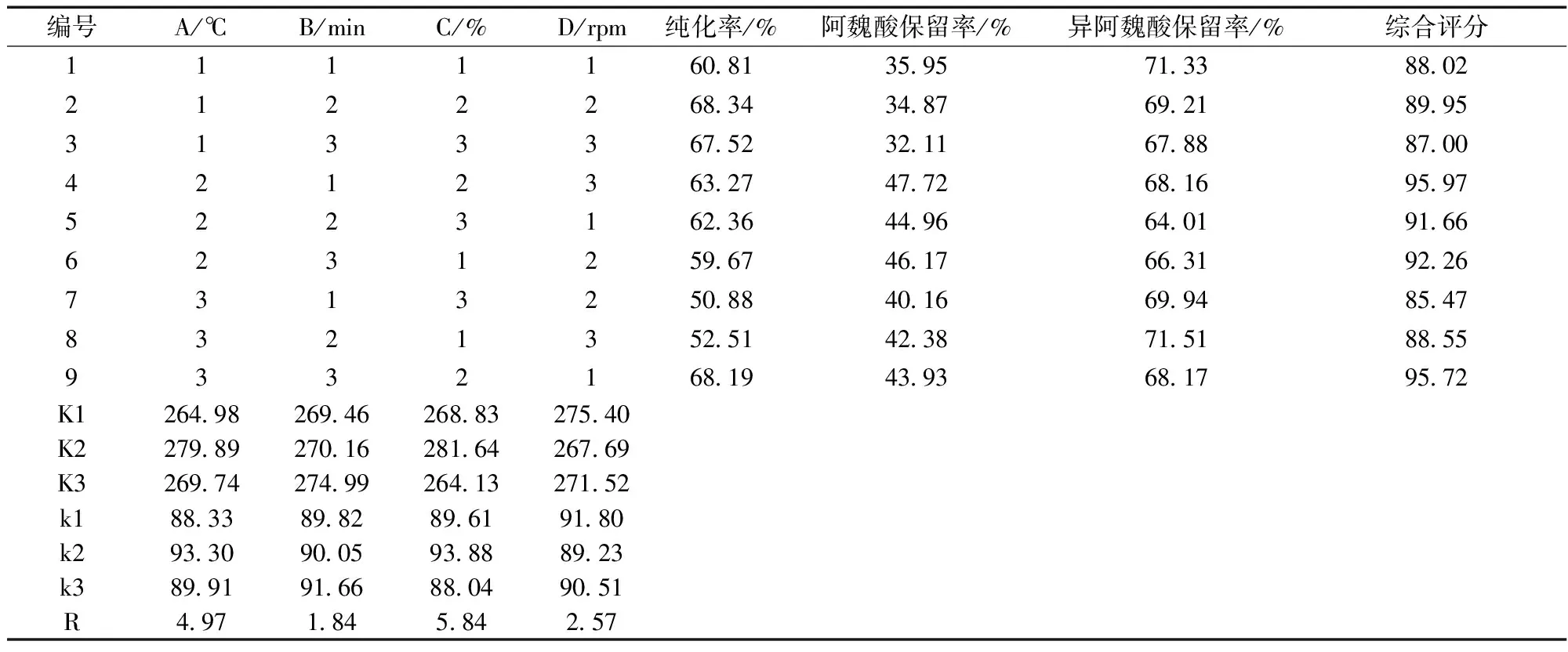
表3 正交试验结果
由表3中的极差计算结果可以看出,各因素对MBF提取物纯化效率影响的大小顺序为C>A>D>B,最佳工艺条件为A2B3C2D1。即加入0.50%的活性碳、Ca(OH)2混合物作为纯化剂,在40℃的条件下,搅拌30min,转速为800 rpm。
2.6 纯化MBF提取物在牙膏中的稳定性研究
将纯化后的MBF提取物按一定量添加到牙膏配方中,制备牙膏样品。把牙膏样品分别置于室温与45℃烘箱中,在0、1、2、3个月时,测定牙膏样品中纯化后MBF提取物中阿魏酸与异阿魏酸的含量。
结果见表4,表5。结果表明在常温与45℃条件下牙膏中阿魏酸的含量略有下降,在3个月的考察时间内,常温样品下降了10.2%,45℃样品下降了15.5%;同样在3个月的考察时间内,常温和45℃样品中异阿魏酸的含量基本保持稳定,常温样品下降了2.5%,45℃样品下降了6.2%。综上所述,纯化后MBF提取物中阿魏酸与异阿魏酸的含量在牙膏中稳定性良好,在牙膏有效期内保持其良好的功效作用,可将采用该纯化工艺的MBF提取物应用于牙膏产品中。

表4 阿魏酸稳定性试验结果
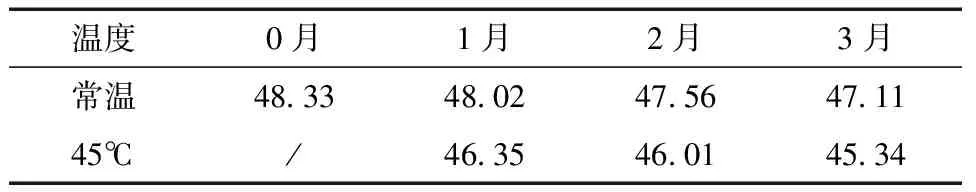
表5 异阿魏酸稳定性试验结果
3 讨论
中药提取物在提取过程中会引入药材本身的色素和杂质,直接将其添加到牙膏产品中对膏体的色泽、气味和口感造成一定的影响,为了解决这个问题,必须对其进行纯化处理。本研究采用活性碳、Ca(OH)2混合物作为纯化剂几乎不会影响提取物的功效,并且具有纯化条件温和、操作简便等优点。在单因素试验的基础上,进一步进行正交试验开展研究,最终确定了MBF中药提取物的最佳纯化工艺条件为:纯化剂用量为0.50%、温度为40℃、搅拌速度为800rpm、时间为30min。该工艺方法具有纯化率高且指标成分保留率较高的优点。将采用该纯化工艺纯化的提取物应用于牙膏产品中,可开发出膏体色泽浅、口感优,并且具有一定功效的中药牙膏。
