血清D -D、LDH及PGE2评估脓毒症血流感染患儿预后的临床价值
2022-08-20孙妍茹霍静雨
孙妍茹,霍静雨,刘 艳
(1.榆林市第一医院绥德院区儿科,陕西 榆林 718000;2.榆林市第一医院榆林院区儿科,陕西 榆林 719000)
脓毒症血流感染是一种较严重的全身感染性疾病,调查显示,院内获得性感染中约有10%为血流感染,且在与院内获得性感染相关的死亡事件中,院内获得性血流感染的发生率仅次于肺炎[1]。脓毒症感染性休克是儿科常见危急重症,儿童有效循环量显著减少,导致各组织、器官血流灌注不足。诊断及预测患儿预后,并及时实施液体复苏是挽救儿童生命和改善预后的重要措施之一。因此,早期明确脓毒症血流感染患儿的诊断,并及时予以对症治疗,对于改善患儿预后意义重大。
临床上常用血清学指标进行感染性疾病的诊断及预后评估。有文献报道,脓毒症患者的预后与神经内分泌变化及促炎/抗炎反应的平衡关系密切[2]。前列腺素E2(prostaglandin E2,PGE2)是一种强烈的免疫抑制物,对白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等致炎因子均有一定的抑制作用,在感染性疾病中可发挥关键作用[3]。此外,有学者研究发现,血清乳酸脱氢酶(lactate dehydrogenase,LDH)可参与糖酵解,在脓毒症患者中呈明显上升的趋势,且与病情严重程度关系紧密;D -二聚体(D -dimer,D -D)则是纤维蛋白原降解产物的前体,能有效反映纤溶酶、凝血酶的活性,可作为反映脓毒症患者感染程度的重要生物学指标之一[4-5]。目前,国内外血清D -D、LDH及PGE2评估脓毒症血流感染患儿预后临床价值的相关研究较少。本研究通过检测脓毒症血流感染患儿血清D -D、LDH及PGE2水平变化,探究其在脓毒症血流感染患儿短期预后评估中的价值,旨在为脓毒症血流感染的临床诊疗工作提供依据。
1资料与方法
1.1一般资料
选取2018年8月至2020年8月榆林市第一医院收治的158例脓毒症血流感染患儿为研究组,其中男94例,女64例;年龄7~13岁,平均(10.20±1.36)岁。纳入标准:①均符合2016年《脓毒症和脓毒性休克国际治疗指南》中相关诊断标准[6];②血培养检测实验结果为阳性;③患儿监护人均知情同意;④既往无严重基础性疾病,无器官移植史。排除标准:①伴恶性肿瘤、血液系统疾病;②伴先天免疫缺陷性疾病;③合并其他病毒或细菌感染;④30d内出现病毒性心肌炎、心衰或接受过心胸外科手术;⑤伴精神疾病;⑥配合度差,拒绝检测相关指标或随访。另选取50例同期招募来本院体检的健康儿童为对照组,其中男29例,女21例;年龄7~14岁,平均(10.33±1.35)岁。两组的性别、年龄等一般资料比较差异无统计学意义(P>0.05),均衡可比。本研究获得医院伦理委员审核批准。
1.2研究方法
采集对照组入院当日及研究组入院当日、入院48h后的外周静脉血5~8mL,离心分离上清。血清D -D水平采用日本Sysmex CA7000全自动凝血分析仪测定;LDH水平采用德国西门子ADVIA2400全自动生化分析仪检测;PGE2采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测,ELISA试剂盒购自上海凯基生物科技有限公司,所有操作均严格按照说明书进行。
1.3随访及分组方法
研究组患儿均自入院起随访28d,并根据第28d时患儿的治疗情况将其分为治疗有效组与治疗无效组。其中治疗无效组为在观察期内治疗无效,病情无缓解或加重;治疗有效组为经治疗后病情得到有效缓解,出院或转至其他科继续治疗的患儿。收集两组儿童的一般资料,包括性别、年龄、合并症及感染菌种等。
1.4统计学方法

2结果
2.1研究组和对照组入院时血清D -D、LDH及PGE2水平对比
研究组患儿入院时血清D -D、LDH及PGE2水平均高于对照组,差异有统计学意义(t值分别为22.072、16.740、35.737,P<0.05),见表1。
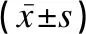
表1 研究组和对照组入院时血清D -D、LDH及PGE2水平对比
2.2不同预后情况脓毒症血流感染患儿的一般资料对比
研究组158例患儿均获随访,入院后28d内有41例(35.04%)患儿治疗无效,治疗有效组与治疗无效组患儿在性别、年龄及感染菌种等一般资料方面比较,差异均无统计学意义(P>0.05),见表2。

表2 不同预后情况脓毒症血流感染患儿的一般资料对比
2.3不同预后情况脓毒症血流感染患儿的血清学指标对比
治疗有效组及无效组患儿48h后的LDH及PGE2水平均低于本组入院时,而48h后的血清D -D水平仅有效组较本组入院时有所下降(P<0.05),但治疗有效组患儿在入院时、48h后的血清D -D、LDH及PGE2水平均低于治疗无效组同期,差异有统计学意义(t值介于2.401~8.409之间,P<0.05),见表3。
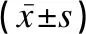
表3 不同预后情况脓毒症患儿血流感染的血清学指标对比
2.4血清D -D、LDH及PGE2指标对脓毒症血流感染患儿预后的评估价值
ROC结果显示,入院48h后血清D -D、LDH、PGE2及三者联合指标用于预测脓毒症血流感染患儿预后的AUC分别为0.679、0.822、0.855、0.950,其中D -D最低,联合预测最高(P<0.05),见图1及表4。

图1 血清D -D、LDH及PGE2指标预测脓毒症血流感染患儿预后的ROC曲线

表4 血清D -D、LDH及PGE2指标对脓毒症血流感染患儿预后的评估价值
3讨论
脓毒症血流感染主要因不同种类病原微生物入侵人血,并在血流中不断繁殖、释放代谢产物和毒素,诱导释放大量细胞因子,最终引发全身炎症反应、中毒及全身感染[7]。该病还可能导致患者的血压下降、凝血及纤溶系统出现异常,进而引发全身多器官功能障碍综合征甚至死亡[8]。目前,脓毒症血流感染的确切发病机制尚未完全明确,但研究显示,细菌内毒素、炎症介质、免疫功能及凝血功能紊乱等均是其发病因素[9]。
3.1 D -D对脓毒症血流感染患儿预后的评估价值
D -D是继发性纤溶的特异性代谢产物,其水平上升标志着凝血酶增多、继发性纤溶酶活性增大,血管内可能存在微血栓,可作为反映机体内高凝状态及纤溶亢进的有效标志物之一[10]。本研究结果在脓毒症血流感染患儿中发现了类似的结论,脓毒症血流感染患儿的血清D -D水平较正常儿童明显升高,且治疗有效组患儿在入院时、48h后的血清D -D水平明显低于治疗无效组,进一步将血清D -D用于预测脓毒症血流感染患儿预后情况分析时,其AUC达0.679,提示血清D -D对于脓毒症血流感染患儿的预后评估可能具有潜在价值,这与以往研究结果相似[11]。在脓毒症血流感染的发生发展过程中,机体内的炎症反应等会触发级联反应损伤内皮细胞,刺激释放组织因子、胶原酶等,而上述物质的释放会进一步导致机体的凝血及纤溶系统出现紊乱,引发微血栓的形成,最终导致D -D水平的升高,但抗凝药等治疗能降低D -D水平,改善患儿预后;反过来由于内皮细胞的损伤,会继续加剧释放各类炎症递质等,形成恶性循环,导致患儿的血流改变,组织灌注或供氧不足等,进一步推动病情进展[12-13]。
3.2 LDH对脓毒症血流感染患儿预后的评估价值
本研究发现,脓毒症血流感染患儿的血清LDH水平较正常儿童明显升高,且治疗有效组患儿在入院时、48h后的血清LDH水平明显低于治疗无效组,进一步将血清LDH用于预测脓毒症血流感染患儿预后情况分析时,其AUC达0.822,提示血清LDH可能是评估脓毒症血流感染患儿预后标志物之一,这与既往文献报道相符[14]。免疫及循环紊乱在脓毒症的发生、发展过程中发挥了重要作用,机体内严重的炎症反应会促使血流量、血管通透性发生改变,引发细胞及组织中出现供氧障碍。缺氧状态下,为维持正常功能,免疫细胞需通过糖酵解来获取能量,而LDH正是参与糖酵解的关键角色,可作为反映机体细胞坏死程度和机体免疫情况的重要指标之一[15]。研究发现,LDH可存在于人体的所有组织、细胞内,在糖酵解过程中,丙酮酸会在LDH的催化作用下转化为乳酸(lactic acid,LA),进而参与糖酵解的最后环节[16]。感染性疾病中由于患者的细胞被破坏,使得细胞膜的通透性变大,LDH释放增多。
3.3 PGE2对脓毒症血流感染患儿预后的评估价值
PGE2是造成炎症、发热等发生、发展的关键介质之一。在炎症反应过程中,PGE2不仅可以通过抑制T细胞、巨噬细胞、粒细胞等的活性,抑制IL-2释放,发挥免疫抑制的作用,还能够抑制TNF-α、IL-1等致炎因子,发挥抗炎作用[17]。本研究发现,脓毒症血流感染患儿血清中PGE2水平明显高于健康儿童。这可能是因为脓毒症血流感染引发的抗炎和致炎介质的级联反应,促进了环氧化酶-2的基因表达及活性,进而刺激了免疫细胞,使得下游靶细胞分泌的PGE2大大增加[18]。随访结果显示,治疗有效组患儿在入院时、48h后的血清PGE2水平显著低于治疗无效组,提示血清PGE2对于判断脓毒症血流感染患儿预后可能具有积极意义。ROC曲线显示,血清PGE2用于预测脓毒症血流感染患儿预后情况的AUC达0.855,证实了其在预后评估中具有重要的临床意义。此外,将血清D -D、LDH及PGE2联合检测,发现其较单独评价指标均具有更好的预测价值,AUC高达0.950,提示联合三项指标检测对于脓毒症血流感染患儿预后评估具有重要价值。
综上所述,脓毒症血流感染患儿的血清D -D、LDH及PGE2水平明显高于健康儿童,监测上述指标对于评估脓毒症血流感染患儿预后具有重要意义。
