不同来源乳铁蛋白对幼鼠肠道发育的影响*
2022-08-20程智美王文利李泽阳孟庆勇戴蕴平张雅丽
程智美 王文利 李泽阳 孟庆勇 戴蕴平 张雅丽**
(1)中国农业大学食品科学与营养工程学院,北京 100083;2)中国农业大学生物学院,北京 100193)
乳铁蛋白(lactoferrin,LF)是由约690个氨基酸构成的一种糖基化蛋白质[1]。LF多肽链两端折叠成两个对称的球形叶,中间由α螺旋连接,且两个球形叶内分别含有一个铁结合位点。现有文献已经证明LF具有促进铁吸收[2]、调节细胞增殖和分化[3]、抗菌[1]、抗病毒[4]等功能活性。
LF是母乳中第二丰富的乳清蛋白。在人初乳中LF浓度可高达5.8 g/L,在人成熟乳中也可达到2.0~3.3 g/L[5],显著高于牛初乳(0.82 g/L)[6]和牛成熟乳(0.1 g/L)[7]中的LF含量。母乳中高浓度的LF在新生儿出生初期起着重要作用,尤其在新生儿抗感染方面,如新生儿对败血症和坏死性小肠结肠炎[8-9]的抵抗方面。现有研究发现,生命早期LF的摄入可以促进仔猪的免疫细胞发育[10]、骨发育[11]和神经发育[12]等。
众所周知,肠道是机体消化吸收营养物质和机体抵御外界病原微生物入侵的重要场所。哺乳期是肠道生长发育、建立成熟肠道屏障系统的最关键时期。LF作为母乳中一种重要的活性蛋白,已经被证明可以在体外促进Caco-2细胞的增殖与分化[13-14]。在体内实验中,Hu等[15]也证明了在7日龄仔猪饮食中添加重组人源乳铁蛋白(recombinant human Lactoferrin,rhLF)能够改善肠道免疫反应[16],提高肠道菌群多样性。但目前还没有母乳中缺失LF及补充LF后对幼体肠道发育影响的报道。另外,不同物种来源的LF氨基酸序列、糖基化位点及数量并不相同。人源LF、牛源LF和鼠源LF氨基酸序列相似性可达78.04%。人源LF含有3个潜在的N-糖基化位点:天冬酰胺(Asn)138、479、624;牛源乳铁蛋白有5个潜在的N-糖基化位点:Asn233、281、368、476和545;鼠源乳铁蛋白只有1个潜在的N-糖基化位点:Asn476[17]。这些不同都可能导致不同来源LF具有不同的生物学作用[3]。因此,本研究选取LF基因敲除的C57BL/6N作为哺乳母鼠以导致哺乳期乳鼠无LF的摄入,通过人工补充喂养rhLF及牛乳铁蛋白(bovine Lactoferrin,bLF),比较小肠发育相关指标的变化,探讨哺乳期LF的添加及不同来源LF对幼鼠肠道发育的影响。
1 材料与方法
本研究获得中国农业大学动物伦理委员会批准(伦理批准号:SyxK 2020-0052),并遵循实验动物福利伦理审查指南照顾和使用动物。
1.1 材料、动物与试剂
rhLF由中国农业大学生物学院戴蕴平课题组提供,为牛乳腺生物反应器高效表达的人LF经纯化后获得的蛋白质,纯度≥90%;牛乳铁蛋白(bLF)购买于美国Sigma公司,为牛乳中分离纯化后获得,纯度≥85%。
杂合LF基因缺陷小鼠(品系C57BL/6N,清洁级)由北京百奥赛图基因生物技术有限公司定制。
生理盐水,Leagene公司;麦芽糖酶试剂盒、乳糖酶试剂盒,南京建成科技有限公司;BCA蛋白试剂盒,上海碧云天生物技术有限公司;RNA提取试剂盒,Magen公司;cDNA反转录试剂盒、UltraSYBR Mixture,康为世纪生物科技有限公司。
1.2 仪器与设备
分析天平,德国赛多利斯公司;高速低温离心机、Nanodrop 2000,Thermo公司;PCR仪,美国应用公司;恒温培养箱(DHP-9082),上海一恒科学仪器有限公司;切片机(RM2016),Leica公司;摊片机(KD-P/51230),江苏省金华市科迪仪器设备有限公司;烤片机,天津市天利航空机电有限公司;全波长酶标仪,美国Thermo Fisher公司;倒置显微镜,日本Nikon公司;移液器,德国Eppendorf公司;荧光定量PCR仪,德国Qiagen公司。
1.3 方法
1.3.1纯合型LF小鼠的构建与鉴定
LF基因在9号染色体正链上,全长约23.5 kb,有17个外显子。分析LF基因结构,选择将外显子3~8删除。sgRNA分别设计在内含子2和8中,大约造成4 kb的基因组缺失,从而达到LF基因敲除的目的(图1)。采用百奥赛图公司基于CRISPR/Cas9开发的EGE系统制备模式小鼠。通过Cas9/gRNA载体显微注射入小鼠受精卵细胞植入到假孕小鼠的子宫内,得到嵌合体的F0代小鼠。将鉴定为可遗传基因型的F0代小鼠分别与野生型小鼠交配获得具有稳定基因型的F1代小鼠。F1代小鼠基因型鉴定引物设计原则如图2。通过PCR技术鉴定F1代是否为LFko/wt的阳性小鼠;F1代的阳性小鼠进行杂交,采用PCR技术筛选出基因型为LFko/ko阳性小鼠,表1为鉴定基因型LFko小鼠所用引物。

Fig.1 Constructive strategy of LF knockout mice
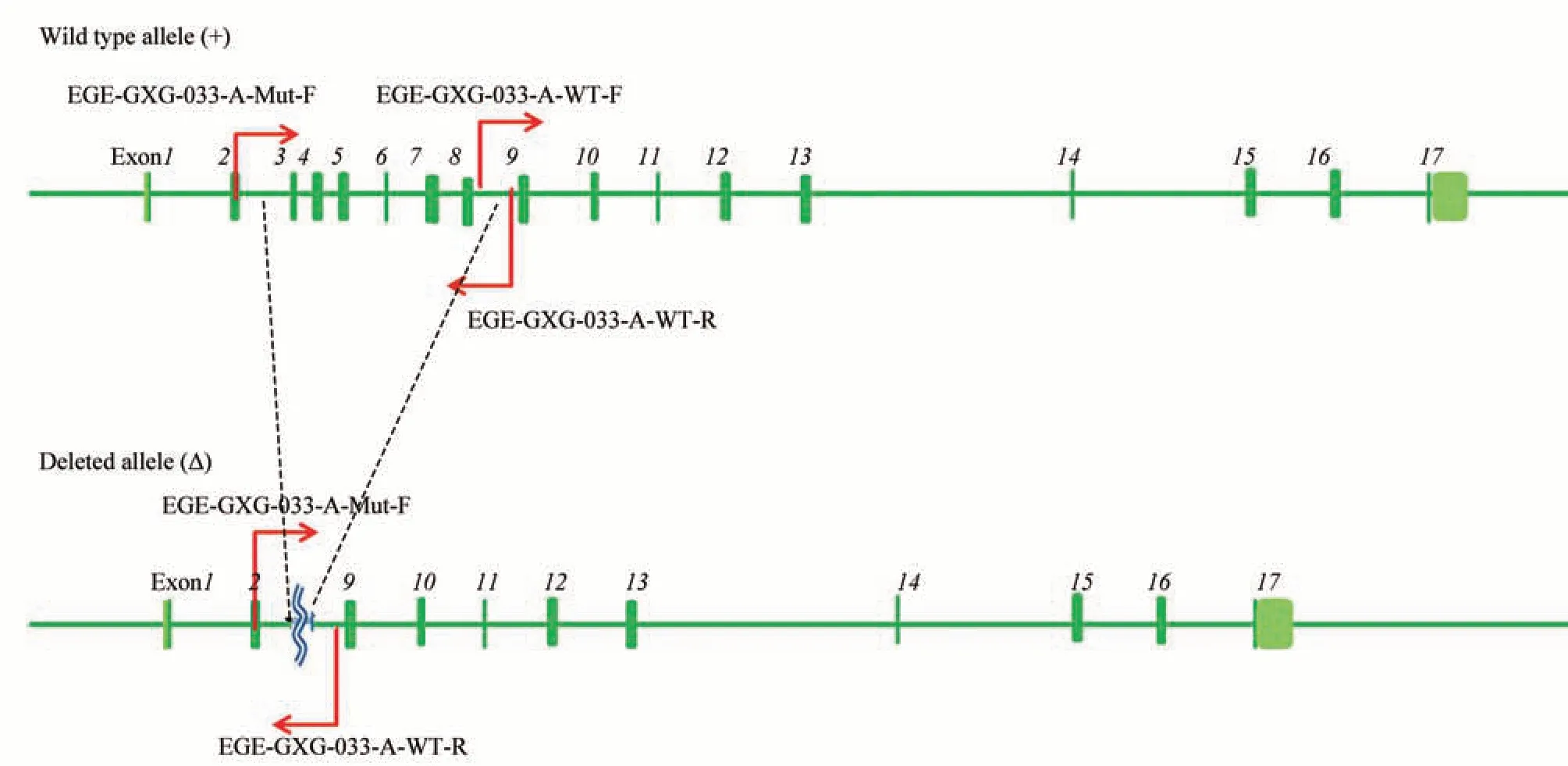
Fig.2 Schematic design of primers for LF knockout mouse identification
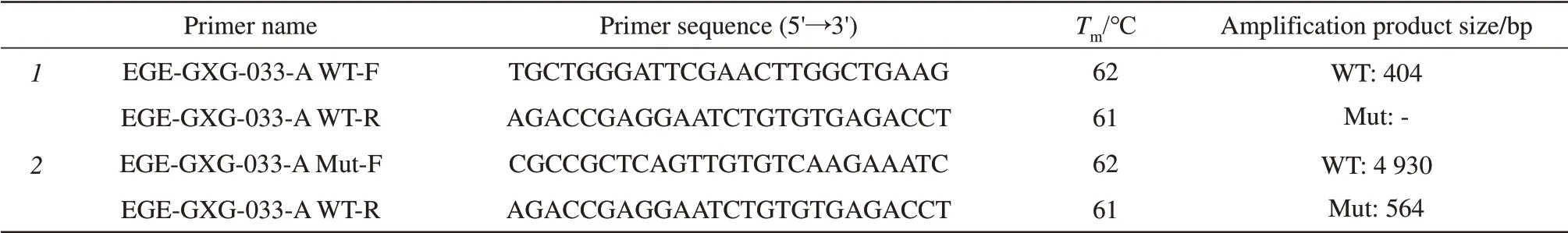
Table 1 Primer information of LFko mouse gene identification
1.3.2乳鼠的繁育与饲喂
杂合子繁育得到的纯合LF基因缺陷(KO)和同窝野生型(WT)小鼠用于纯合子繁育,以得到大量年龄匹配的WT和KO小鼠用于实验。KO和WT纯合子小鼠同一时间合笼交配。分娩后,将WT新生小鼠(仅WT基因型新生小鼠用于后续实验)随机分为4组,每组6只:牛乳铁蛋白组(bLF组)由KO母鼠进行喂养并每日人工饲喂bLF(100 mg/kg);重组人乳铁蛋白组(rhLF组)由KO母鼠进行喂养并每日人工饲喂rhLF(100 mg/kg);BSA阴性对照组(BSA-组)由KO母鼠进行喂养并每日人工饲喂BSA(100 mg/kg);BSA阳性对照组(BSA+组)由WT母鼠进行喂养并每日人工饲喂BSA(100 mg/kg)。100 mg/kg的剂量是根据婴幼儿乳铁蛋白摄入量计算及参考已发表文献[12],稍作修改得到。实验期间所有母鼠被安置在一个12 h光/暗循环的可控环境中,自由获取食与水。各成分的人工饲喂是通过人造硅胶乳头刺激新生小鼠自我吸吮,以减少人为刺激。
1.3.3组织样本的采集与保存
乳鼠饲喂21 d后注射麻药后颈椎脱臼处死,采集肝脏、脾脏、肾、胸腺、小肠组织称重,并测量小肠组织长度。切取部分十二指肠、空肠、回肠固定于4%多聚甲醛中,剩余组织-80℃冻存备用。
1.3.4麦芽糖酶和乳糖酶活力测定
取小肠组织进行匀浆,离心取上清液。按照麦芽糖酶和乳糖酶测试试剂盒说明书进行后续操作,使用酶标仪记录505 mm下的A值,并计算酶活力。
1.3.5小肠组织形态学观察
取固定好的样品进行组织石蜡包埋。切取厚度为5µm的薄片于载玻片,脱蜡后进行苏木精-伊红染色(hematoxylineosin,HE)并置于光学显微镜下观察。测量小肠绒毛长度及隐窝深度并计算其比值。
1.3.6Occludin和ZO-1基因表达量检测
根据RNA提取试剂盒说明,提取RNA进行反转录,所得到的cDNA-20℃保存。利用Primer软件设计基因特异性引物(表2),以GAPDH为内参基因,参照荧光定量PCR试剂盒操作进行基因表达量的检测。

Table 2 Primer information for qPCR experiment
1.3.7数据分析
数据以平均值±标准误差(SEM)表示。使用SPSS 19.0软件进行统计学分析,单因素方差分析(ANOVA)和事后最小显著性差异(LSD)分析各组间的显著性差异。如果P<0.05,则认为差异显著。
2 结 果
2.1 LF敲除小鼠纯合子的筛选鉴定
利用表1给出的2对基因型鉴定引物对小鼠进行基因型PCR鉴定,筛选出LFko/ko小鼠和LFwt/wt小鼠,部分结果见图3。引物1 PCR鉴定显示(图3a),LFwt/wt(野生型)和LFko/wt(杂合子)小鼠显示为1条404 bp大小的条带。引物2鉴定显示(图3b),基因型LFko/ko和LFko/wt小鼠显示为1条大小为564 bp的条带。根据PCR实验后的凝胶电泳结果判断动物的基因型(表3)。如通过图3可以判断样品1~3、6、8为LFko/wt杂合子;样品4、7为LFko/ko纯合子;而样品5为LFwt/wt纯合子。纯合子被筛选出后,近亲繁殖,扩大纯合子规模,以备后期实验。
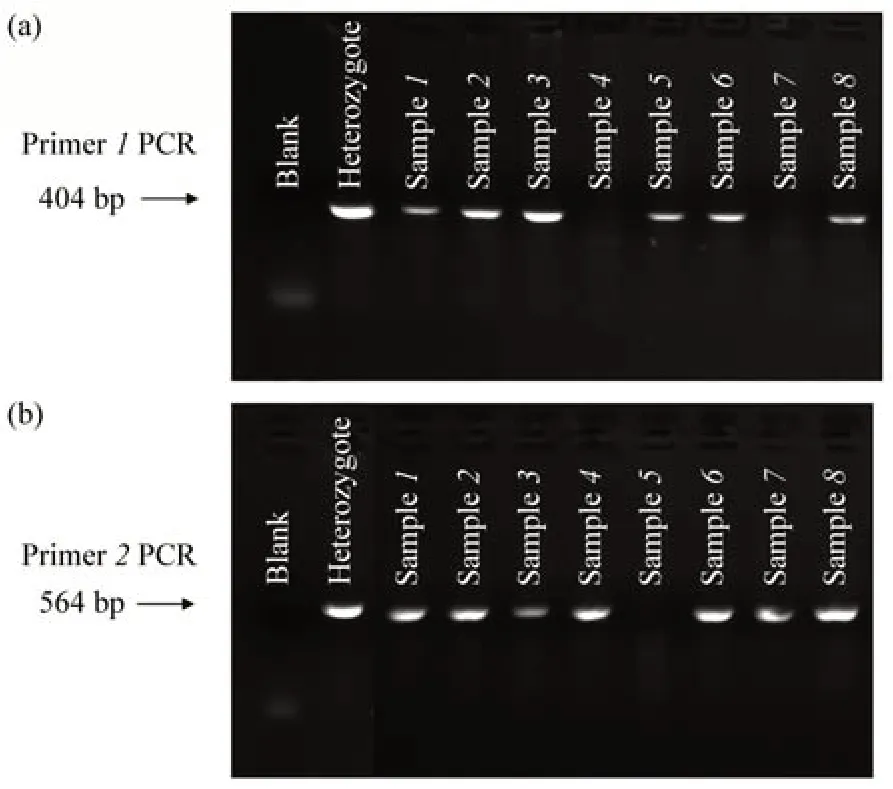
Fig.3 PCR identification results of mice with LFko/ko,LFwt/wt genotypes
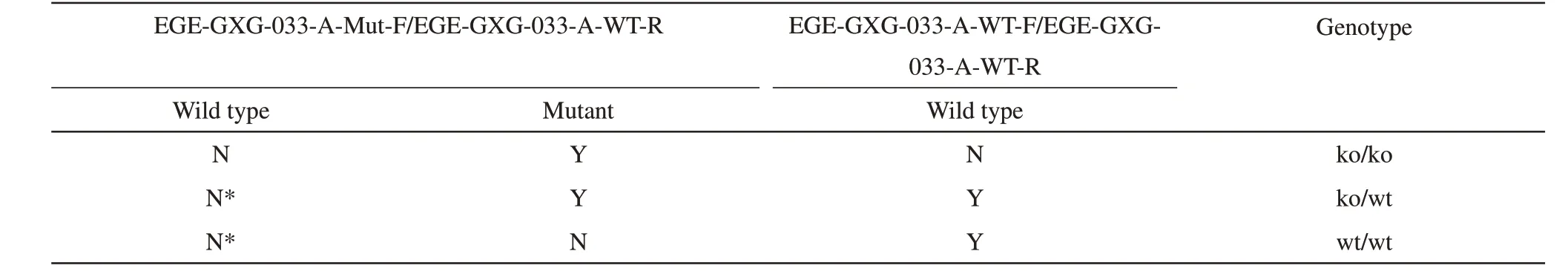
Table 3 Genotype comparison of animal based on expected gel electrophoresis results after PCR experiment
2.2 LF对乳鼠肠基础指标的影响
对纯合子进行自繁,然后将获得的所有野生型仔鼠分为4组,分别为由LFko/ko基因型母鼠哺乳并人工饲喂BSA的BSA-组,饲喂bLF的bLF组,饲喂rhLF的rhLF组,以及由LFwt/wt基因型母鼠哺乳并人工饲喂BSA的BSA+组。无论是bLF还是rhLF的添加对幼鼠的体重均无显著性影响(图4a)。
单位长度下小肠的质量即肠密度是反应小肠发育情况的一项指标。4组小鼠的小肠指数与小肠密度均无显著性差异(图4b,d),但哺乳期有rhLF摄入的小鼠小肠长度显著低于BSA+和bLF组小鼠(P<0.05),且与BSA-组小鼠差异不显著(图4c)。
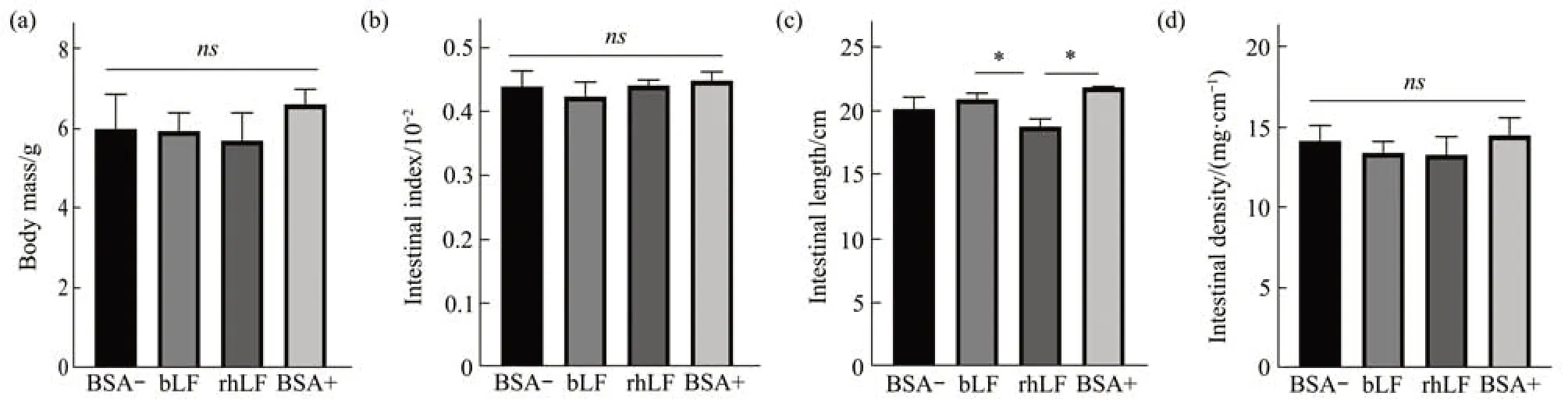
Fig.4 Effects of LF on body weight and basic intestinal indexes in suckling pups
2.3 LF对乳鼠回肠形态的影响
对回肠的绒毛长度及隐窝深度进行测定,哺乳期饲喂rhLF的小鼠回肠绒毛长度显著高于其他3组(P<0.05,图5a),且隐窝深度显著低于其他3组(P<0.05,图5b)。从小肠绒毛长度/隐窝深度比值(Vh/Cd)的结果看出(图5c),哺乳期有rhLF摄入的小鼠Vh/Cd值显著高于其他3组小鼠(P<0.05),说明了哺乳期rhLF的摄入促进了回肠绒毛及隐窝的发育,对小肠吸收功能的成熟具有重要意义。
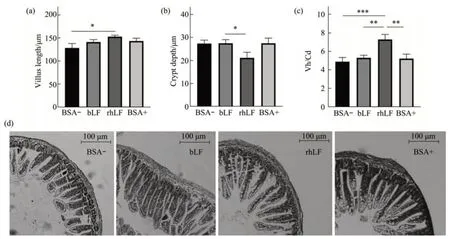
Fig.5 Effect of LF on the appearance of ileum in suckling pups
2.4 LF对乳鼠小肠组织二糖酶活性的影响
鉴定小肠组织的发育成熟度,可以通过测定组织中麦芽糖酶和乳糖酶的活性来进行评价,其中乳糖酶活性越高代表小肠发育越不成熟,而麦芽糖酶活性越高代表小肠发育越成熟[18]。本文分别测定了十二指肠、空肠和回肠的麦芽糖酶和乳糖酶活性。4组小鼠十二指肠的麦芽糖酶活性无显著性差异(图6a)。与阴性对照BSA-组相比(图6b),哺乳期饲喂bLF和rhLF的小鼠的十二指肠乳糖酶活性分别降低了37.14%(P<0.01)和43.29%(P<0.01),但都显著高于阳性对照组BSA+的乳糖酶活性(P<0.01)。另外,阳性对照BSA+组十二指肠麦芽糖酶活性/乳糖酶活性比值(M/L)显著高于其他3组(P<0.001),与阴性对照BSA-组相比,bLF组和rhLF组十二指肠M/L值显著性增加(P<0.05)(图6c)。
4组小鼠的空肠麦芽糖酶活无显著性差异(图6d)。BSA+组小鼠空肠乳糖酶活性相比BSA-组小鼠下降了36.79%(P<0.05),bLF组、rhLF组相对于BSA-及BSA+组小鼠空肠乳糖酶活性无显著性差异(图6e)。与阴性对照BSA-组相比(图6f),bLF、rhLF、BSA+组小鼠空肠M/L值分别上升了23.68%(P>0.05)、45.86%(P<0.05)和119.87%(P<0.01)。
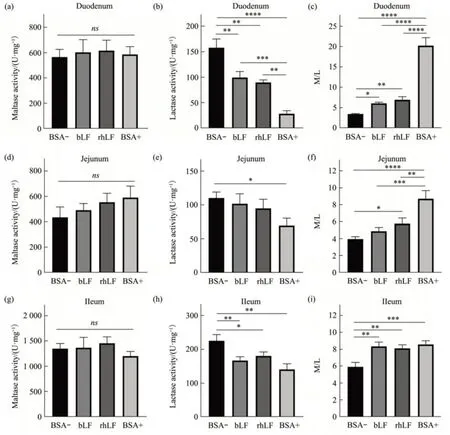
Fig.6 Effect of LF on disaccharidase activity of small intestinal in suckling pups
4组小鼠的回肠麦芽糖酶活无显著性差异(图6g)。另外,与BSA-组小鼠相比,其他3组回肠乳糖酶活性均显著性下降(图6h)。与阴性对照BSA-组相比(图6i),bLF、rhLF、BSA+组小鼠回肠M/L值分别上升了40.98%(P<0.05)、37.17%(P<0.05)和44.95%(P<0.05)。
2.5 LF对乳鼠回肠Occludin及ZO-1表达的影响
Occludin和ZO-1是两种构成小肠细胞间紧密连接的重要蛋白质。与阴性对照BSA-组相比(图7a),哺乳期有rhLF摄入的小鼠回肠组织Occludin表达量增加了20.18倍(P<0.001),而bLF与BSA+组表达量无显著性差异。另外,与阴性对照BSA-组相比(图7b),rhLF组小鼠回肠ZO-1表达量增加了2.11倍(P<0.05),但bLF与BSA+组表达量无显著性差异。
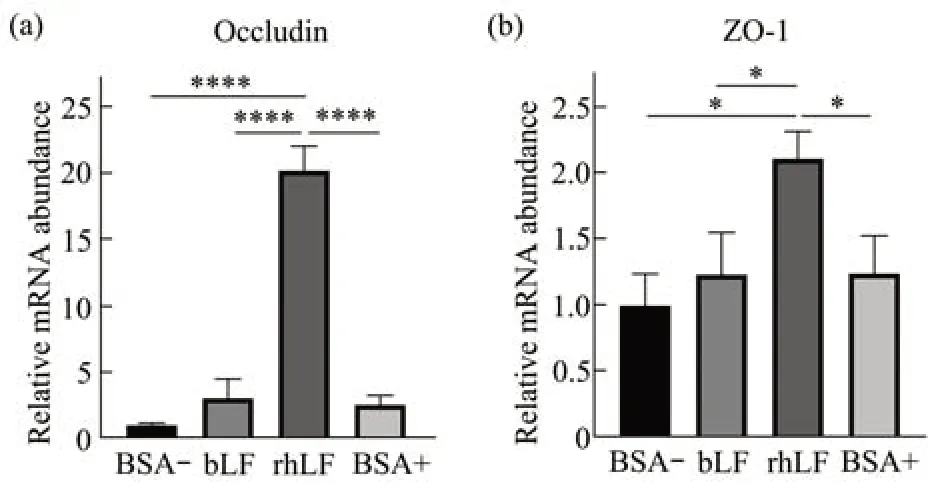
Fig.7 Comparisons of LF on Occludin and ZO-1 expression of ileum in suckling pups
3 讨 论
为了探究哺乳期LF的缺失及不同来源LF对幼鼠肠道生长发育的影响,本研究选取bLF和rhLF两种乳铁蛋白,分别对哺乳期无LF摄入的小鼠进行补充喂养并在21 d时测定其肠道发育情况。结果显示,rhLF的补充显著性增加小鼠回肠绒毛长度/隐窝深度值、上调回肠Occludin及ZO-1基因的表达,并提高小鼠十二指肠、空肠及回肠二糖酶M/L值。但bLF的补充仅显著性增加了小鼠十二指肠及回肠二糖酶M/L值。
生命早期是机体建立小肠分级结构和多功能的关键时期,在此时期正确建立小肠上皮和隐窝具有重要意义。小肠绒毛高度与隐窝深度的高比例已被视为营养消化吸收能力提高的标志[19]。本研究发现,哺乳期rhLF的添加有利增加了回肠绒毛长度并减少了隐窝深度,Vh/Cd值显著性增大,这说明rhLF组小鼠可能比其他3组具有更高的消化吸收能力。Hu等[20]对哺乳期乳猪添加bLF饮食的研究中发现,bLF的添加显著提高了第8天和第21天乳猪空肠Vh/Cd值,而对回肠Vh/Cd值无显著性影响。LF对肠道形态的不同影响可能是由于不同来源的LF及不同浓度LF对小肠上皮细胞分化和增殖的调控不同[13,21-23]。此外,绒毛和隐窝的结构变化通过影响二糖酶的活性来影响小肠对碳水化合物的利用效率[24]。乳糖酶活性在新生儿出生后迅速发展达到最大值,并随着小肠的发育成熟其活性逐渐降低至稳定水平,而麦芽糖酶活性随个体的肠道发育成熟而逐渐升高。因此M/L值可用来表征肠道发育成熟程度[18]。早在2001年,Zhang等[25]在高表达(12 g/L)hLF转基因母鼠哺乳的10日龄幼鼠中观察到十二指肠M/L值显著提高。本研究中也发现哺乳期bLF和rhLF的添加显著提高了十二指肠和空肠M/L值。另外,本研究发现,与阴性对照组相比,哺乳期bLF和rhLF的添加显著增加了回肠M/L值,且rhLF的添加还显著增加空肠M/L值。LF对不同肠段二糖酶的影响不同可能是由于LF浓度及给药方式及处理时间不同引起的。总之,这些结果表明哺乳期LF的添加能够促进小肠的发育成熟并提高其对碳水化合物的利用效率。
肠屏障是机体对抗外界不利因素的第一道防线。机械屏障是肠屏障中最重要的一种,肠黏膜上皮细胞通过紧密连接蛋白互相连接,形成完整的生物屏障。细胞质跨膜蛋白与衔接蛋白形成的复杂蛋白质网络结构是肠上皮细胞间紧密连接的重要组成部分。Occludin是最早发现的紧密连接蛋白,通常Occludin通过细胞膜外部与相邻细胞结合以产生旁闭合[26]。ZO-1能够通过与Occludin的相互作用连接跨膜蛋白和细胞骨架,影响细胞间的紧密联系,从而调节其通透性[27]。这两种蛋白质的表达减少或结构损伤会破坏肠道屏障功能,导致肠壁通透性增加[28]。本研究发现,与阴性对照组相比,rhLF组小鼠回肠组织中Occludin的表达量上调了20.18倍(P<0.001),ZO-1的表达量上调了2.11倍(P<0.05)。在体外对Caco-2细胞的研究中发现,50 mg/L和100 mg/L浓度的bLF能够显著上调Occludin和ZO-1的表达[13]。但在本研究中,bLF对小鼠回肠组织这两种蛋白质的表达有上调现象但并不显著,其可能是因为本实验使用的bLF浓度较小且经过胃肠道消化后并未能达到体外实验所用bLF浓度。总之,哺乳期LF的补充增强了乳鼠回肠组织Occludin和ZO-1的表达,且rhLF的增强效果较bLF更加显著。
4 结 论
不同来源的LF在氨基酸结构、糖基化位点和糖基化程度上都有所差别,本实验发现,缺失LF摄取的乳鼠肠道发育成熟度明显下降,而人工饲喂不同来源的LF进行回补后,乳鼠的肠道发育成熟度、消化吸收能力、肠道屏障功能均得到明显改善。并且bLF和rhLF的回补效果也有所差异,rhLF比bLF表现出更有效的作用。这说明不同来源的LF由于其结构的差异性,可能导致其对乳鼠肠道细胞的生理功能产生差异。这些结果提示,在进行初生婴幼儿食品添加LF时,应该进行更深入的科学探索。
