gbpC和gbpD基因在盘基网柄菌细胞趋化性和趋电性运动中的差异研究*
2022-08-20蒋锐达王家家赵三军王晓燕高润池
蒋锐达 王家家 赵三军 王晓燕 高润池
(云南师范大学能源与环境工程学院,生命科学学院,生物能源持续开发利用教育部工程研究中心,云南省生物质能与环境生物技术重点实验室,昆明 650500)
迁移是细胞最重要的属性之一,是细胞在接收到迁移信号或感受到某些物质的浓度梯度后产生的位置改变的行为。在高等真核生物体中,细胞受到胞外环境信号诱导后会朝特定方向发生迁移,从而影响胚胎发育、血管生成、伤口愈合、免疫反应、炎症反应、动脉粥样硬化、癌症转移等重要的生理和病理过程。在诸多环境信号中,由环境中化学信号引起的细胞定向迁移行(称为趋化性)被研究得较深入,其机制和信号通路等研究也较为透彻[1]。而近年来,人们观察到在高等真核生物体中广泛的存在着生物电信号[2],其同样可以指导许多类型的细胞发生定向的迁移(称为趋电性),例如,干细胞[3]、癌细胞[4-5]、上皮细胞[6-7]、神经轴突[8]、盘基网柄菌细胞[9]、神经嵴细胞[10]等。总体上,大部分的细胞在直流电场中朝阴极迁移,而少部分细胞朝阳极迁移,极少数则根据条件的不同,出现双向迁移的情况。
细胞的趋化性和趋电性运动存在许多共同之处,例如,在活体内的许多情况下,化学因子梯度和内源性生物电场同时存在于组织中,它们都能够指导细胞发生定向迁移。此外,细胞的趋电性和趋化性在运动模式上也比较相似,都是在细胞的前端或者后端有特殊的蛋白质受体聚集,从表面上看,它们似乎也是共用细胞内的信号通路,如MAPK和PI3K信号通路[11]。这些相似性,导致很难确定趋化性和趋电性的原理或机制究竟是共享还是完全重叠。甚至一些研究者认为,细胞趋电性运动的根本原因是细胞趋化性运动,因为当细胞处于直流电场时,会引起环境中和细胞内的带电荷分子的运动,从而产生化学梯度,并最终引起细胞发生趋化运动。
然而,细胞的趋化性和趋电性之间似乎又存在着差异。在盘基网柄菌趋电性的前期研究中发现,野生型细胞(只需要经过简单饥饿处理),甚至是营养生长的细胞都具有趋电性[9],但缺乏cAMP诱导极化的细胞却没有趋化运动,可以说,细胞极化是细胞发生趋化运动的前提和基础[12]。据研究报道,gbpC和gbpD基因在盘基网柄菌细胞中调控肌球蛋白的磷酸化,并在细胞极化和趋化运动中发挥不同的作用。gbpC缺失的细胞株表现出细胞极化消失,细胞趋化性显著降低,而gbpD敲除的细胞株则表现出完全相反的现象,即细胞变得超极化,运动速度和趋化性都显著增强[12]。因此,为探究极化在细胞趋电性与趋化性中的作用差异,本研究选用了基因gbpC和gbpD为研究对象,通过对两个基因的细胞趋电性调控作用研究,同时比较细胞趋电性和趋化性的两种定向运动模式的异同,为细胞趋化性与趋电性的差异提供新的研究基础。
1 材 料
1.1 细胞和质粒
野生型盘基网柄菌细胞(AX2)、敲除gbpC的RasGEF结构域的突变株(记为gefT null或gefT-)、敲除gbpD的RasGEF结构域的突变株(记为gefU null或gefU-)、Lifeact-GFP质粒(David Knecht教授惠赠,来自Department of Molecular and Cell Biology,University of Connecticut)。gefT null和gefU null细胞株由日本NBRP惠赠。
1.2 培养基和缓冲液
HL5培养基:40 g葡萄糖,40 g示蛋白胨,20 g酵母粉,3.86 g磷酸氢二钠,1.94 g磷酸二氢钾,0.12 g硫酸链霉素,水定容到至4 L,pH 6.5;121°C灭菌30 min。
发育缓冲液(DB):先配制10×磷酸盐缓冲液:12.695 g磷酸氢二钠,6.803 g磷酸二氢钾,水定容至1 L;实验时配制新鲜的1×DB:400 ml 10×磷酸盐缓冲液、0.8 ml 1 mol/L氯化钙、4 ml 2 mol/L硫酸镁,水定容至4 L。
1.5%Agar-DB固体平板:按1.5%的比例在新鲜1×DB缓冲液中加入琼脂粉或琼脂条,121°C灭菌30 min,倒平板。
10×Steinberg’s溶液:580 mmol/L氯化钠,6.7 mmol/L氯化钾,4.4 mmol/L硝酸钙,13 mmol/L硫酸镁,46 mmol/L三羟甲基氨基甲烷,水定容至1 L,pH 7.5~7.7;使用时用水稀释10倍。
H50缓冲液:20 mmol/L HEPES(4-羟乙基哌嗪乙磺酸)、pH 7.0,50 mmol/L氯化钾,10 mmol/L氯化钠,1 mmol/L硫酸镁,5 mmol/L碳酸氢钠,1 mmol/L磷酸二氢钠,过滤除菌。
2 方 法
2.1 细胞培养
从-80°C冰箱里取出冻存的AX2细胞,室温融化后在超净工作台中将冻存管中的细胞悬液转移至装有15 ml HL5培养基的培养皿中,22°C复苏3 h或过夜。弃培养液后,重新加入15 ml HL5培养基,22°C培养。当细胞密度达到培养皿底面覆盖率的80%左右时,即可进行传代。由于盘基网柄菌细胞贴壁较松,因此,通过用移液枪吸取液体后推出的机械冲力即可将细胞悬浮。经过3次传代的细胞长到指数生长期时,即可用于实验。
gefU null突变株的培养与AX2细胞的培养方法一致。gefT null突变株为尿嘧啶缺陷型,因此在培养时,需要在HL5培养基中需加入尿嘧啶,其他培养方法与AX2细胞一致。
2.2 质粒电转化
收集指数生长期的AX2细胞,冰上静置15 min后,2 000 r/min,5 min,4℃,弃去上清液;用冰浴处理的H50缓冲液洗2次,2 000 r/min,4℃离心5 min,弃去上清。用适量的H50缓冲液将细胞重悬,调节细胞浓度至1~5×1010个/L。取100µl细胞悬液与5µl Lifeact-GFP质粒DNA混合,转入0.1 cm的电击杯中,电击2次,条件:750 V,25µF,每次电击间隔5 s。电击结束后将电击杯放置在冰浴上静置5 min使细胞恢复。将电击杯中细胞悬液转入加有HL5培养基的培养皿中,22℃培养24 h后,在培养基中加入潮霉素B(30 mg/L)进行阳性克隆子的筛选。约3 d后,未转化的细胞逐渐死亡,而转化细胞开始贴壁。7~10 d后,阳性克隆被筛选出来。
gefT null和gefU null突变株的Lifeact-GFP质粒电转化的实验操作与AX2相同。
2.3 荧光显微镜观察电场中细胞的肌动蛋白分布
待阳性克隆子筛选出来后,取指数生长期的细胞,置于DB缓冲液中饥饿处理3 h后,将细胞种植到制作好加电小室的盖玻片(40 mm×60 mm)上,贴壁后用倒置荧光显微镜观察绿色荧光蛋白的分布情况,必要时施加12 V/cm的直流电场,以20 s拍摄一帧照片的频率记录细胞的运动状态。
2.4 多细胞发育实验
取指数生长期的AX2细胞,将细胞收集到50 ml离心管中,2 000 r/min离心5 min,弃上清,用新鲜的DB缓冲液重悬后,再次离心,弃上清,最后用适量的DB重悬细胞,并用血球计数板进行细胞计数。从悬液中取约5×107个细胞,转到1.5%Agar-DB固体平板上,轻轻晃动平板,以使细胞均匀分布在平板上,22°C正置1 h后,去除残留液体,并倒置培养,期间用倒置显微镜可观察细胞的发育情况,约22~24 h,多细胞发育完成形成具有孢子结构的多细胞体。
gefT null和gefU null突变株的多细胞发育实验操作与AX2相同。
2.5 细胞趋电运动
取指数生长期的细胞(AX2、gefT null突变株、gefU null突变株),用DB缓冲液洗2次后,继续用DB缓冲液使细胞饥饿3 h。重悬细胞后,取适量细胞种到加电小室中,待贴壁后,在小室两端连接场强为12 V/cm的直流电场,用带有CCD的显微镜记录细胞在电场中的运动情况,拍照频率为间隔1 min拍1帧,共30 min。拍照结束后,将图片导入imageJ软件中进行分析。每组实验至少重复3次,每次分析的细胞个数为50个。为定量的反应细胞在电场中的运动方向,本研究选用方向性指数(directedness)和方向持续性指数(persistency)两个参数。其中,方向性指数用细胞起始位置和最终位置连线与电场矢量方向夹角的余弦值来评估,而方向持续性指数是细胞位移和轨迹的比值,比值越大,说明细胞沿某个方向的运动过程较为“笔直”,比值越小,说明细胞在沿某个方向运动过程更为“曲折”。细胞在电场中的运动速度是细胞趋电性的另一个指标,本研究选用轨迹速度(track speed)和位移速度(displacement speed)两个参数。轨迹速度指的是细胞在单位时间(min)内的平均运动距离(μm),位移速度指的是单位时间(min)内的平均位移距离(μm)。
2.6 蛋白质印迹
2.6.1蛋白质样品的收集
收集指数生长期的细胞(AX2、gefT null或gefU null),用DB缓冲液洗2次,2 000 r/min,离心5 min。彻底弃去上清液后,重悬于DB缓冲液至终浓度为2×1010个/L。取适量细胞种植于加电小室(40 mm×40 mm)中,在两端施加12 V/cm的直流电场,30 min后,收集细胞,弃上清加入裂解液,并立即放入沸水浴中保温5 min。取出稍冷却后,12 000 r/min,离心1 min,上清即为蛋白质样品。
2.6.2蛋白质电泳及印迹
SDS-PAGE电泳使用Bio-Rad公司生产的预制胶。将SDS-PAGE胶安装在电泳仪中,按15μl/孔的样品进行上样。先用150 V电压浓缩蛋白质,再用80~120 V电压分离蛋白质。
制备“三明治”的转膜系统,安装到转膜仪中,根据蛋白质条带大小调整转膜的电压和时间。转膜结束后,取出PVDF膜,用TBST清洗15 min,共3次。根据蛋白质大小将PVDF膜剪开,分别用一抗(含TBST/2%脱脂奶粉)孵育,室温1 h后,取出PVDF膜,并用TBST洗膜4次,每次2 mim。二抗孵育,室温1 h,再用TBST洗膜4次,每次2 mim。按比例现配显影液,将PVDF膜浸泡于显影液中1 min,用成像系统进行显影。
3 结 果
3.1 gefT null和gefU null突变株的多细胞发育
盘基网柄菌具有特殊的生命周期,通常情况下,以游离的单细胞独立生活,当环境中营养物质匮乏或条件不适宜时,一些“中心细胞”首先向环境中分泌cAMP引起周围细胞发生极化,并朝高浓度的cAMP聚集,最终完成从单细胞的生命周期向多细胞的生命周期的转变。
据研究报道,尽管gbpC突变株和gbpD突变株表现出完全相反的趋化性,但均能在DB琼脂上完成与野生型细胞一致的多细胞发育过程,而且在发育的时间上,也与野生型细胞发育没有差异[12]。其原因可能是细胞在不同材质的表面运动模式不一样。另外,在细胞发育过程中,由于细胞的密度较大,因此发育过程中对细胞趋化性运动的需求相对较低,细胞能够聚集并完成发育,即便细胞具有较强的趋化运动,但是细胞需要在基因层面对多细胞的发育进行调控,从而发育时间也与野生型的细胞无明显差异。本研究结果也表明(图1),仅缺失RasGEF结构域的gefT null突变株和gefU null突变株也都能够在DB琼脂上完成与野生型细胞一致的多细胞发育过程,而且在发育的时间上,也与野生型细胞发育没有差异。说明RasGEF结构域是gbpC和gbpD基因中的关键结构域,调控着两个基因的重要功能。
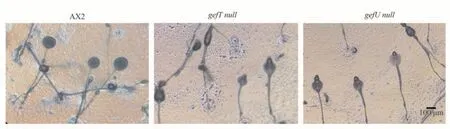
Fig.1 Developmental phenotypes of wild-type and rasGEF null cells
3.2 gefT null和gefU null突变株的细胞形态与运动速度
细胞极化的调控在细胞的趋化性运动中发挥重要作用。在cAMP浓度梯度环境中,盘基网柄菌形成具有明显前端和后端的极化细胞,这个过程也是细胞发生朝向或远离高浓度化学因子趋化性运动的前提和基础。研究报道,gbpC缺失突变株由于不能形成明显的前端和后端,且侧生伪足比较多,因此,细胞运动速度较慢。而gbpD缺失突变株却与之完全相反,细胞发生超极化,细胞的运动速度较快(图2a)。本研究的细胞形态观察发现:gefT null突变株细胞形态为椭圆形,相同的时间内移动的距离较短;gefU null突变株细胞形态呈现细长形状,运动时有明显的前端和后端,且相同时间内移动的距离较长(图2b)。
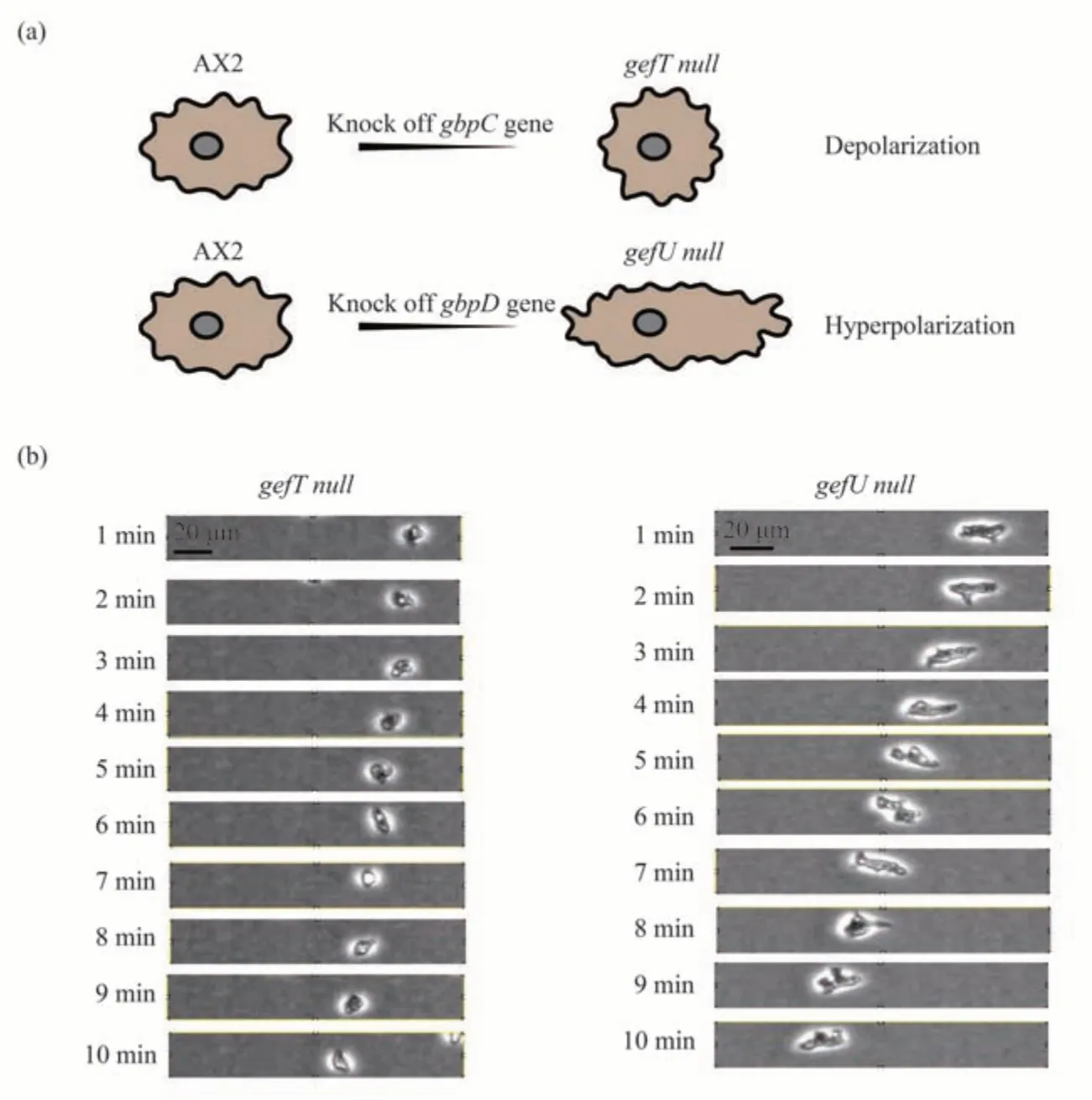
Fig.2 Cell morphology of gefT null and gefU null mutant strains
3.3 gefT null和gefU null突变株对直流电场的响应
细胞随机运动实验表明,gefT null突变株细胞也形成较多的侧生伪足,运动速度较慢,约为(3.88±0.09)μm/min,与野生型细胞的运动速度较为接近,即(3.80±0.07)μm/min。而gefU null突变株细胞发生明显的极化,运动速度较快,约为(7.20±0.17)μm/min(图3a)。细胞在微小直流电场中表现出朝向阳极或阴极的定向迁移现象被称为细胞的趋电性。野生型盘基网柄菌细胞AX2、gefT null突变株和gefU null突变株在强度为12V/cm的直流电场中,都发生朝向阴极的定向迁移(图3b,c)。数据分析结果显示(图4),野生型细胞在直流电场中的方向性指数为0.86±0.01,方向持续性指数为0.48±0.01。gefT null突变株和gefU null突变株在相同强度的直流电场中的方向性指数分别为0.81±0.01和0.60±0.01,方向持续性指数分别为0.41±0.01和0.36±0.01。统计结果表明,gefT null突变株的趋电性与野生型之间没有差异,但gefU null突变株的趋电性与野生型和gefT null突变株都存在显著差异。
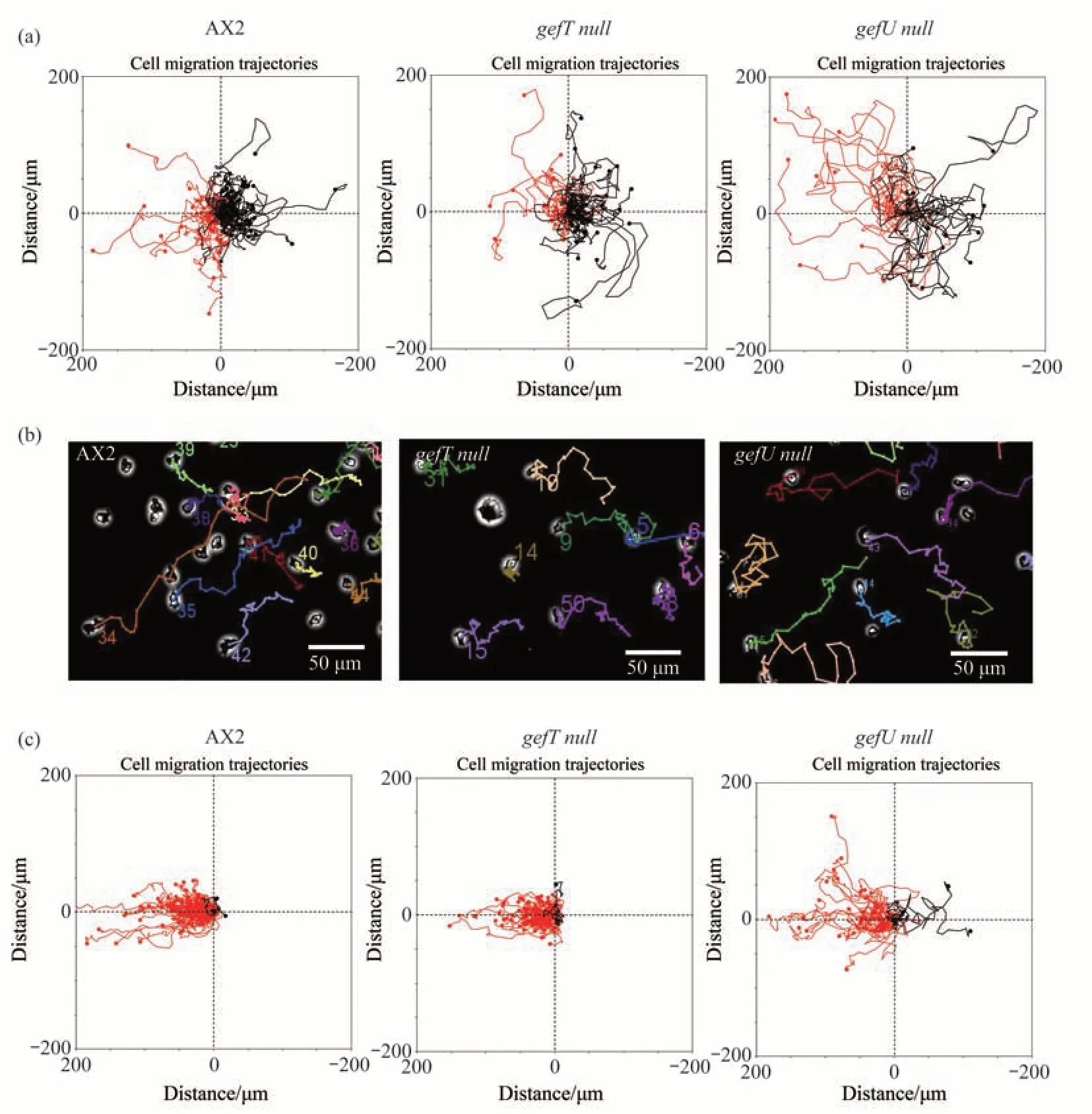
Fig.3 Trajectory of gefT null and gefU null mutants
AX2、gefT null突变株和gefU null突变株在强度为12 V/cm直流电场中的轨迹速度和位移速度分析显示(图4),野生型细胞的轨迹速度为(5.02±0.03)μm/min,位移速度为(2.45±0.02)μm/min。gefT null突变株和gefU null突变株在相同强度直流电场中的轨迹速度分别为(3.23±0.04)μm/min和(5.57±0.13)μm/min,轨 迹 速 度 分 别 为(1.22±0.03)μm/min和(2.22±0.09)μm/min。统计结果表明,gefU null突变株在电场中的运动速度与野生型相似,两者之间无差异,但gefT null突变株在电场中的运动速度与野生型和gefU null突变株之间存在显著性差异。与随机运动实验结果相比,野生型细胞的运动速度在电场作用下有增强的趋势,但gefT null突变株和gefU null突变株的运动速度都有降低的趋势,尤其是gefU null突变株的运动速度降低的趋势更明显。

Fig.4 Direction of gefT null and gefU null mutants in a DC EF at 12 V/cm
3.4 直流电场中的细胞骨架变化与速度调控
肌动蛋白和肌球蛋白是细胞运动过程中调节细胞骨架重排的重要成分。肌动蛋白通过聚集负责形成新的伪足,而肌球蛋白是维持细胞极化和伪足收缩的重要调节因子。为了探讨肌动蛋白和肌球蛋白在细胞趋电运动中的作用,本研究用lifeact-GFP标记肌动蛋白,观察活细胞中在直流电场中肌动蛋白的分布与变化,并用肌球蛋白调节轻链(regulatory light chain,RLC)磷酸化抗体检测电场对细胞肌球蛋白的作用及变化。研究结果发现,受直流电场刺激后,野生型细胞和突变株细胞的F-actin分布并没有呈现明显的改变,仍然分布在细胞伪足着生处,且这种分布在整个施加电场的过程中保持一致(图5)。此外,由于gefT null细胞株未发生明显极化,F-actin-GFP主要分布在侧生伪足上。这些现象与cAMP诱导的F-actin聚集存在较大差异。文献报道,利用鬼笔环肽标记细胞骨架实验中,cAMP诱导野生型细胞的F-actin聚集存在双相波的变化,F-actin聚集的峰值发生在cAMP刺激后的5 s左右,而后瞬时降低,一直到50 s左右下降到最低,之后恢复到原来的水平,这也是趋化性和趋电性的重要差别之一。
作为维持细胞极化和收缩重要调节因子的肌球蛋白,也是细胞趋化运动的必要因素,受到RLC和重链(heavy chain,MHC)的磷酸化调控。其中,RLC的磷酸化增加肌球蛋白ATP酶活性,而MHC磷酸化调控肌球蛋白丝的形成。直流电场作用下的细胞运动,仍需要细胞收缩。通过蛋白质印迹研究电场作用下的RLC磷酸化变化情况,结果显示(图6),野生型细胞中,RLC的磷酸化受电场的指导,并且以一种时间依赖的方式发生磷酸化,这也有可能就是电场作用下细胞运动速度变快的原因之一。而两个突变株的RLC磷酸化受电场指导情况并不一致,gefT null突变株受电场刺激1 min时有降低的趋势,但随电信号刺激时间的延长,RLC磷酸化呈现上升趋势,这可能就是维持细胞在电场中平均速度与随机运动接近的原因。而在gefU null细胞中,电场刺激后,RLC的磷酸化反而以时间依赖的方式被抑制,同样,推测这可能就是导致电场刺激下突变株的运动速度与随机运动相比较反而降低的原因之一。
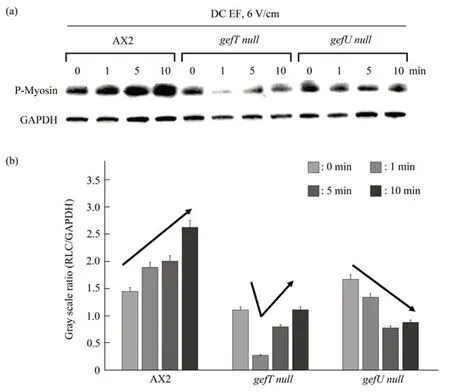
Fig.6 DC EF-induced phosphorylation of myosin regulatory light chain(RLC)
4 讨 论
盘基网柄菌虽然是一种低等的真核生物,但却拥有很多与高等真核细胞同源性很高的基因及保守的分子机制。人们常用它来研究阿米巴式的细胞运动。目前所了解的阿米巴式真核细胞迁移,大多都是通过对盘基网柄菌的研究揭示的。例如,肌动蛋白的黏合蛋白(冠蛋白)的鉴定[13]、细胞骨架成分参与细胞迁移的功能冗余[14]、肌球蛋白II在细胞迁移中的作用[15]、GPCRs趋化性受体的鉴定[16]、磷酸肌醇和G蛋白信号事件对迁移细胞前沿的限制作用[17],包括细胞迁移中Ras GTP酶[18]、肌动蛋白波的发现[19]等。
盘基网柄菌也是用来研究细胞趋化性和趋电性运动机制的理想模型。前期的研究发现,细胞的趋电性与趋化性在模式上比较相似,都是在细胞前端或者后端有特殊的蛋白质受体聚集。另一方面,趋化性和趋电性的信号转导通路并不是完全重叠的[20]。而本研究结果表明,含有RasGEF结构域的gbpC和gbpD在盘基网柄菌的趋化性和趋电性中发挥不同作用。在趋化运动中,gbpC通过调控细胞极化来促进细胞的趋化运动,当gbpC基因缺失后,细胞的极化消失,趋化运动被抑制;gbpD诱导附着基质的伪足形成,从而负调控细胞运动速度和细胞极化[12]。在趋电运动中,敲除gbpCRasGEF结构域的突变株(gefT null)极化消失,但细胞的趋电性却保持不变。而敲除gbpDRasGEF结构域的突变株(gefU null)发生超极化,但细胞的趋电性显著降低。肌动蛋白在化学刺激和直流电场刺激后的变化也有差异,受化学信号刺激后,肌动蛋白发生明显的跨膜过程,但受直流电场刺激则并未发生明显的跨膜过程,而是一直保持原来的荧光水平。受两种不同信号刺激的肌球蛋白轻链磷酸化方式也存在差异,文献报道称受cAMP刺激的盘基网柄菌野生型细胞的肌球蛋白RLC发生瞬时磷酸化,而本研究发现受电场刺激的RLC以时间依赖的方式发生磷酸化,且电场刺激下两个突变株细胞的RLC磷酸化方式也存在差异。
5 结 论
本项研究结果表明,细胞的趋电性和趋化性之间存在许多差异。首先,趋化性对细胞极化的依赖程度高于趋电性。其次,肌动蛋白和肌球蛋白在化学信号和电信号刺激下的作用方式也不同。除了本研究发现的新差异,一些未知的信号通路也可能分别参与了细胞的趋化性和趋电性,包括信号的感应、迁移方向的确定、迁移方向的维持,以及细胞黏附的控制和细胞速度的调控,这些都需要研究者们做进一步的探索。
