千频交流电刺激在外周神经传导阻断中的作用*
2022-08-20伊国胜白瑞峰魏熙乐
伊国胜 赵 强 白瑞峰 魏熙乐 王 江
(天津大学电气自动化与信息工程学院,天津 300072)
外周神经系统是中枢神经系统与机体器官及外界环境交互的重要接口,负责联系各种感觉输入和运动输出。外周神经的异常病理活动与许多神经机能障碍有关,而阻断外周病理活动的传导是缓解相应疾病症状的一种有效疗法。例如,阻断感觉神经异常活动的传导可以用来缓解疼痛症状[1],阻断运动神经异常活动的传导可以用来缓解运动障碍疾病中的痉挛症状[2-3],而阻断交感神经或副交感神经纤维传导可以调节与自主神经回路异常活动有关的心脏病、炎症或代谢疾病的病程发展[4-6]。目前,常用的神经传导阻断方法包括化学阻断[7-8]和药物阻断[9-10],但是这些方法不能精确控制传导阻断的发生时刻或位置[6]。此外,它们通常还会产生一系列副作用,如全身乏力、认知功能受损或中枢神经活动抑制等,严重时可能造成不可逆的神经损伤[7-10]。
目前,另一种可供选择的神经阻断方法是千频交 流 电(kilohertz frequency alternating current,KHFAC)刺激[6,11-12],它是将千频赫兹的电流或电压以胞外刺激方式施加到靶向神经纤维。KHFAC产生的神经传导阻断又被称KHFAC阻断,它具有快速性、可控性、可逆性、局部作用和副作用小的特点。但是,该技术的一个缺陷是,KHFAC施加后会在阻断电极附近的局部神经纤维上激活一簇高频放电,这种现象又被称为初始响应(onset response),它可能造成强烈的肌肉痉挛或疼痛感。另一个缺陷是撤去阻断电流后靶向神经仍然处于传导阻断状态,它们需要经历一段时间才能恢复正常的神经传导能力,这一现象被称为KHFAC的后续效应(carry-over effect)。即使存在初始响应和后续效应的缺陷,相关临床研究证实,采用KHFAC的脊髓电刺激可以有效治疗慢性疼痛[13]和截肢后疼痛[14]等症状,而采用KHFAC的腹部迷走神经电刺激可以有效调节饱腹感、控制食欲及减轻体重[15-16]。这表明,KHFAC技术在改善和治疗由外周神经异常活动导致的疾病症状方面具有临床应用潜力。
近年来,各国学者采用电生理实验、神经计算模型或二者相结合方法对KHFAC技术进行了相关研究。重点关注了KHFAC在不同物种的外周神经上引发的传导阻断效应,主要围绕以下4个方面展开:a.刺激波形参数;b.阻断电极特性和神经纤维特性等因素与KHFAC阻断之间关系;c.初始放电特性及抑制方法,后续效应特性;d.KHFAC阻断神经传导的生物物理机制以及其潜在的临床应用。鉴于KHFAC技术的重要应用前景,有必要对目前KHFAC在神经传导阻断方面的预临床研究进展进行综述。本文首先介绍了KHFAC阻断神经传导的研究方法,然后详细综述了该技术在神经传导阻断方面的研究进展,同时归纳总结了KHFAC作用的生物物理机制,最后对该领域未来的相关研究进行了展望。
1 电生理实验研究方法
目前,研究KHFAC神经阻断效应的电生理实验包括在体动物实验、离体动物实验和临床实验3种,相关研究中前两种动物实验居多而临床实验较少。这些实验研究的基本思路均是检测KHFAC在一个完整神经干上诱发的局部传导阻断能力,关注重点在于传导阻断与千频刺激波形、幅值及频率的关系。在体实验的对象包括大鼠、猫、蛙、山羊、猕猴和猪等。对于大鼠,被阻断的神经包括坐骨神经[17-21]、阴部神经[22]、脊髓背角广动力范围神经元[23]、迷走神经[24-25]和胫骨神经[26-27];对于猫,被阻断的神经包括坐骨神经[21,28]和阴部神经[29-31];对于蛙,被阻断的是坐骨神经[32-33];对于山羊,被阻断的是脊髓背角广动力范围神经元[23];对于猕猴,被阻断的是正中神经[34];对于猪,被阻断的是颈动脉窦神经[35]。离体实验的对象包括蛙、大鼠和海兔。对于蛙,被阻断的是坐骨神经[36];对于海兔,被阻断的是无髓鞘轴突[37-38];对于大鼠,被阻断的是迷走神经[39]。在临床实验中,KHFAC能够阻断坐骨神经[14]、胫骨神经[14]、迷走神经[40]和桡神经[41]。下面将从实验方案、波形和参数、记录信号及量化指标4个方面对这些电生理实验的研究方法进行梳理介绍。
1.1 实验方案
KHFAC的神经阻断实验通常采用多个电极对外周神经进行刺激或记录,典型实验设置如图1a所示[11-12]。处于左侧近端的测试电极1是一个刺激电极,其输入是一系列低频阈上脉冲电流,用以产生沿着神经传导的动作电位序列。与电极1相邻的电极是一个阻断电极,其输入是千频赫兹交流电信号,用于阻断动作电位在轴突上的传导。值得指出的是,常用的阻断电极是卡肤电极(cuff electrode),它是以环绕方式贴附在神经表面,常包括单极性、双极性和三极性3种[30]。一些实验的阻断电极也采用神经束内微电极[28,42]或玻璃吸盘式电极[36]。事实上,电极类型对神经阻断的影响很大,这部分将在下面3.4节进行论述。处于右侧远端的测试电极2通常设置在阻断区域和肌肉神经接点之间的位置,它也是一个刺激电极,输入的是一系列低频阈上脉冲电流。设置电极2的目的是为了在在体情况下区分神经传导阻断究竟是由KHFAC导致还是由神经递质耗竭导致[11-12,18,43]。由KHFAC产生的传导阻断只发生在阻断电极附近,故其不影响肌肉神经接点处的神经传导。于是,由电极1和电极2激活的动作电位序列理论上能够产生相同幅值的肌肉抽搐反应。如果由电极2激活的放电序列不能产生肌力响应,则说明最终的神经传导阻断是由肌肉神经接点处的递质耗竭导致。
1.2 波形和参数
电生理实验采用的千频交流波形包括正弦波、电荷平衡(charge-balance)的双极性方波以及单极性方波(图1b)。正弦波是一种对称的双极性波形,其正半周期和负半周期的面积相等而极性相反。由于在一定时间段内流经阻断电极的正电荷与负电荷相等(即净电荷为零),因此正弦波是一种电荷平衡的波形。对于电荷平衡的双极性方波来说,它分为对称和非对称两种。对称双极性方波的两个脉冲极性相反、幅值相同,而占空比可在0~1之间随意调节。非对称双极性方波的两个脉冲极性相反而幅值不相等,但是正相脉冲和反相脉冲的面积相等,从而保证电荷平衡。与上面两种波形不同的是,单极性方波是一种电荷非平衡的刺激波形。应用这种电荷非平衡的千频波形时要十分谨慎,这是因为它们会在阻断电极和神经组织接触界面引发非可逆的法拉第反应[44],进而导致电极出现溶解、点蚀和腐蚀等损伤[6,45]。短时间的非可逆反应会影响神经传导能力,而长时间的非可逆反应可能造成神经损伤[46-48]。因为电荷平衡的千频刺激诱发的上述不利影响严重低于单极性方波,所以实际电生理实验中常用的是正弦波和电荷平衡双极性方波。刻画上述波形的主要参数包括频率和幅值。电生理实验中,用于产生神经传导阻断的KHFAC频率范围大于1 kHz,最高可达70 kHz[11-12]。特别地,实际应用中千频信号可以通过电压源或电流源产生,因此KHFAC幅值的单位可以为伏特(V)或毫安(mA),而其通常采用波形峰值或峰峰值进行量化。

Fig.1 Method summary of KHFAC experimental studies图1 KHFAC的实验研究方法总结
1.3 记录信号
为了检测KHFAC的神经传导阻断效应,在体和离体实验记录的生理信号不同。在体实验中,常用的记录信号包括由靶向神经支配的肌肉力(muscle force)[17-20,24,26-28,30,32-34,42]、复合动作电位(compound action potential)[25,41]、单 纤 维 响 应(single fiber response)[23,43]、尿 道 括 约 肌 压 力(urethral sphincter pressure)[22,29,31]和肌电图活动(electromyographic activity)[49]等。肌力是一种最常用的记录量,它能有效反应靶向神经内运动纤维的阻断状态,主要用于运动阻断实验,相应记录位置如图1a所示。图1c给出了大鼠胫骨神经在10 kHz双极性对称方波作用下的肌力响应,数据来自于笔者之前与美国杜克大学Warren M.Grill教授合作进行的一次电生理实验记录。可以发现,在施加KHFAC前神经纤维上每个动作电位都可以正常传导至肌肉处进而产生一次肌肉收缩,对应一个肌力脉冲。当KHFAC完全阻断神经传导后,肌力脉冲响应消失。复合动作电位主要用于感觉阻断实验,特别是人体实验。它只能在KHFAC施加前后进行记录,不能在刺激施加同时进行在线记录。这是由于千频电信号施加位置与复合动作电位记录位置很近,前者容易对后者产生明显干扰[23]。单纤维记录能够准确反映单个运动纤维或感觉纤维的阻断状态。但是这种记录方式的实验消耗较大,并且只能检测神经干中一小部分纤维的响应。离体实验中,常用的记录信号是神经纤维产生的动作电位[36-39],相应记录位置如图1a所示。
1.4 量化指标
阻断阈值(block threshold)是量化KHFAC诱发神经传导阻断效应的一个常用指标量,它是指在一个完整外周神经上产生完全传导阻断的最小KHFAC幅值,最初由Bhadra和Kilgore提出[18]。电生理实验中确定阻断阈值的方法如下[12,18]:首先给靶向神经施加一个幅值高于阻断阈值的KHFAC,用以产生完全的传导阻断,然后逐渐减小千频信号幅值,直至动作电位开始恢复传导并且产生小幅度的肌肉收缩现象。在这个过程中,确定能够维持完全传导阻断的最低KHFAC幅值,并将其定义为阻断阈值。最小阻断频率(minimal blocking frequency)是量化KHFAC阻断效应的另一个指标[50],它是指在给定千频刺激幅值情况下能够完全阻断神经传导的最小KHFAC频率,相应计算方法与阻断阈值类似。阻断阈值和最小阻断频率可以用来评估和理解不同实验结果之间的差异性。除了阻断阈值和最小阻断频率外,还有一系列量化靶向神经在KHFAC施加时产生初始响应的指标量,包括肌力峰值、初始响应持续时间和初始响应时序历程内肌力对时间的积分等[18]。此外,Bhadra和Kilgore[18]还提出计算由近端电极1产生的肌力峰值与由远端电极2产生的肌力峰值之比。这是一种量化靶向神经传导能力的指标量,可以用来检测KHFAC产生的长时程阻断效应[12]。在正常传导或神经递质耗竭情况下,上述肌力峰值的比值为1。但是,当KHFAC诱发局部传导阻断进而损坏靶向神经的传输能力时,这个比值将明显降低。
2 计算模型研究方法
2.1 轴突模型
目前,KHFAC计算模型研究的关注重点是千频信号对单个轴突中动作电位传导的阻断效应,研究方法如图2,3所示。相关研究采用的轴突模型包 括Schwarz-Eikhof(SE)模 型[51-52]、Chiu-Ritchie-Rogart-Stagg-Sweeney(CRRSS)模型[51,53]、Schwarz-Reid-Bostock(SRB)模 型[51,54-55]、Frankenhaeuser-Huxley(FH)模型[51,53,56-59]、Hodgkin-Huxley(HH)模型[60-62]和 McIntyre-Richardson-Grill (MRG)模型[17,19,27,63-65]。
SE轴突模型是Schwarz和Eikhof[66]基于大鼠神经纤维的电压钳位数据构建的,可以用来模拟带有髓鞘轴突的郎飞结(node of Ranvier)的跨膜电压动态。SE模型可以描述一些轴突几何形态,包括郎飞结长度L,两个郎飞结间距离Δx和轴突直径d(图2a)。SE模型郎飞结的细胞膜上包含Na+电流INa、K+电流IK和漏电流IL,相邻郎飞结由轴浆电阻Ra连接(图2b)。
CRRSS轴突模型是Chiu等[67]基于兔子神经纤维的电压钳位数据构建的,模拟的对象是带有髓鞘轴突郎飞结的跨膜电压动态。CRRSS模型描述的轴突几何形态与SE模型相同,但是其郎飞结的细胞膜上只含有Na+电流INa和漏电流IL,不含有K+电流IK,相邻郎飞结由轴浆电阻Ra连接(图2c)。
SRB轴突模型是Schwarz等[68]基于人类外周神经的电压钳位数据构建的,也是用来模拟带有髓鞘轴突郎飞结的跨膜电压动态。SRB模型描述的轴突几何形态与SE模型相同,但是其郎飞结的细胞膜上包含Na+电流INa、快速K+电流IKf、慢速K+电流IKS和漏电流IL,相邻郎飞结由轴浆电阻Ra连接(图2d)。
FH轴突模型是Frankenhaeuser和Huxley[69]基于非洲爪蟾神经纤维的电压钳位数据构建的,可以用来模拟带有髓鞘轴突郎飞结的跨膜电压动态。FH模型描述的轴突几何形态也与SE模型相同,而其郎飞结的细胞膜上包含Na+电流INa、K+电流IK、非特异性电流Ip和漏电流IL,相邻郎飞结由轴浆电阻Ra连接(图2e)。
HH轴突模型最初是Hodgkin和Huxley[70]基于乌贼巨轴突的电压钳位数据构建的,它模拟的是无髓鞘轴突的跨膜电压动态。HH模型将轴突分割为长度Δx、直径d的一系列圆筒,它不含有郎飞结长度L这个参数。在传统HH模型中,每个轴突圆筒的细胞膜上含有Na+电流INa、K+电流IK和漏电流IL,相邻圆筒由轴浆电阻Ra连接(图2b)。需要注意的是,虽然SE模型和HH模型中离子电流种类相同,但是离子电流的动态特性却有很大区别。近期,一些学者在传统HH模型中引入了Na+泵电流INa-p和K+泵电流IK-p,进而构建了一个能够描述细胞膜内外Na+和K+浓度动态的轴突模型[71-72](图2f)。这种含有离子泵的HH轴突模型不仅能够有效模拟短时刺激下动作电位的产生、传导和阻断现象以及长时刺激下轴突的刺激后阻断现象,还能复现动物实验观测的动作电位衰减和变宽等活动依赖效应。
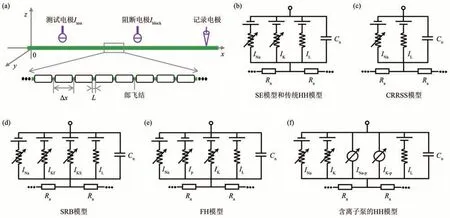
Fig.2 Method summary I of KHFAC computational modeling studies图2 KHFAC的计算模型研究方法总结(I)
MRG模型是McIntyre等[73]构建的哺乳动物外周神经纤维模型,它能够描述轴突的精确几何形态和生物物理特性。MRG模型具有双层电缆结构,包含了郎飞结、髓鞘连接段、郎飞结旁主段和两个郎飞结的结间段等部分(图3a)。郎飞结的细胞膜含有快速Na+电流INaf、持续Na+电流INap、慢速K+电流IKS和漏电流IL。McIntyre等[73]根据人、猫和兔子的轴突电生理实验数据确定了上述离子电流的动力学参数。两个郎飞结之间的结构不含主动离子电流,由线性电导Gm和Gi以及细胞膜电容Cm和Ci组成。郎飞结与非郎飞结通过轴浆电导Ga和轴突周围电导Gp连接(图3b)。
值得指出的是,SE、CRRSS、SRB、FH和MRG模型中各离子电流都是采用Hodgkin和Huxley所构建的电流方程进行描述。这类电流方程采用一些相互独立的门控变量对离子通道建模(如激活门变量和失活门变量),能够复现生理实验记录的大部分电流行为,同时参数易于辨识。但是,这类电流方程不能复现离子通道动力学状态之间的耦合特性和转迁规律。另一种离子通道模型是Markov模型,它采用一些状态和状态之间的转迁概率对离子通道建模,这类模型能够复现通道状态之间的耦合特性和转迁规律。本课题组前期将MRG模型中部分郎飞结的快速Na+电流INaf和持续Na+电流INap分别替换为Nav1.1通道和Nav1.6通道的Markov模型,进而构建了一个外周有髓鞘轴突的混合模型[74]。两类Na+通道的Markov模型是由Balbi等[75]提出,它们均含有6个状态,分别为关闭状态C1和C2、开通状态O1和O2以及失活状态I1和I2。基于上述混合MRG模型,进行消除初始响应的KHFAC波形优化研究。
2.2 仿真方案
KHFAC的计算模型仿真方案与电生理实验类似(图2a,3a)。在轴突模型一端,采用一个测试电极施加阈上刺激脉冲Itest,用以产生沿着轴突传导的动作电位。在轴突模型中间,通过阻断电极施加千频电流Iblock,用以阻断动作电位传导。在轴突模型另一侧,采用一个电极记录轴突响应,用以观察KHFAC产生的神经阻断效应。图3c,d是基于上述刺激方案得到10 kHz对称双极性方波电流作用下原始MRG模型各郎飞结的膜电压响应,相应数据是在NEURON环境下通过数值仿真所得,可见测试电流Itest和阻断电流Iblock的时序(图3d中图和下图)。在0~100 ms时,未施加千频电流Iblock,阈上刺激Itest在轴突模型最左侧郎飞结产生的50 Hz周期放电能够可靠地传导至轴突最右侧的郎飞结。在t=100 ms时,开始对MRG模型施加幅值为1 mA的10 kHz方波电流Iblock。此时,左侧放电序列仍能传导至阻断电极附近,但是之后被Iblock阻断,不能传递至轴突模型的另一端。特别地,MRG模型在施加Iblock后会随之产生一簇持续时间为12 ms左右的高频初始放电,然后进入完全传导阻断状态(图3d上图)。这些高频放电便是阻断电流Iblock产生的初始响应。
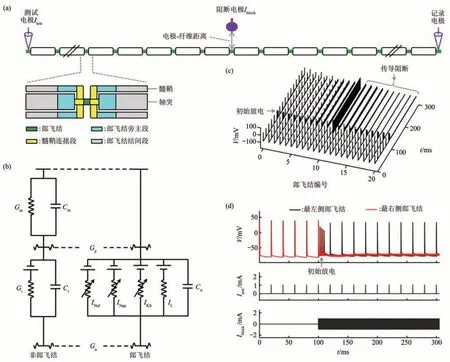
Fig.3 Method summary II of KHFAC computational modeling studies图3 KHFAC的计算模型研究方法总结(II)
值得注意的是,阻断电极输入的千频电流Iblock通常是以胞外刺激方式施加到轴突模型上。但是,测试电极却有两种刺激方式可以选择。对于FH、SRB、SE、HH和CRRSS模型,测试电极输入的电流Itest通常是以胞外刺激方式施加到轴突上[51-62](图2a)。对于MRG模型,测试电流Itest通常选择胞内刺激方式[17,19,27,63-65,74](图3a)。在对刺激建模方面,通常假设轴突模型处于一个无限均匀、各向同性的介质中,介质电导率为σ。胞外刺激是通过改变轴突胞外电势进而影响多个相关郎飞结的膜电压活动,而胞内刺激只是改变刺激注入处的郎飞结活动。因此,Itest(t)的两种施加方式导致最终胞外电势的建模方法不同。当Itest是胞内刺激时,MRG模型第n个郎飞结的胞外电势Ve,n(t)只与阻断电流Iblock(t) 有关,计算方式如下[17,19,27,63-65,74]:
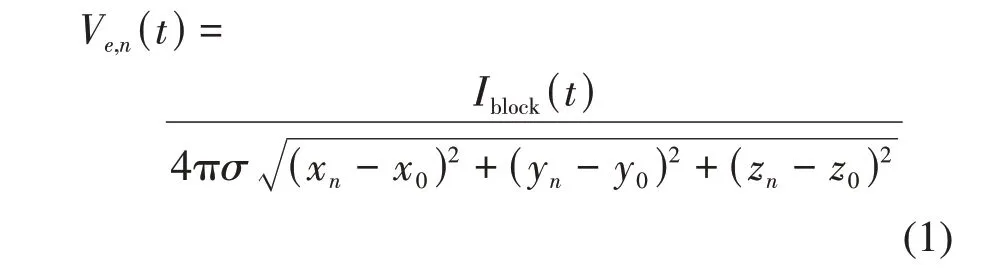
其中,(xn,yn,zn)表示第n个郎飞结的胞外位置,(x0,y0,z0)表示阻断电极的位置。当Itest(t)是胞外刺激时,轴突模型第n个郎飞结的胞外电势Ve,n(t)与Itest(t)和Iblock(t)均有关,计算方式如下[51-62]:
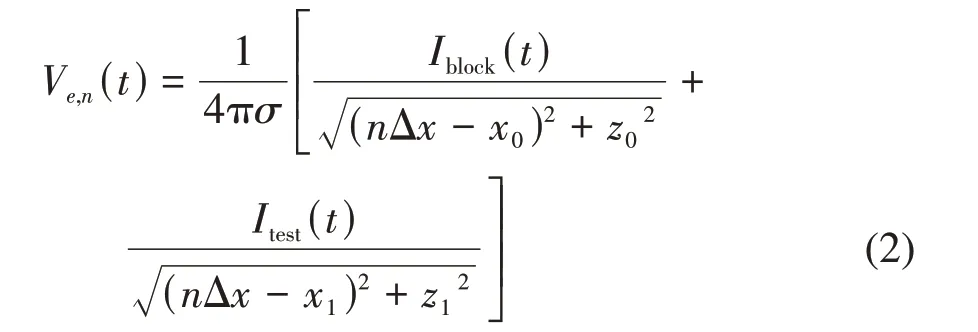
其中,(x0,z0)表示阻断电极的位置,(x1,z1)表示测试电极的位置,Δx为两个郎飞结间的距离。值得指出的是,按照图2a中的坐标定义方式,轴突和电极所处位置在y轴的坐标均为0,故公式(2)忽略了y轴的坐标值。此外,对于无髓鞘HH轴突模型来说,Ve,n(t)表示每个圆筒的胞外电势,而Δx为圆筒长度。
3 研究进展
电生理实验和计算模型研究详细刻画了KHFAC作用下神经纤维的响应特性。结果显示,KHFAC能够在刺激电极附近产生局部的传导阻断,但同时还在靶向神经上诱发初始响应及后续效应。特别地,KHFAC产生的神经传导阻断受刺激波形和参数、电极设置和位置以及神经纤维类型和直径影响。还有一些电生理实验关注了KHFAC在临床上的应用潜力。下面将对上述研究发现进行逐一梳理和介绍。
3.1 初始响应及抑制方法
对神经纤维施加KHFAC后,靶向神经在被完全阻断前会产生短暂的同步放电活动。这种由阻断电流激活的短暂高频放电被称为初始响应。在基于单纤维记录[43]、肌力记录[18,42,61,76]及尿道括约肌压力记录[2,9,32]的电生理实验和计算模型仿真[32,51,61,65]中均发现了这种初始放电。图1c显示KHFAC施加后一个典型的初始响应波形。通常地,可将初始响应分为快速上升和慢速下降两个阶段。第一阶段的快速上升响应是KHFAC刚一施加时由其激活的高频放电(约为1~6个)导致,相应放电频率有时可达到生理允许范围的最大值[20,65]。由这些高频初始放电产生的肌力幅值比单个轴突放电产生的肌力幅值要高2~3倍,所以第一阶段的初始响应常会导致肌肉出现大幅度抽搐。第二阶段的慢速下降响应是在第一阶段之后发生,是由神经在KHFAC刺激下产生的低强度重复放电导致[42,64-65],这个阶段的持续时间通常大于第一阶段。随着神经纤维不断适应KHFAC刺激,这些重复放电逐渐消失,最终靶向神经的传导能力被完全阻断。施加KHFAC后,第一阶段初始响应总是随之产生,但是在某些情况下第二阶段初始响应却可能消失。
初始响应的持续时间与KHFAC施加后靶向神经开始进入完全传导阻断状态的具体时刻直接相关。在计算模型仿真中,由于可以准确记录放电序列沿着轴突模型传导的时序信息,所以可以较为容易地确定KHFAC实现完全传导阻断所用的时间。对于SE、SRB、FH、HH和CRRSS轴突模型,仿真结果显示KHFAC可在几毫秒内便完全阻断它们的动作电位传导[51-62]。但是对于MRG轴突模型,KHFAC则需要10~30 ms才能实现完全传导阻断[65]。在电生理实验中,由于很难同时记录KHFAC刺激下神经纤维各个郎飞结的放电序列,所以无法像计算模型仿真那样直接确定KHFAC实现完全传导阻断所需的时间。为了解决这个问题,Foldes等[77]提出了一种周期计数方法,用以量化电生理实验中KHFAC实现完全传导阻断所需要的时间。基于这种方法,他们发现KHFAC可以在7.5~14 ms内完全阻断大鼠坐骨神经传导,而这一实验结果与MRG模型的仿真结果[65]一致。
初始响应是KHFAC技术向临床转化的一个重要阻碍,这是因为它可能激活肌肉、反射回路以及特定通路的传入或传出信号,进而导致机体生理发生不可预知的变化[6]。特别地,这种不期望的初始放电很容易造成强烈的肌肉痉挛或疼痛感[6,12],因此一些研究提出了不同的KHFAC波形用以抑制或消除初始响应。对于HH轴突模型,采用幅值从0 mA线性增加至高于阻断阈值水平的KHFAC波形可以消除模型产生的初始响应[60]。但是,这种幅值从0 mA线性增加的KHFAC波形不能消除MRG轴突模型和大鼠坐骨神经产生的初始响应[19]。近期实验研究发现,如果将KHFAC幅值从一个非0值线性增加至阻断阈值的125%,可以成功消除大鼠坐骨神经产生的初始响应[78]。一些在体实验还发现,增加KHFAC幅值和频率可以降低神经纤维产生的初始响应[21,29]。基于这一特性,Gerges等[20]提出了一种由高幅值和高频率向低幅值和低频率过渡的KHFAC波形,并采用生理实验证明了这种波形可以降低或消除大鼠坐骨神经产生的初始放电。还有研究发现,引入直流电流可以抑制初始放电,但是相应直流电流会损伤神经进而造成长时间的传导失败[79]。降低直流引发不可逆损伤的一种方法是将直流电流换为电荷平衡的形式,即施加一段时间单极性电流后继续施加极性相反的电流用以进行电荷平衡。电生理实验显示,采用KHFAC、电荷平衡直流电流和具有高电容材料的阻断电极可以明显降低甚至消除大鼠坐骨神经产生的初始放电,并且不会对神经传导能力产生不可逆损伤[47]。近期一项研究发现,在KHFAC前施加一个电荷平衡直流电流也可以明显降低MRG模型和大鼠坐骨神经产生的初始放电[80]。除了引入直流电流外,改变电极几何特性也可以抑制初始响应[21]。需要指出的是,上述这些KHFAC波形在阻断神经传导方面还存在一些缺陷,例如不能完全消除初始响应或者在临床植入和应用中存在很大难度与挑战。为了克服这些问题,本课题组结合MRG轴突模型、Na+通道Markov模型和粒子群优化算法提出了一种工程优化方法,用以产生既能阻断神经传导又不激活初始响应的KHFAC波形[74]。相关仿真结果显示,驱使郎飞结中的压控Na+通道由关闭状态不经过开通而直接转移至失活状态,可以完全消除KHFAC在混合MRG轴突模型上激活的初始放电。基于这种方法所得的KHFAC波形不需要引入直流电流,易于植入和实现。
3.2 后续效应
KHFAC阻断会引发一定程度的后续效应,即撤去KHFAC后靶向神经继续处于传导阻断状态,需要一段时间才能恢复正常传导能力。一些生理实验发现,KHFAC的后续效应在阻断信号撤去后几秒内便消失。例如,当阻断信号是20 s的18 kHz电流时,由大鼠坐骨神经支配的肌肉抽搐力在阻断电流撤去后的1 s内便恢复至阻断前高度[18];当阻断信号是40 s的3 kHz电流时,由蛙坐骨神经支配的肌肉抽搐力在阻断电流撤去后的500 ms左右恢复至阻断前高度[32];当阻断信号的持续时间增至57 s时,由大鼠坐骨神经支配的肌力抽搐在撤去KHFAC后6 s左右恢复正常高度[51];当阻断信号的持续时间为30 s~2 min时,海兔无髓鞘神经的复合动作电位传导特性在撤去KHFAC后5 s内恢复正常,并且神经传导的恢复时间随阻断电流持续时间增加而变长,但是不依赖于刺激频率[37]。在上述实验中,KHFAC后续效应的持续时间相对短暂,此时被阻断的神经纤维在千频信号撤去后能较为快速地恢复正常传导能力。
在某些条件下,KHFAC后续效应的持续时间会延长至几分钟。此时,在撤去千频信号后的相当长一段时间内,神经纤维的传导能力仍被继续抑制.当采用5 kHz电荷平衡的KHFAC刺激1 min时,大鼠迷走神经的复合动作电位幅值在关闭阻断信号后1 min才能恢复正常[39]。类似地,当采用幅值为阻断阈值的5 kHz方波电流刺激5 s时,蛙坐骨神经至少需要1 min才能恢复正常传导能力[81],并且在撤去阻断信号30 s内混合动作电位的幅值恢复比其传导速率恢复慢[82],而恢复后的混合动作电位幅值和传导速度依赖于KHFAC幅值[81]。当KHFAC幅值增至阻断阈值的1.4~2倍且持续时间为5 min时,由蛙坐骨神经支配的肌肉抽搐力在阻断信号撤去后(249±58)s内才彻底恢复正常[33]。相应的恢复过程包含两个阶段,第一阶段是蛙坐骨神经继续处于彻底阻断状态,第二阶段是传导能力部分恢复阶段。这两个阶段的持续时间依赖于KHFAC强度和施加时间,不依赖于刺激频率。当对猫阴部神经施加幅值为0.5~5 mA、持续时间为30~60 s的1 kHz电流刺激时,后续效应的持续时间≥2 min,相应的传导阻断会在刺激结束后的6~18 min内逐渐消失[83]。特别地,增加千频电流的幅值和持续时间会进一步延长上述刺激后的阻断时间。在脊髓背角广动力学范围神经元中,后续效应的典型持续时间为2~3 min,在某些神经元中也可能达到10 min,具体数值与KHFAC的刺激时间有关[23]。类似地,Bhadra等[84]发现大鼠坐骨神经传导能力的恢复时间也依赖于KHFAC持续时间。当KHFAC持续时间小于15 min时,传导恢复可以在瞬时完成。但是当KHFAC持续时间为(50±20)min时,传导恢复所需时间明显增大。这些实验数据表明,KHFAC产生的后续效应在不同实验中具有很强的可变性。这种可变性的产生除了受KHFAC幅值和刺激时间影响,还与阻断信号的施加方式(电压或电流)、阻断信号中直流成分以及神经纤维类型和直径等有关[6]。
目前,关于KHFAC引发后续效应的机制研究主要以模型仿真为主。相关研究发现,KHFAC能明显改变轴突内外的Na+浓度和K+浓度,进而产生刺激后的传导阻断[71]。KHFAC后续效应的持续时间与轴突内外离子浓度的恢复速度和恢复方式有关。具体来说,短时间(<500 ms)刺激后阻断是由于轴突外Na+和K+浓度通过扩散方式快速恢复导致,而长时间(>3 s)刺激后阻断是由于轴突内正常Na+浓度通过细胞膜离子泵慢速恢复导致[71]。需要指出的是,当采用直流电流阻断神经传导时,阻断信号在靶向神经上也会引发后续效应,而这种后续效应的产生同样与离子浓度和离子泵有关[72]。
3.3 刺激参数与波形的影响
KHFAC诱发的神经传导阻断强烈依赖于刺激频率。大部分研究一致显示,能够实现神经传导阻断的最小刺激频率是4~5 kHz[11],低于4 kHz的KHFAC只能阻断大直径的神经纤维,不能完全阻断小直径纤维[32,52,55-56,60-61,85],或者在细纤维上诱发大量初始放电[55,65]。特别地,最小阻断频率在不同神经纤维之间具有很大差异性。对于直径为10~20µm的FH轴突模型,实现其完全传导阻断需要KHFAC频率大于8 kHz[57]。对于直径为2~5µm的FH轴突模型,实现其完全传导阻断却需要KHFAC频率至少大于10 kHz[57]。直径为10µm的CRRSS轴突模型的最小阻断频率为15 kHz[53],相应结果高于10µm的FH轴突模型。直径较小的大鼠坐骨神经的最小阻断频率为10 kHz[51],相应结果与FH轴突模型类似。对于直径为3.0、3.9和4.1 mm的猕猴正中神经来说,高于20 kHz的KHFAC能完全阻断其传导,而10 kHz的KHFAC会在每个神经上诱发强直性收缩[34]。这些数据表明,诱发神经传导阻断的最小KHFAC频率不仅依赖于神经直径,还与神经类型有关。此外,相关实验研究还发现,KHFAC对Wistar大鼠坐骨神经的传导阻断只发生在某一特定频段,而完全传导阻断则发生于其中更小频率范围,如果继续增大频率,靶向神经可能出现部分阻断、强直甚至不阻断现象[86]。这说明,实际应用中KHFAC频率并不是越高越好,需要谨慎选择。
KHFAC诱发的神经阻断效应还强烈依赖于刺激强度。生理实验显示,大鼠坐骨神经的阻断阈值在10~30 kHz范围内随KHFAC频率增加而线性增加[18],而猫阴部神经的阻断阈值在1~30 kHz范围内也与KHFAC频率成线性正比关系[29]。随后,模型仿真发现,MRG模型的阻断阈值在3~10 kHz范围内随KHFAC频率增加而非线性增加,在10~40 kHz范围内随频率增加而线性增加[65]。但是,也有研究显示阻断阈值与刺激频率之间并不是单调的线性关系。海兔无髓鞘神经的阻断阈值在5~12 kHz范围内随KHFAC频率增加而增加,但是在12~50 kHz范围内随频率增加而减小[37];C纤维的阻断阈值在5~20 kHz范围内随KHFAC频率增加而增加,在30~50 kHz范围内随频率增加而减小,但是A纤维的阻断阈值在5~50 kHz范围内总是随频率增加而增加[36];大鼠坐骨神经快纤维的阻断阈值在5~50 kHz范围内随KHFAC频率增加而增加,但是慢纤维的阻断阈值却随频率增加呈现先增加后降低的非单调趋势[24]。这些数据表明,增加频率通常导致神经纤维需要更高强度的KHFAC用以实现传导阻断,而阻断阈值与刺激频率之间的具体关系依赖于神经纤维类型。此外,前期基于HH模型[60-61]、MRG模型[63,65]和FH模型[57]的仿真研究表明,阻断阈值随纤维直径增加而降低。类似地,离体实验也显示直径较大的有髓鞘Aδ纤维的阻断阈值低于直径较小的无髓鞘C纤维[39],而本课题组前期研究也发现,混合MRG模型在直径为2.0μm和8.4μm时的阻断阈值低于10μm[74]。这些结果均暗示了KHFAC优先阻断直径较大的神经纤维。
KHFAC诱发的神经阻断效应还受刺激波形影响。基于HH、FH和MRG模型的仿真研究表明,方波的阻断阈值低于正弦波[26,61,87],而对称方波的阻断阈值低于方波簇[87]。在猫阴部神经的KHFAC实验中,脉冲宽度随频率变化的方波波形产生的传导阻断效果优于脉宽为固定值的方波波形[76,85]。基于HH和FH模型的仿真研究还发现,阻断阈值与刺激频率之间的关系也依赖于方波波形[59]。具体来说,当KHFAC为对称双极性方波时,阻断阈值在所研究的频率范围内一直是随频率增加而线性增加;当KHFAC为非对称双极性方波时,阻断阈值随频率增加呈现先增加后降低的演化趋势,而最大阻断阈值对应的频率依赖于正相脉冲宽度与负相脉冲宽度之差。近期,Peña等[27]进一步指出非对称双极性方波的电荷非平衡特性依赖于KHFAC幅值和频率,这导致由电荷非平衡引入的直流偏置效应也呈现频率依赖性,而直流偏置与刺激频率之间的关系在不同直径的神经纤维间具有明显差异,这种差异性造成了阻断阈值与KHFAC频率之间的非单调关系。特别地,他们还发现非对称双极性方波的阻断阈值与其占空比成反比关系[26]。此外,噪声的引入也会影响对称方波的阻断效应,特别是叠加-50 dB的高斯白噪声能够明显减低方波的阻断阈值[87]。
3.4 电极设置与位置的影响
KHFAC诱发的神经阻断效应与电极类型有关。在猫坐骨神经的阻断实验中,卡肤电极能够完全阻断由神经支配的所有肌肉运动,但是神经束内电极只能阻断一部分神经传导[28]。在尿道外括约肌的运动阻断实验中,采用螺旋电极的阻断阈值为(4±1)V,采用卡肤电极的阻断阈值为(7±3)V,而采用神经束内电极的阻断阈值为(26±10)V[30]。基于有限元模型和MRG轴突模型的仿真研究发现,点源(point source)电极和卡肤电极在轴突上产生的兴奋、阻断和复兴奋模式类似[63]。但是与卡肤电极相比,点源电极的阻断阈值对电极-轴突距离变化更为敏感。当电极与轴突之间距离较小时,点源电极对应的阻断阈值低于卡肤电极。当电极与轴突之间距离较大时,点源电极对应的阻断阈值高于卡肤电极。此外,基于FH模型的仿真研究发现,双电极的阻断阈值大于单电极,并且在相同的刺激条件下双电极双向脉冲刺激对靶向神经的损伤程度小于单电极双向脉冲刺激[88]。
KHFAC诱发的神经阻断效应与电极表面积也有关。增加双极性卡肤电极的表面积会提高KHFAC阻断的节能性,并且阻断阈值随卡肤电极表面积增加而呈现频率依赖式降低[49]。除了电极表面积,双极性卡肤电极两极触点之间的距离也是影响神经传导阻断的一个因素。电生理实验发现,大鼠坐骨神经的阻断阈值随触点之间距离增加而呈现先降低后增加的趋势,在触点距离为1~2 mm时阻断阈值达到最小值[64]。特别地,当两个触点之间距离从0.5 mm变为4 mm时,大鼠坐骨神经产生初始响应的上升时间变长,初始响应的峰值增加,并且肌力对时间的积分增大[21]。此外,电极材料不会对阻断阈值、初始响应和神经传导恢复产生明显影响,但是KHFAC阻断过程中功率耗散却随电极材料特性的不同而发生变化,特别是在高频情况下[89]。
KHFAC诱发的神经阻断效应还强烈依赖于阻断电极与神经纤维之间的距离。对于SE模型[51]和FH模型[90],增加阻断电极与轴突之间的距离会增加用以产生传导阻断的电流强度。对于直径为7.3、10和16µm的MRG模型,其在4和40 kHz电流刺激下的阻断阈值均随电极和轴突之间距离增加而增大[65]。对于直径为1、2和5.7µm的MRG模型,其在5、10和20 kHz电流刺激下的阻断阈值也均随电极和轴突之间距离增加而增大[63]。此外,前期研究显示当电极与轴突之间距离由1 mm降为0.3 mm时,直径为10μm的混合MRG模型的阻断阈值明显降低[74]。上述模型仿真数据一致表明,相同幅值的KHFAC优先在距离阻断电极较近的神经纤维处产生传导阻断,这是因为距离较近的靶向神经具有较低的阻断阈值。
3.5 临床应用
目前,KHFAC已被用于迷走神经刺激、脊髓刺激和胞体神经刺激等临床实验研究中。相关结果表明,KHFAC对迷走神经、感觉神经、阴部神经、运动神经和自主神经的阻断能力使其在临床上有着多方面的应用潜力。
KHFAC对迷走神经的阻断可以减轻饥饿感和增加饱腹感,进而以安全方式减小受试者的食欲和体重,从而治疗肥胖症[91-92]。在迷走神经的KHFAC阻断技术方面,美国EnteroMedics公司研发了一款名为Maestro的植入式神经电刺激仪。这款医疗设备采用5 kHz电脉冲信号阻断腹部迷走神经,进而达到控制食欲和减轻体重的效果。特别地,2015年美国食品药品监督管理局(Food and Drug Administration,FDA)批准可以将Maestro神经刺激仪用于肥胖治疗。此外,KHFAC对传入颈迷走神经的完全阻断还可以提高颈迷走神经刺激的抗炎作用,但其对传入颈迷走神经的不完全阻断却会加剧全身炎症[93]。
KHFAC对感觉神经的阻断可以缓解疼痛。例如,采用10~20 kHz的KHFAC阻断坐骨神经或胫骨神经可以安全方式缓解下肢截肢患者的神经瘤疼痛,这种缓解效应在一些受试者中可持续几个小时[14],采用10 kHz的KHFAC阻断胸脊髓传导可以明显减缓受试者的背部疼痛,并且这种缓解效应可以在没有明显感觉异常的情况下产生[1,13]。此外,KHFAC还可以用于治疗癌症疼痛、头痛、神经瘤和术后疼痛等一系列疼痛症状。特别地,前期临床研究显示KHFAC和经皮神经电刺激均能提高体感阈值,但KHFAC作用下受试者感觉更舒服、不适感更小[41]。
此外,KHFAC对运动神经的阻断可以治疗中风、脑瘫和多发性硬化症等疾病中的痉挛症状,还可以缓解肌张力障碍等疾病中的肌肉收缩症状[6,11,94]。KHFAC对阴部神经的阻断可以使尿道括约肌松弛,进而缓解脊髓损伤患者的排尿困难症状[2]。KHFAC对自主神经的阻断可以用以缓解高血压、心力衰竭、哮喘、肥胖、流涎和多汗等症状[6,94],而这一方面的应用潜力也渐渐成为目前生物电子医学所关注的一个重点。
上述这些实验研究证明了KHFAC在临床应用方面的安全性及有效性,为该技术的临床转化提供了基础和支撑。需要指出的是,临床上应用KHFAC时需要考虑受试者能否忍受由初始放电导致的不适感。对于一些具有严重疼痛症状的患者,通常期望经历短暂的初始放电,因为此时的不适感很小。对于需要控制慢性疼痛症状的患者,则可以经历相对较长时间的初始放电。对于一些需要频繁开启和关闭KHFAC刺激的患者,由于初始放电被激活的次数随之增加,所以通常也期望初始放电时间较短亦或是没有初始放电。
4 生物物理机制
早期关于KHFAC阻断神经传导的机制假说包括刺激引发胞外K+累积[43]和动作电位电流的同步中断[95]等,但是这些假说都缺乏直接的模型或实验证据支持。目前,一个具有证据支持的生物物理机制假说为KHFAC导致K+通道激活。基于无髓鞘HH模型的仿真结果显示,KHFAC驱使延迟整流K+通道进入持续的高激活水平,进而导致阻断电极附近细胞膜产生高强度的K+电流[60-61]。这种流向胞外的电流能够抑制流向胞内的Na+电流,进而驱使跨膜电压向超极化方向偏移,从而抑制动作电位产生以及阻断神经传导。特别地,K+通道的激活水平依赖于KHFAC幅值和频率,而这种依赖性能够解释电生理实验所发现的一些刺激强度特性。例如,增加KHFAC幅值会增加K+电流激活水平,因此只有足够高幅值的KHFAC才能产生传导阻断;增加KHFAC频率会降低K+电流激活水平,因此较高频率下需要较大阈值实现神经传导阻断。除了与KHFAC参数有关,K+通道的激活水平还依赖于温度。基于有髓鞘FH轴突模型的仿真结果显示,降低温度导致K+通道开通和关闭速度变慢,于是需要一个较低的最小阻断频率用以维持K+通道持续开通,所以最小阻断频率随温度降低而降低[56]。一些研究还发现,在某些情况下KHFAC的阻断机制是K+通道与其他通道共同激活导致。在有髓鞘FH模型中,KHFAC阻断神经传导的机制具有频率依赖性[58]。在4~10 kHz范围内,神经阻断主要由K+通道持续激活导致。在大于20 kHz的超高频范围内,神经阻断由Na+通道和K+通道的共同持续激活导致。与FH模型类似,在80 kHz的超高频刺激下无髓鞘HH模型在阻断电极处的Na+通道和K+通道均出现持续开放,进而造成神经纤维的传导阻断[96]。在有髓鞘SRB模型中,高于4 kHz的KHFAC通过诱发快速K+通道和慢速K+通道持续激活进而导致神经传导阻断[55]。特别地,阻断阈值处的慢速K+电流幅值是快速K+电流幅值的3.5~6.5倍,暗示了前者是诱发神经传导阻断的主导因素[55]。事实上,在无髓鞘轴突和两栖动物的有髓鞘轴突中,K+电流的暂态幅值很大,导致其在动作电位产生中的作用很强。因此,K+通道激活成为KHFAC阻断这些轴突传导的主要生物物理机制。
神经传导阻断的另一个具有证据支持的生物物理机制是KHFAC导致Na+通道失活。基于有髓鞘MRG模型的仿真结果显示,KHFAC作用下流向郎飞结内的Na+电流平均值高于流向郎飞结外的K+电流平均值[65]。这使得相应郎飞结出现一个流向胞内的净电流,随之产生的持续动态去极化导致Na+通道失活进而抑制动作电位产生以及造成轴突传导阻断。特别地,快速激活Na+电流和慢速持续Na+电流均参与了上述阻断效应,但是前者作用更明显。随后的仿真研究进一步发现,KHFAC作用下MRG模型的慢速K+通道、快速Na+通道和持续Na+通道电导值均高于KHFAC施加前的静息值,暗示3个离子电流均参与了神经传导阻断[17]。但是,流向胞内的Na+电流对传导阻断起促进作用,而流向胞外的电流对传导阻断起抑制作用。在阻断电极附近的郎飞结内,Na+电流强度高于所有流向胞外离子电流的强度,导致相应细胞膜产生持续的去极化响应。由于Na+通道的慢速失活变量无法跟随膜电压的千频变化,所以Na+电流动态只能由膜电压的持续去极化控制。因此,在被阻断的郎飞结内94.6%的Na+通道均被KHFAC失活,进而造成神经传导阻断。特别地,在体动物实验结果显示当采用雷诺嗪阻断持续Na+通道后,诱发大鼠产生神经传导阻断的KHFAC幅值增加[17],这进一步支持了MRG模型的上述仿真结果。事实上,在一些哺乳动物的有髓鞘轴突中,流向胞外的K+电流幅值很小,导致Na+电流在动作电位产生中的作用很强。因此,Na+通道失活成为KHFAC阻断这些神经传导的主要生物物理机制。
5 结语与展望
一些神经机能障碍的产生与感觉、运动或自主神经活动的异常增强有关,而阻断这些异常电活动在外周神经上的传导对于减轻这类疾病症状具有重要意义。KHFAC刺激是一种阻断神经传导的有效方法,它具有快速、可控、可逆、局部作用和副作用小的特点。但是,这种技术的一个缺陷是KHFAC在靶向神经内激活的高频初始放电会导致肌肉抽搐或疼痛感,它是该技术向临床转化的一个重要阻碍。近年来的相关研究采用电生理实验、神经计算模型或二者相结合的方法刻画了KHFAC刺激下外周神经响应的详细特性,提出了一些抑制和消除初始响应的方法,量化了KHFAC在不同神经上引发的后续效应,同时探究了KHFAC诱发神经传导阻断的生物物理机制及在临床上的潜在应用。研究结果显示,大于4 kHz的KHFAC能够有效阻断神经传导,但是阻断阈值、最小阻断频率和初始响应等受刺激波形和参数、神经类型和直径以及电极设计和位置等多种因素影响。KHFAC阻断神经传导的生物物理机制假说包括刺激诱发K+通道激活和Na+通道失活。这些结果为系统理解KHFAC技术的神经阻断效果与相关作用机制提供了科学依据,有助于该技术的安全、规范和合理应用。
目前,关于KHFAC神经阻断的研究已经取得了重要进展,为该技术的实验设计、设备研发、协议优化和科学应用提供了理论基础与方法借鉴。但是,仍然存在一些问题与机制有待于进一步研究,未来可以考虑从以下几个方面进行深入。
a.KHFAC产生的神经传导阻断受神经形态影响。研究发现,神经直径、神经束直径、束状组织和神经膜厚度等形态在人类、猪、猴子和大鼠等不同物种之间存在明显差异[97]。但是,这些形态差异与KHFAC神经阻断之间的关系尚不清楚。未来需要详细刻画不同物种的外周神经形态特性,在此基础上明确这些神经形态对KHFAC作用下阻断阈值、最小阻断频率、初始响应及后续效应的影响。
b.前期关于KHFAC阻断神经传导的机制认识几乎都是基于计算模型所得,虽然缺乏直接的电生理实验验证,但是却暗示了相关阻断机制依赖于轴突自身的电生理特性。研究显示,在年龄增加或慢性疾病病程发展的过程中,轴突的电生理特性也随之发生动态变化[6,98-99]。因此,明确KHFAC阻断神经传导的详细生理机理并识别其对轴突电生理状态的依赖性对于临床上安全合理应用KHFAC技术十分必要。
c.前期关于初始响应的电生理实验研究大多为麻醉状态下进行,而非麻醉状态下初始响应的幅值及持续时间等特性尚未得到系统刻画。此外,目前用以抑制初始响应的方法还存在一些缺陷,例如不能完全消除初始响应或者不适合临床植入。因此,探索相关方法在持续刺激或临床环境下的可行性与抑制效果十分必要。虽然本课题组前期提出的工程优化方法[74]可以解决上述缺陷,也具有一个可解释的作用机制。但是,相关方法尚处于计算模型仿真阶段,未来仍需要动物实验和临床实验进行进一步验证。
d.靶向神经的传导能力在KHFAC撤去后需要一段时间才能恢复,但是目前对这种后续效应的认识并不深入。未来需要结合电生理实验和神经计算模型系统刻画上述后续效应与刺激参数和波形、电极设置与位置以及神经类型和直径等因素之间的关系,进而明确KHFAC后续效应产生的生物物理机制以及引发的不利生理影响,同时研发相应的抑制方法。
e.在将高幅值KHFAC注入到生物组织过程中,高阻抗电极、刺激器上升和下降时间以及组织的低通滤波特性等可能造成阻断信号衰减和波形扭曲[6,12]。在这种情况下,靶向神经实际接收的阻断信号并不是精确的电荷平衡、对称、双极性千频波形,这为理解和复现相应实验结果带来了挑战。未来需要设计有效方法用以缓解甚至消除KHFAC波形的衰减和扭曲现象。
f.现有电流源或电压源产生的KHFAC极易受大量直流电流污染,导致实际输出的是电荷非平衡的阻断信号[6,12]。阻断信号中的直流成分对阻断阈值和后续效应具有很大影响,短期使用时会影响神经纤维的正常传导能力,而长期使用时会损害神经纤维和阻断电极[46-48]。未来需要不断完善和研发相关电气隔离方法用以抑制和消除直流成分对KHFAC信号的污染。
g.目前关于KHFAC阻断的认识大部分是基于动物实验和模型仿真所得。虽然也有少量的人体实验研究,但是刺激参数、刺激电极、刺激靶点、初始响应、后续效应、信号产生及施加方式等对临床上神经阻断的影响还尚不完全清楚,尤其是在清醒状态下。此外,KHFAC阻断在临床上的应用潜力还有待继续开发,特别是需要确定相应应用的有效参数、量化指标和产生机制。
