跨膜转录因子Nrf3的分子结构及生物学功能研究进展*
2022-08-20高烂宇阳艺琳杨茂元任勇刚
杨 婧 高烂宇 阳艺琳 杨茂元 任勇刚
(1)川北医学院基础医学与法医学院,南充 637000;2)川北医学院附属医院,南充 637000;3)深圳市第二人民医院,深圳 518000)
跨膜转录因子核因子E2相关因子3(nuclear factor-erythroid 2 related factor 3,NFE2L3)也 称Nrf3,属于碱性亮氨酸拉链CNC-bZIP(cap'n'collar basic-region leucine zipper)家族,该家族成员包括来源果蝇的CNC、秀丽隐杆线虫的Skn-1(Skinhead-1)、脊椎动物的p45 NFE2(nuclear factor-erythroid derived 2)、Nrf1/LCR-F1/TCF11(nuclear factor-erythroid 2 related factor 1,NFE2L1)、Nrf2(nuclear factor-erythroid 2 related factor 2,NFE2L2)、BACH1(BTB and CNC homology 1)和BACH2(BTB and CNC homology 2)蛋白[1-2]。Nrf3作为CNC-bZIP家族成员,通过bZIP结构序列与小分子肌肉腱膜纤维肉瘤(musculoaponeurotic fibrosarcoma,Maf)蛋白结合形成异源二聚体,并与位于其靶基因启动子区域的抗氧化反应元件(antioxidant response elements,AREs)或亲电子体反应元件(electrophile response elements,EpREs)结合调控下游基因表达,以发挥转录因子功能,影响干细胞分化、早期胚胎发育、炎症反应、细胞癌变和抗毒性保护作用等[3-6]。随着研究的不断深入,CNC-bZIP家族成员在慢性炎症、癌症、糖尿病、肥胖、神经退行性病变等疾病中的功能逐渐被揭示,Nrf3也显示出在基础研究和临床应用中的潜在价值[7]。为了进一步明确转录因子Nrf3在生物机体中的功能特性,本文总结现有Nrf3的相关文献及研究进展,从其表达分布、分子结构和生物学功能等方面进行简要综述。
1 Nrf3的定位与表达分布
人源Nrf3定位7p15.2染色体,位于HOXA(homeobox Acluster)基因位点附近[8-9]。Nrf3作为细胞应激反应的重要调节因子,在多种器官组织如心脏、脑、肺、肾、胰腺、结肠、前列腺、胸腺、脾脏等均有表达[8,10],在人巨核细胞、红细胞、睾丸、骨骼肌和卵巢中几乎不表达,但在角膜、皮肤、膀胱、B细胞、单核细胞和胎盘中呈高表达[8,11-12]。Nrf3也在多种恶性肿瘤中呈现高表达,如霍奇金淋巴瘤、非小细胞肺癌、前列腺癌、胶质母细胞瘤、大肠癌、睾丸癌、胰腺癌等[13-18](图1,http://timer.cistrome.org/),已被证实是12种癌症类型中127种显著突变的基因之一[19]。鼠源Nrf3也在多种器官组织中表达,脑、胸腺、睾丸和胎盘的表达水平较高,子宫、胃和肺的表达水平中等,肾脏中的表达水平较低,心脏、肝脏、脾脏和卵巢中几乎不表达[13]。

Fig.1 Differential expression of Nrf3 in tumor and normal tissues in TCGA database[20]图1 TCGA数据库中Nrf3在肿瘤和正常组织的差异表达[20]
2 Nrf3蛋白的分子结构
全长人源Nrf3蛋白含694个氨基酸(amino acid,aa)。Nrf3作为CNC-bZIP蛋白家族成员,具有典型的N端结构域(N-terminal domain,NTD)、反式激活结构序列(transactivation domain,TAD)和DNA结合结构序列(DNA-binding domain,DBD)。主要包括N端同源框1(N-terminal homology box 1,NHB1)、N端同源框2(N-terminal homology box 2,NHB2)、富含Pro/Glu/Ser/Thr序列(proline/glutamic acid/serine/threonine-rich sequence,PEST)、富含Asn/Ser/Thr结构域(Asn/Ser/Thr-rich domain,NST)、Nrf2-ECH同源6区(Nrf2-ECH homology 6-like,Neh6L)、帽环蛋白(cap'n'collar,CNC)、碱性亮氨酸拉链(basic leucine zipper,bZIP)、Nrf2-ECH同源3区(Nrf2-ECH homology 3-like,Neh3L)等[6,21](图2)。

Fig.2 Structural sequence diagram of human Nrf3 protein图2 人源Nrf3蛋白结构序列示意图
2.1 N端结构域(NTD)
NTD是Nrf3的负调控结构序列,该序列包含NHB1(12~31 aa)和NHB2(76~100 aa)。NHB1是内质网信号肽的一部分,已被证明是家族成员Nrf1靶向内质网所必需的[22-23]。生物信息学分析显示Nrf3蛋白序列N端也存在信号肽,该信号肽同样包含NHB1样序列,并且与Nrf1中的序列高度保守。有研究猜测细胞核中的Nrf3可能是缺少NHB1序列的截短形式[24]。NHB2为一段富含Leu/Val的多肽,该序列可能参与Nrf3在内质网的翻译后修饰和活性调节,Nrf3的蛋白酶体降解过程可能由NHB1和NHB2之间的间隔区(如CRAC1/2)监控[22-23]。鼠源Nrf3的NHB1是由n、h和c三区组成信号肽序列的一部分。n区(1~11 aa)控制90 ku糖蛋白的丰度,h区(12~23 aa)被证明是内质网Nrf3糖基化所必需的,c区(24~39 aa)含有一个信号肽酶裂解位点,负责从96 ku的前体产生90 ku的成熟Nrf3糖蛋白。c区和NHB2之间的氨基酸序列控制鼠源Nrf3蛋白水解为糖化和非糖化产物[23]。
2.2 PEST序列(158~172 aa)
PEST在Nrf3蛋白降解过程中发挥重要作用,负调节Nrf3的活性。PEST可能参与鼠源Nrf3和Nrf1缺失h区后对ARE驱动基因表达的调节,Nrf1缺失h区促进ARE驱动基因的表达,而Nrf3缺失h区对ARE驱动基因的表达并无显著影响[23-25]。
2.3 转录激活结构序列(TAD)
TAD包含3段序列,分别为Neh5L(211~256 aa)、NST(258~350 aa)和AD2L(351~400 aa)。Neh5L为TAD发挥转录激活作用的必需结构序列。NST序列中发现了7个潜在的N-连接糖基化位点,并被证明是Nrf3发生糖基化的区域[22,24]。AD2L为类似AD2的结构序列,AD2存在于Nrf1中,包含DSGLS/XS序列,该序列在CNC家族中高度保守,参与形成次级TAD,激活基因转录。在Nrf1结构序列中,AD2和NST是仅有的两个发挥正调控作用的序列,而存在于Nrf3中的AD2L序列是否发挥相似功能,目前尚不明确[26]。
2.4 Neh6L序列(401~498 aa)
Neh6L位于丝氨酸重复结构序列和DBD结构序列之间,该序列富含丝氨酸,参与蛋白质降解过程,对Nrf3活性发挥负调节作用[27]。
2.5 DNA结合结构序列(DBD)
DBD结构序列由CNC(499~542 aa)和bZIP(543~604 aa)组成。CNC序列最初从果蝇转录因子鉴定获得[21],由高度保守的43个氨基酸组成(如Nrf3中499~542 aa)[7],该序列存在于昆虫、鱼类、鸟类和哺乳动物,但在植物和真菌中不存在[28]。bZIP序列能够与小Maf蛋白在细胞核发生异二聚反应[27],参与调节胚胎发育、肿瘤发生、自身免疫和炎症性病变等多种病理生理过程[28]。高度保守的bZIP蛋白家族主要由创建结构序列(即BRLZ)决定,该结构序列由碱性区域(BR)和亮氨酸拉链(LZ)重复组成,长度为60~80 aa。BR碱性区域包含大约16 aa的共有序列,富含精氨酸和赖氨酸,与反应元件直接接触。它负责一个假定的核定位信号(NLS)和DNA结合活性,以获得目标基因。LZ亮氨酸拉链由7肽重复序列组成,介导bZIP蛋白的二聚化[29]。Nrf3从胞浆向胞核转位,通过bZIP结合小Maf蛋白形成异源二聚体,该活性复合体结合ARE序列,发挥转录因子功能,调节下游相关基因表达[26]。
2.6 Neh3L序列(605~636 aa)
Neh3L紧邻bZIP序列,位于Nrf3氨基酸序列的C端,参与组成CNC蛋白的CTD结构[27],Neh3L序列在家族成员中高度保守,但其具体功能尚不明确。
3 Nrf3的加工修饰
Nrf3作为一种糖基化蛋白,序列结构上具有与Nrf1相似的富含Asn/Ser/Thr的糖基化位点。Nouhi等[24]通过免疫印迹和免疫荧光实验发现,人源Nrf3存在3种电泳迁移形式以及不同形式Nrf3对应的细胞定位,当细胞内环境稳定时,中间迁移型具有最短的半衰期,较快迁移型更稳定,较快迁移型和中间迁移型对应未发生糖基化的Nrf3,主要定位于细胞核;而缓慢迁移型则对应于一种N-糖基化的Nrf3,主要存在于内质网。但目前对产生较快迁移型和中间迁移型Nrf3的分子机制及可能存在的切割修饰位点尚不明确。Zhang等[23]也发现鼠源Nrf3存在3种形式,猜测3种形式的蛋白质分子质量分别为90、80、70 ku,并证实90 ku的Nrf3代表一种糖基化蛋白,它在内质网中的产生依赖于N端信号序列的h区,80 ku的Nrf3可能代表糖基化的裂解蛋白或去糖基化的非裂解蛋白,70 ku的Nrf3可能是一种非糖基化的裂解多肽。同时证明鼠源Nrf3存在Site-1蛋白酶(Site 1 protease,S1P)切割位点。
蛋白质稳态平衡在机体细胞活动的维持中发挥重要作用,蛋白质稳态的异常往往导致多种疾病的发生[30]。泛素化作为蛋白质的翻译后修饰,在蛋白质稳态平衡的维持中起着关键作用。泛素-蛋白酶体系统中的26S蛋白酶体由催化核心20S蛋白酶体和调节亚基19S蛋白酶体组成,泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与80%以上蛋白质的降解[31-32]。Nrf3主要通过含F框及WD重复结构域蛋白7(F-box and WD repeat domain containing protein 7,FBW7)、E3泛素蛋白连接酶HRD1-含缬酪肽蛋白(E3 ubiquitin-protein ligase HRD1-valosin containing protein,HRD1-VCP)和β转导重复相容蛋白(β-transducin repeat containing protein,β-TRCP)等进行泛素化修饰后经蛋白酶体降解。FBW7作为SCF(SKP1-CUL1-F-box)型E3泛素连接酶的靶蛋白识别组分,介导Nrf3的泛素化降解。该过程需要糖原合成酶激酶3β(glycogen synthase kinase 3 beta,GSK3β)通过磷酸化FBW7结合位点,提高其与底物的亲和力。此外,FBW7也可阻断Nrf3介导NAD(P)H醌氧化还原酶1(NAD(P)H quinone dehydrogenase 1,NQO1)的表达[33]。当细胞处于应激状态时,Nrf3由胞质向胞核转移,天冬氨酸蛋白酶DNA损伤诱导蛋白2(DNA-damage inducible protein 2,DDI2)对其N端进行加工修饰,促进Nrf3向细胞核移动(图3)。在Nrf1的加工修饰过程中,DDI2切割NHB1促进Nrf1从ER释放入核,由于NHB1结构序列在Nrf1和Nrf3中高度保守,Nrf3的切割入核机制可能与Nrf1相似[3,34]。
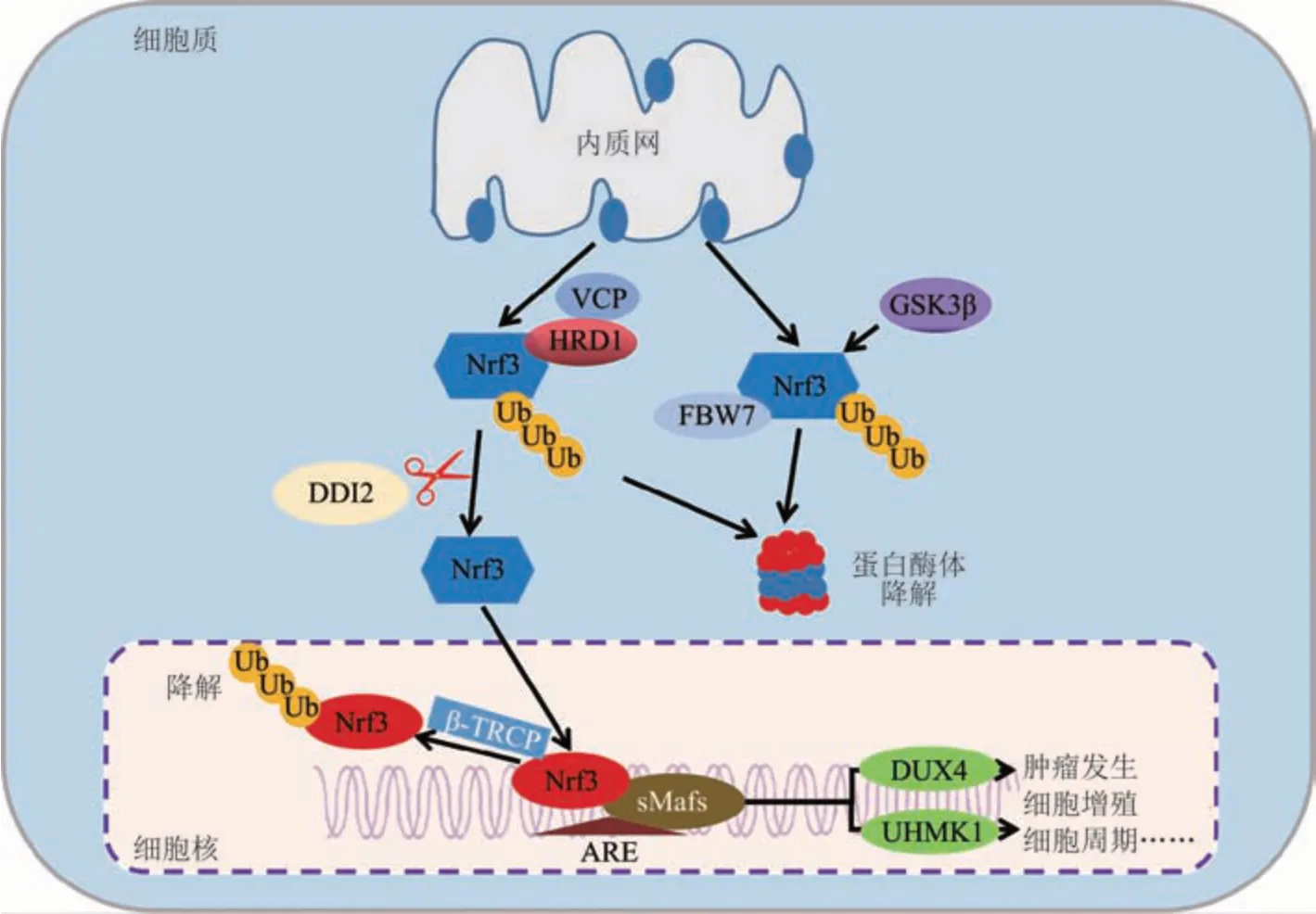
Fig.3 The mechanisms of expression regulation and degradation of Nrf3 in cells图3 Nrf3在细胞内的表达调控及降解机制
4 Nrf3与Nrf1、Nrf2的异同
4.1 表达分布和结构序列异同
Nrf1、Nrf2和Nrf3同属于CNC-bZIP家族,结构和功能具有高度同源性,都可以结合靶基因启动子区域的AREs和EpREs元件调节基因的表达,但每个成员在组织中的表达分布却并不相同。Nrf1和Nrf2几乎在所有组织中表达,Nrf3则在胎盘组织中显著高表达[35]。
在结构序列上,Nrf3和Nrf1都拥有与Nrf2同源的Neh1L、Neh3L、Neh5L、Neh6L序列,而Nrf2还具有Nrf2-ECH同源区(Nrf2-ECH homology,Neh2)、Nrf2-ECH同源 区4(Nrf2-ECH homology 4,Neh4)序列。Neh2结构上分为两个亚区,其氨基端序列与Nrf1和Skn-1的氨基端序列高度保守,羧基端序列在CNC家族成员中不保守,这说明Neh2是Nrf2的一个重要功能序列[36](图4)。Neh2介导Nrf2蛋白泛素化并结合位于胞浆的Kelch样ECH相关蛋白1(Kelch-like ECHassociating protein 1,Keap1),Keap1发挥负调节Nrf2的功能。研究发现,Keap1对Nrf2的抑制严格依赖于Neh2的结构完整性[37],由于Nrf3缺失Neh2序列,因此Nrf3的功能不受Keap1调控。Nrf3的氨基端比Nrf2多150个氨基酸,该序列含有的内质网锚定信号使其亚细胞定位异于Nrf2,但其在Nrf3的具体功能仍未知。在Nrf1中,NTD结构序列使得Nrf1/Nrf2在胞内差异分布,促进Keap1增加Nrf1的稳定性[38-39],进而对下游靶基因进行差异化调控。Neh4和Neh5作为Nrf2的转录激活结构序列,可连接cAMP反应元件结合蛋白(cAMP responsive element binding protein,
CREB),以获得有效的转录活性。同时,双荧光素酶实验证实Nrf2具有比Nrf1、Nrf3更强的激活报告基因能力,这种与ARE元件结合的超强转录激活能力,可能是由于Neh4和Neh5结构序列协同结合CREB结合蛋白(CREB binding protein,CBP)所产生的[40]。

Fig.4 The structural sequence diagram of Nrf1,Nrf2 and Nrf3 proteins图4 Nrf1、Nrf2与Nrf3蛋白结构序列示意图
4.2 功能异同
Nrf1和Nrf2是研究较多的CNC家族成员,结合已确定的ARE基序分析结果,Nrf2更容易与富含GC碱基区域的ARE结合,而Nrf1更容易与富含AT碱基的侧翼区域结合,这种序列上的偏好可能与分子信号调节不同相关,也决定了特定细胞环境下不同成员的激活[35]。并且Nrf1、Nrf2和Nrf3之间激活报告基因表达能力的差异,证实CNC蛋白与小Maf蛋白的聚合能力不同,因此与DNA的结合力也不尽相同[8]。研究发现,Nrf3可通过抑制Nrf1的mRNA多聚体形成抑制Nrf1的翻译,细胞质多聚腺苷酸元件结合蛋白3(cytoplasmic polyadenylation element-binding protein 3,CPEB3)作为Nrf3的靶基因,参与抑制Nrf1的翻译,它不仅是Nrf1和Nrf3互补维持基础蛋白酶体活性的关键因素,也是Nrf3高表达而不是Nrf1高表达的结直肠癌患者预后不良的关键因素[41]。同时,Nrf3与Nrf2也存在相关分子激活机制和生物学功能的区别,Nrf3的核转位并不抑制HRD1介导的Nrf3的细胞质降解,而Nrf2的核转位是通过抑制降解同时响应氧化应激而触发[3,42]。此外,Nrf3-Maf二聚体可通过结合ARE序列,竞争性抑制Nrf2介导的抗氧化蛋白NQO1的活性,发挥负调节ARE介导基因表达的功能[43]。
Nrf1基因敲除(Nrf1-/-)小鼠因胚胎红细胞成熟障碍而发生严重贫血,导致小鼠胚胎死亡[44]。Nrf2-/-小鼠无任何原发性特异表型变化,在胚胎发育、生长和繁殖方面没有明显的缺陷[45],但成年Nrf2-/-小鼠对环境刺激更敏感,并引发慢性氧化应激性所致的退行性病变[46]。现有研究结果表明,Nrf2的活性与抗氧化应激反应、延缓衰老和延长寿命等密切相关[47]。Nrf3-/-小鼠无任何原发性表型变化[13],但对化学致癌物更加敏感。
5 Nrf3的生物学功能
5.1 Nrf3在小鼠组织器官发育及疾病发生中的作用
鼠源Nrf3定位于染色体6B3,也位于Hoxa基因位点附近,全长鼠源Nrf3由660个氨基酸组成。研究发现,Nrf3-/-小鼠与野生型小鼠相比没有明显的表型差异,并且Nrf3-/-/Nrf2-/-和Nrf3-/-/p45-/-双基因敲除小鼠相比野生型小鼠也无原发性表型变化[13],小鼠生长发育正常。感染淋巴细胞脉络丛脑膜炎之后,Nrf3-/-小鼠与野生型相比在病毒特异性CD4 T细胞和淋巴细胞的数量之间无明显差异[13]。但是暴露于化学致癌物苯并芘后,Nrf3-/-小鼠更容易患上细胞性淋巴母细胞瘤,死亡率也显著上升[25]。抗氧化剂丁基羟基甲苯(BHT)处理后,Nrf3-/-小鼠体重下降更多,解剖发现小鼠附睾周围白色脂肪组织含量减少,同时也存在明显的肺功能损伤特征,如肺泡上皮细胞损伤、泡沫状肺泡巨噬细胞、肺泡出血和血管周围炎症细胞浸润等[48]。也有研究表明,Nrf3对小鼠的伤口愈合起到关键作用,一定剂量的紫外线照射诱导野生型小鼠角质形成细胞凋亡,而Nrf3-/-小鼠的角质形成细胞凋亡则降低[49]。
5.2 Nrf3在肿瘤发生发展中的作用
尽管Nrf3-/-小鼠无明显的表型变化,但其在人类疾病特别是肿瘤发生中的作用已初现端倪。Nrf3主要参与人结直肠癌、肝癌、乳腺癌、胰腺癌等肿瘤发生发展过程,并与患者的生存预后有关,具体研究进展包括:
5.2.1Nrf3与结直肠癌
结直肠癌是常见恶性肿瘤之一,现有研究证实Nrf3与结直肠癌的发生发展密切相关。在结直肠癌发生过程中,Wnt/β-catenin信号通路的突变是关键诱因[50]。Aono等[51]发现存在一段物种保守的Wnt响应元件(Wnt response element,TCF/LEF consensus element,WRE)序列作为Nrf3的识别基序,并证实Wnt信号通路中的β-catenin/TCF4复合物可以激活Nrf3表达,从而导致肿瘤细胞增殖和葡萄糖转运蛋白1(glucose transporter 1,GLUT1)表达上调。Chowdhury等[3]发现,Nrf3可通过诱导UHMK1基因表达促进癌细胞增殖。UHMK1是一种丝氨酸/苏氨酸蛋白激酶,通过磷酸化细胞周期蛋白依赖性激酶抑制剂1B(cyclin dependent kinase inhibitor 1B,p27Kip1)丝氨酸位点,调节细胞周期进展,敲除UHMK1减少p27Kip1的磷酸化而导致细胞生长停滞。Zhang等[52]对结肠癌HCT116和SW480细胞系敲减Nrf3,发现周期蛋白D1(cyclin D1,CCND1)和Ser807/811位点磷酸化Rb1(pRb1-ser807/811)细胞周期调节因子的表达降低,使细胞周期停滞在G0/G1期。Bury等[53]也深入研究了Nrf3与结直肠癌的关系,证实NF-κB的亚单位RELA与Nrf3的表达正相关,抑制剂处理或基因敲除RELA降低NF-κB表达,进而通过抑制Nrf3诱导DUX4的表达,DUX4作为周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)的直接抑制因子调节结直肠癌细胞增殖。此外结直肠癌细胞中Nrf3还可直接与蛋白酶体成熟蛋白(proteasome maturation protein,POMP)基因启动子区的ARE结合,激活20S蛋白酶体的组装,促进肿瘤抑制因子p53和Rb(retinoblastoma)的泛素非依赖性蛋白降解,进而促进结直肠癌的发生[18]。
5.2.2Nrf3与乳腺癌
癌症基因组图谱(The Cancer Genome Atlas,
TCGA)数据库分析结果显示,Nrf3在大多数肿瘤组织中高表达,如膀胱癌、结直肠癌和胰腺癌等,但在乳腺癌组织中的表达由于缺乏正常组织对照而不明确。由于乳腺癌分型不同,Nrf3在不同恶性程度的乳腺癌中所发挥的作用也存在差异。研究发现,Nrf3的表达与乳腺癌淋巴结转移和肿瘤分期呈负相关。Nrf3在乳腺癌MCF-7细胞的表达远高于MDA-MB-231和SKBR3细胞的表达,MCF-7细胞敲减Nrf3可促进癌细胞增殖,SKBR3和MDAMB-231过表达Nrf3抑制肿瘤细胞生长和转移。侵袭性肿瘤细胞首先改变细胞外基质和细胞与细胞之间的黏附,上皮细胞-间充质转化(epithelialmesenchymal transition,EMT)是启动细胞迁移的过程,也是癌细胞迁移的关键步骤[54]。研究发现,Nrf3通过AKT/ID3信号轴调节乳腺癌细胞的迁移和侵袭,外源性表达Nrf3失活AKT信号通路进而抑制DNA结合抑制剂3(inhibitor of DNA binding 3,ID3)蛋白的表达,上调E钙黏蛋白的表达,下调波形蛋白和N钙黏蛋白的表达,抑制EMT和细胞外基质的降解,从而降低乳腺癌细胞的迁移和侵袭能力[55-56]。
5.2.3Nrf3与肝细胞癌
在肝细胞癌(hepatocellular carcinoma,HCC)中,Nrf3的功能缺失可诱导肝癌细胞凋亡,下调N钙黏蛋白、波形蛋白和EMT转录调节因子(SNAI1、SNAI2)的表达,抑制HCC细胞增殖、迁移和侵袭[10]。研究发现,Nrf3在HCC组织细胞呈现高表达,敲减肝癌HepG2细胞Nrf3,抑制细胞的增殖与迁移,并进一步验证Nrf3可能通过激活Wnt/β-catenin信号通路促进HCC的EMT效应[57]。此外,Nrf3可结合Pla2g7(phospholipase A2group 7)基因启动子区域,调节Pla2g7表达和蛋白质活性,调控干细胞向平滑肌细胞分化[58],而Pla2g7被证实是HCC的标志蛋白[59],Nrf3可能通过直接激活Pla2g7的转录促进HCC细胞迁移侵袭,这也可能是Nrf3在HCC进展中的潜在作用机理[10]。
5.2.4Nrf3与胰腺癌
Wang等[17]通过TCGA数据库分析及实验证实,Nrf3蛋白质水平和mRNA水平在胰腺癌(pancreatic cancer,PC)中显著增加,同时发现Nrf3表达较高的PC患者通常伴有不良预后,单因素分析显示Nrf3的表达、TNM分期、淋巴结转移和病理分级是预测PC患者总生存率的重要因素。实验发现,Nrf3与血管内皮生长因子A(vascular endothelial growth factor-A,VEGFA)表达呈现正相关,在胰腺癌PANC-1和SW1990细胞中敲减Nrf3导致VEGFA表达减少,提示Nrf3可能通过调节VEGFA促进PC的进展[17]。
5.3 Nrf3在胚胎发育、干细胞分化中的作用
在早期研究CNC家族成员的表达和定位时发现,Nrf3参与活性氧平衡和早期胚胎发育过程中的肌肉前体迁移。Nrf3在鸡胚早期发育过程中的表达从心脏导管融合开始,而后循环至心肌,随后从心脏消失。中枢神经系统中Nrf3的表达在心室神经上皮细胞中逐渐出现并维持在低水平,并且至少持续到胚胎发育的第6天。有趣的是,在早期骨骺、发育中的肾脏集合管和卵黄囊的单个细胞中也观察到Nrf3的高表达[60]。
在平滑肌细胞(smooth muscle cell,SMC)分化的机制研究中,Nrf3对胚胎干细胞向平滑肌细胞分化至关重要。Nrf3的表达在SMC分化1~8 d后显著上升,敲除Nrf3导致平滑肌特异性标志物表达下调,Nrf3过表达显著上调SMC特异性标志物心肌蛋白,但不上调血清反应因子(serum response factor,SRF)。Nrf3直接与SMC分化基因(SMαA,SM22α)启动子结合,以剂量依赖方式促进SMC分化。同时证实Nrf3通过上调活性氧的产生,参与内质网应激诱导的SMC分化[61]。从上述生物学功能得出,Nrf3与组织器官的发育、肿瘤的发生发展密切相关(表1)。

Table 1 The roles of Nrf3 in tissues,organs and diseases表1 Nrf3在各组织器官及疾病中的作用

续表1
6 结 语
总结上述生物学功能,Nrf3参与机体内多种生理活动,在不同组织器官的功能和生理稳态中发挥独特作用(表1)。同时作为转录因子,Nrf3在肿瘤发生、发展过程中参与癌基因或抑癌基因的转录调控,可能同时具备促癌因子或抑癌因子的功能[65]。并且有研究发现,Nrf3可通过调节免疫系统活性参与肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)的发展,Nrf3的高表达可能通过抑制抗肿瘤免疫作用,使肿瘤细胞逃避免疫系统的检测,导致肾细胞癌的增殖和转移[63]。此外,新近文献关于Nrf3在细胞能量代谢、糖脂代谢中新功能的揭示[34,66],也提示其可能是基础生命活动调节的核心分子。但目前对于Nrf3的研究仍较少,对其分子功能及调节机制的了解非常有限,Nrf3对细胞基础生命活动调节的机制仍需深入阐明。如应激状态下,Nrf3与Nrf1/Nrf2如何平衡以维持氧化还原稳态、内质网应激、蛋白质稳态?临床上,如何解释Nrf3在大部分肿瘤显著高表达,而Nrf1/Nrf2并无显著变化?Nrf3在大部分肿瘤组织显著高表达的原因?Nrf3可能存在的非转录因子功能?这些问题均需要进一步研究探索。
总之,Nrf3作为CNC-bZIP家族一员,在调控组织器官发育和特化、细胞氧化还原平衡、蛋白质稳态和细胞代谢等方面发挥重要作用。相信随着研究的深入,将不断丰富Nrf3的生理功能和分子调节机制,也将为肿瘤、糖尿病、神经退行性病变等疾病的诊断与治疗带来新思路。
