外源SNP对盐胁迫下甜瓜幼苗生长及抗氧化酶活性的影响
2022-08-19李世玉程登虎
李世玉,程登虎,闫 星,赵 娟,袁 飞,徐 红,张 勇*
(1 西北农林科技大学 园艺学院,陕西杨陵 712100;2 东台国家现代化农业产业园,江苏东台 224200)

甜瓜(CucumismeloL.)是葫芦科(Cucurbitaceae)甜瓜属的一年生蔓生草本植物,是重要的设施园艺经济作物,具有一定耐盐性[7]。但是近年来设施土壤盐渍化越来越严重,盐胁迫对甜瓜生产造成了不可估计的经济损失。利用外源褪黑素[8]、脯氨酸[9]、甜菜碱[10]等能有效缓解盐胁迫对甜瓜生长发育的抑制作用,在此基础上探索利用其他外源物质缓解盐胁迫对甜瓜造成的伤害,对降低设施土壤盐渍化造成的损失具有重要作用。
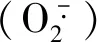
外源NO对缓解植物轻度盐胁迫危害取得了一定的进展,但目前缺乏有关外源NO对甜瓜在重度盐胁迫下生理调控影响的研究。因此,本试验通过叶面喷施不同浓度的外源NO供体硝普钠(SNP),研究其对重度盐胁迫(300 mmol·L-1NaCl)下甜瓜幼苗生长、光合色素含量、细胞膜透性、抗氧化酶活性、渗透调节物质含量的影响,以期为外源NO在甜瓜抗盐栽培中的应用提供理论依据。
1 材料和方法
1.1 材 料
试验于2020年5月至10月在西北农林科技大学园艺学院日光温室进行,供试材料为耐盐性较差的厚皮甜瓜品种‘农大甜10号’,种子由西北农林科技大学园艺学院西甜瓜课题组提供。NO供体为亚硝基铁氰化钠二水合物(C5FeN6Na2O·2H2O) (sodium nitroprusside,SNP),购自源叶生物公司,纯度为98.5%。
1.2 试验处理与设计
选取饱满、大小一致的甜瓜种子浸种催芽(55 ℃温水中浸泡4~6 h后,放在铺有湿润纱布的培养皿内,置于28 ℃恒温箱中12~24 h),待种子露白后,播种于50孔穴盘育苗。待幼苗长至2片真叶时将幼苗移栽至营养钵(10 cm×10 cm)中,每钵1株,每隔2 d浇1次1/4 Hoagland营养液,每钵用量为20 mL。当幼苗长至三叶一心时挑选生长一致的幼苗进行处理。
试验共设7个处理:1) 对照 (CK),正常浇水; 2) S0,300 mmol·L-1NaCl; 3) S50,300 mmol·L-1NaCl+50 μmol·L-1SNP; 4) S100,300 mmol·L-1NaCl+100 μmol·L-1SNP;5) S150,300 mmol·L-1NaCl+150 μmol·L-1SNP; 6) S200,300 mmol·L-1NaCl+200 μmol·L-1SNP; 7) S250,300 mmol·L-1NaCl+250 μmol·L-1SNP。每处理重复3次,共45株。处理中试剂的浓度是通过前期预试验中设置不同浓度NaCl(100、200、300、400 mmol·L-1)和SNP(50、100、300、500、800 μmol·L-1)筛选得出。SNP处理液在傍晚20:00进行叶面喷施(以叶面欲滴又不滴水为宜),连续喷施3 d,最后一次喷施后第2天上午9:00点进行NaCl灌根处理(记做第0天),第3天上午再进行一次灌根处理,第7天上午取幼苗上数第2~3片完全展开叶(储存于-80 ℃超低温冰箱中)进行各种生理指标的测定。
1.3 测定指标及方法
1.3.1 生长发育指标(1)株高:以子叶到生长点的高度为株高;(2)茎粗:用游标卡尺测量子叶上方2 cm处茎的粗度;(3)鲜重和干重:用去离子水冲洗植株后,吸水纸拭干,称量地上部和地下部鲜质量。然后分别将根、茎、叶于110 ℃烘箱中杀青后,调至70 ℃烘干至恒重,称量器官干重;(4)壮苗指数:壮苗指数= (茎粗/株高+根干质量/茎叶干质量) × 全株干质量。
1.3.2 光合色素含量叶片叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素的含量采用95%乙醇浸提法[20]测定。各处理重复3次。
1.3.4 抗氧化酶活性称取0.3 g研磨均匀的叶片样品加入6 mL 50 mmol·L-1pH7.8的磷酸缓冲液,冰浴30 min后,4 ℃、12 000 g离心10 min,上清液即为提取的粗酶液,可用于超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)的测定。各处理均重复3次。
(1)SOD活性:采用氮蓝四唑(NBT)还原法[25]测定。酶反应体系为50 mmol·L-1pH7.8磷酸缓冲液、136 mmol·L-1甲硫氨酸、20 μmol·L-1核黄素、750 μmol·L-1NBT、100 μmol·L-1乙二胺四乙酸二钠、0.5 mL蒸馏水和0.1 mL粗酶液(对照加0.1 mL蒸馏水),其中一管对照放置黑暗中作空白管,将其余各管光照30 min,以空白调零,测定反应液在560 nm的吸光度。
(2)POD活性:采用愈创木酚比色法[25]测定。酶反应体系为 50 mmol·L-1pH7.8磷酸缓冲液680 μL、 250 mmol·L-1愈创木酚100 μL、20 μL酶液,最后加入 200 mmol·L-1H2O2启动液200 μL,立即测定470 nm的吸光度,每隔15 s读数一次,共测2 min。
(3)CAT活性:采用紫外吸收法[26]测定。酶反应体系为 50 mmol·L-1pH7.0磷酸缓冲液780 μL、20 μL酶液,最后加入 200 mmol·L-1H2O2启动液200 μL,立即测定240 nm的吸光度,每隔10 s读数一次,共测1.5 min。
(4)APX活性:采用过氧化氢法[27]测定。酶反应体系为 50 mmol·L-1pH7.3磷酸缓冲液580 μL、1 mmol·L-1乙二胺四乙酸二钠 100 μL、5 mmol·L-1抗坏血酸ASA100 μL、20 μL酶液,最后加入5 mmol·L-1H2O2启动液200 μL,立即测定290 nm的吸光度,每隔5 s读数一次,共测1.5 min。
(5)GR活性:采用比色法[27]测定。酶反应体系为100 mmol·L-1pH8.0 Tris-HCl 640 μL、10 mmol·L-1乙二胺四乙酸二钠100 μL、2.5 mmol·L-1GSSG 120 μL、20 μL酶液,最后加入1 mmol·L-1NADPH启动液120 μL,立即测定340 nm的吸光度,每隔5 s读数一次,共测1.5 min。
(6)MDHAR活性:参考Krivosheeva等[28]的方法测定。酶反应体系为50 mmol·L-1pH7.3 Hepes-KOH 740 μL、11 mmol·L-1乙二胺四乙酸二钠 10 μL、25 mmol·L-1抗坏血酸ASA 110 μL、20 μL酶液,最后加入20 μL(AO)启动液,立即测定340 nm的吸光度,每隔10 s读数一次,共测1.5 min。
(7)DHAR活性:参考Nakano等[27]的方法测定。酶反应体系为 100 mmol·L-1pH7.0 Hepes-KOH 640 μL、1 mmol·L-1乙二胺四乙酸二钠100 μL、25 mmol·L-1还原型谷胱甘肽GSH 120 μL、20 μL酶液,最后加入2 mmol·L-1氧化态脱氢抗坏血酸DHA 启动液120 μL,立即测定265 nm的吸光度,每隔10 s读数一次,共测1.5 min。
1.3.5 游离脯氨酸和可溶性蛋白含量游离脯氨酸(Pro)含量采用磺基水杨酸法[26]测定。称取0.2 g研磨均匀的叶片样品加入2 mL磺基水杨酸,沸水浴中提取10 min,冷却后,6 000 g离心10 min,取1 mL上清、1 mL蒸馏水、1 mL冰醋酸、2 mL酸性茚三酮,沸水浴中显色1 h,冷却后加2 mL甲苯,涡旋震荡0.5 min,静置分层,吸取红色甲苯相,520 nm处测定吸光度。可溶性蛋白含量采用考马斯亮蓝法[26]测定。称取0.2 g研磨均匀的叶片样品,加入10 mL蒸馏水,取2~3 mL匀浆于离心管中,5 000 g离心10 min,上清液即为蛋白质提取液。吸取蛋白质提取液0.1 mL,加入0.9 mL蒸馏水和5 mL考马斯亮蓝G-250试剂,充分混合,放置2 min后在595 nm比色,记录吸光值。各处理重复3次。
1.4 数据分析
用 Excel 2017和 Origin Pro 2019软件整理实验数据和作图,用 SPSS 19. 0统计软件进行单因素方差分析,采用Duncan新复极差法进行差异显著性检验(α= 0.05)。
2 结果与分析
2.1 外源SNP对盐胁迫下甜瓜幼苗植株表型和生长的影响
盐胁迫条件下不同SNP处理甜瓜幼苗植株生长表型情况如图1所示。与CK相比,甜瓜叶片在单独盐胁迫处理(S0)下明显黄化,边缘卷曲枯萎严重。不同浓度外源SNP处理(S50-S250)的效果不同。与S0相比,S50处理下叶片稍有恢复但仍明显发黄卷曲;S150处理下叶片已明显复绿,生长状态最好;S100处理叶片状况比S150稍差;S200处理叶片状况较差,稍优于S250处理;S250处理叶片生长状况最差。可见,S150处理对甜瓜所受盐胁迫伤害的缓解效果最佳,随后依次为S100、S50、S200、S250处理。
同时,在单盐胁迫处理(S0)下,甜瓜幼苗的株高、茎粗、地上部和地下部的鲜重和干重、壮苗指数均比对照显著下降,降幅在28.85%~51.50%之间(表1)。而施加不同浓度的外源SNP均能显著提高NaCl胁迫下甜瓜幼苗各生长指标,且各指标随SNP浓度的增加呈现先上升后下降的趋势,但都高于S0处理,低于CK处理。其中以S150处理的株高、茎粗、地上部和地下部的鲜重和干重、壮苗指数最大,比S0处理分别提高了43.55%、29.73%、51.20%、54.55%、76.11%、45.45%、48.94%,除地下干重外增幅均达到显著水平。
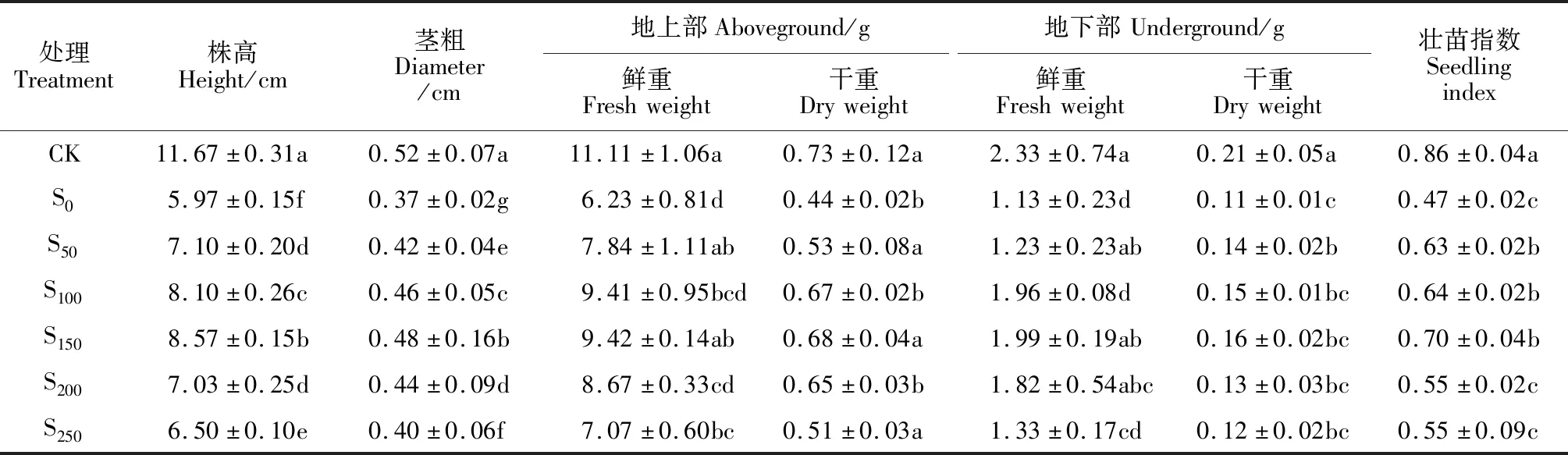
表1 外源SNP对盐胁迫下甜瓜幼苗生长的影响Table 1 Effects of exogenous SNP on the growth of melon seedlings under salt stress
2.2 外源SNP对盐胁迫下甜瓜幼苗光合色素含量的影响
盐胁迫下甜瓜幼苗的光合色素含量与对照(CK)相比均出现不同程度的下降(表2)。其中,单盐胁迫处理(S0)幼苗叶片的叶绿素a、叶绿素b、类胡萝卜素、叶绿素总量比CK分别显著降低了51.33%、44.74%、29.17%、49.01%。叶面喷施不同浓度SNP处理后,叶片各光合色素含量均比S0处理不同程度增加,但仍显著低于相应的对照;随SNP浓度的增加,各光合色素含量均呈现先上升后下降的趋势,并且都在S150处理下增幅最大,此时叶绿素a、叶绿素b、类胡萝卜素、叶绿素总量分别比S0处理显著提高了47.27%、28.57%、11.76%、40.26%。

表2 外源SNP对盐胁迫下甜瓜幼苗光合色素含量的影响Table 2 Effects of exogenous SNP on photosynthetic pigment contents of melon seedlings under salt stress
2.3 外源SNP对盐胁迫下甜瓜幼苗叶片产生
速率及H2O2和MDA含量的影响
图2显示,与CK相比,单盐胁迫处理(S0)大幅
2.4 外源SNP对盐胁迫下甜瓜幼苗叶片抗氧化酶活性的影响
如图3所示,单一盐胁迫处理(S0)甜瓜幼苗叶片SOD、POD、APX、GR、MDHAR和DHAR的活性均比对照显著提高20%~215%,并以MDHAR活性增幅最大,而其CAT活性却比对照显著降低53.25%。与S0处理相比、不同浓度SNP处理甜瓜幼苗叶片SOD、POD、CAT、APX、GR、MDHAR和DHAR的活性大多不同程度升高;随SNP处理浓度的增加,7种酶活性均呈先升高后下降的趋势变化,并均在S150处理下得到最大增幅,此时比相应S0处理分别显著提高了25.20%、63.18%、56.62%、18.00%、68.00%、43.65%、36.89%,说明叶面喷施适宜浓度SNP能显著增强盐胁迫甜瓜幼苗叶片的抗氧化酶活性,从而增强幼苗耐盐胁迫能力。
2.5 外源SNP对盐胁迫下甜瓜幼苗叶片脯氨酸和可溶性蛋白含量的影响
从图4可知,叶面喷施不同浓度SNP能显著提高盐胁迫下甜瓜幼苗叶片中脯氨酸和可溶性蛋白含量。其中,与对照相比,单独盐胁迫处理(S0)能分别使甜瓜叶片中脯氨酸与可溶性蛋白的含量显著提高107%和49%;随SNP浓度的升高,甜瓜叶片中脯氨酸和可溶性蛋白含量均呈现先上升后下降的变化趋势,且大多显著高于S0处理,并均在S150处理下含量最高,此时分别比S0处理显著提高了73.86%和42.98%。
3 讨 论
盐胁迫是主要的非生物胁迫之一,当植物遭受盐胁迫时,最直观的表现是生物量积累的降低,而生物量积累的降低是植物遭受生理伤害的综合反映[5]。本试验中盐胁迫甜瓜幼苗的生长受到显著抑制,其株高、茎粗、干鲜重均明显降低,许姣姣[21]利用γ-氨基丁酸提高了甜瓜内源NO含量进而增强甜瓜耐盐碱性,本研究利用叶面喷施不同浓度外源NO供体SNP后,盐胁迫的生长抑制作用得到明显缓解,并且随SNP浓度的增大缓解作用呈现先上升后下降的趋势,并在150 μmol·L-1SNP)的缓解效果最佳,这种趋势与吴铮等[29]在藜麦幼苗中的研究结论一致。只是最佳浓度有所不同,可能是由于物种不同,或本试验为重度盐胁迫所导致。
光合色素作为植物吸收、传递和转换光能,进行光合作用的物质基础,其含量的高低直接关系到叶片光合功能的充分发挥[30]。本研究结果表明,盐胁迫下甜瓜幼苗叶片光合色素含量均显著降低,而施加SNP处理可使胁迫下幼苗叶片的各色素含量获得不同程度的提高,这与孙德智等[20]在番茄幼苗中的研究结论一致。说明外源NO可通过提高盐胁迫下光合色素的含量而影响甜瓜幼苗的生长发育,进而增强了植株的耐盐性。
细胞膜是维持植物体正常生长代谢的重要组成部分[31]。逆境胁迫对植物细胞最直接的伤害就是破坏细胞膜,导致细胞内代谢平衡发生紊乱,活性氧
同时,SOD、POD、CAT等保护酶能有效减轻ROS对细胞膜系统的伤害,抑制膜脂过氧化,以减轻逆境胁迫对植物细胞的伤害[33]。SOD能将毒性
另外,植物为了减缓由盐胁迫造成的生理代谢不平衡,通常会在植物胞内积累一些小分子可溶性有机化合物,例如可溶性蛋白、脯氨酸等,以通过渗透调节来降低细胞水势,保证植物细胞正常生理功能,从而使植物正常生长[35]。因此通过外源物质诱导和调控植物中脯氨酸和可溶性蛋白的含量可以有效缓解逆境伤害[36]。本研究结果表明,在盐胁迫条件下,喷施不同浓度外源SNP后甜瓜幼苗叶片的脯氨酸和可溶性蛋白的含量明显增加,并且随SNP施用浓度的增大呈现出先上升后下降的趋势,并在150 μmol·L-1浓度处理下含量增幅达到最大。这一变化规律与在小麦幼苗[37]、番茄[38]、黄瓜[39]上相关的研究结论一致,但最佳浓度有所差异,可能是由于胁迫效果与物种之间差异导致。这说明添加SNP有利于植物幼苗体内渗透调节物质的合成与积累,减轻盐胁迫对甜瓜幼苗生长的危害,提高幼苗对盐胁迫的适应性。
综上所述,叶面喷施外源SNP可以有效促进甜瓜幼苗叶片光合色素含量、抗氧化酶活性、渗透调节物质含量的提高,显著降低细胞膜透性。在本研究中,150 μmol·L-1SNP叶面喷施处理可高效修复甜瓜幼苗因NaCl胁迫引起的伤害,恢复和维持植株生理代谢和生化反应的恒稳状态,缓解甜瓜幼苗在逆境下受到的生长抑制,提高了甜瓜幼苗的抗盐性。
