液相色谱-串联质谱法测定茶叶中5种农药
2022-08-19陈亮高海荣陈硕王秀云张聪刘亿婕
陈亮,高海荣,陈硕,王秀云,张聪*,刘亿婕*
1. 福建省食品药品质量检验研究院(福州 350000);2. 福建省药品审核查验中心(福州 350000)
茶叶中富含茶多酚类化合物和人体必需的多种微量元素,有利于健康,茶饮料受到世界各国人民的喜爱。然而在茶叶种植过程中,会使用农药来除草、除虫、防病等[1-2],有些农药甚至会超标[3],因此农药残留成为茶叶质量安全问题之一[4]。2016—2020年,欧盟多次通报茶叶中丁醚脲、唑虫苯甲酰胺问题[5],同时我国最新修订的GB 2763—2021《食品安全国家标准 食品中农药最大残留量》中并未规定茶叶中甲基硫菌灵、氯噻啉、氯虫苯甲酰胺农药残留检测的标准方法及限量(氯噻啉为临时限量),因此建立适用于茶叶中丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺5种农药残留量的检测方法非常有必要。
QuEChERS样品前处理方法于2003年首次被提出[6],是一种简便、可靠的前处理技术[7-9],QuEChERS被广泛应用于食用农产品中农兽药残留的检测[10-11]。MWCNTs是一种新型材料,由多层石墨化片卷曲而成的碳纳米管,其具有比表面积大、表面吸附性能好、选择性能好等优点。近年来,也有少量报道将MWCNTs用于农药残留检测中[12-13],为快速高效的检测茶叶中丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺5种农药残留,试验基于QuEChERS方法,优化N-丙基乙二胺(PSA)、C18、MWCNTs的用量,利用高效液相色谱-串联质谱法同时分析检测茶叶中这5种农药残留。
1 材料与方法
1.1 仪器与试剂
1.1.1 试验仪器
AB 5500 Qtrap三重四极杆质谱仪(美国AB公司);1290 Infinity安捷伦高效液相色谱仪(美国安捷伦公司);CR21N落地式高速冷冻离心机(日本日立公司);Milli-Q超纯水处理系统(美国Millipore公司);XSE204电子分析天平(瑞士梅特勒有限公司);Turbo Vsp Lv全自动氮吹仪(美国Biotage公司);HM100刀式研磨机(北京格瑞德曼公司);MS3型涡旋混合器(德国IKA公司)。
1.1.2 试剂与材料
甲醇、乙腈、丙酮(色谱纯,德国默克公司);醋酸钠、无水硫酸镁(分析纯,国药集团化学有限公司);MWCNTs(内径3~5 μm,外径8~15 μm,长度50 μm)、甲酸、醋酸(质谱级)(均为上海阿拉丁化学试剂有限公司);SelectCoreTMN-丙基乙二胺(PSA)50 μm、SelectCoreTMC1850 μm、陶瓷均质子(长2 cm×外径1 cm):纳谱分析技术(苏州)有限公司;丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺对照品(100 μg/mL,天津农业部环境质量监督检验测试中心);Agilent Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm,美国Agilent公司)。
茶叶样品购自当地超市或市场,空白基质样品来自购买样品初筛后确定无丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺残留的样品。
1.2 试验方法
1.2.1 样品前处理
取不少于200 g的茶叶样品,经刀式研磨器粉碎后,过0.180 mm(80目)的筛后封装于塑料瓶中,于0~4 ℃保存,准确称取2.0 g(精确至0.000 1 g)茶叶粉末于50 mL塑料离心管中,加入10 mL水涡旋混匀后,静置浸泡30 min。加入10 mL酸化乙腈(含1%醋酸,体积比)并混匀,盖上盖子后置于冰箱-18 ℃冷却30 min,加入6 g无水硫酸镁、1.5 g醋酸钠及1颗陶瓷均质子,盖上盖子,剧烈涡旋振荡2 min,以8 000 r/min的转速离心10 min。取5 mL上清液于装有900 mg无水硫酸镁、200 mg PSA、200 mg C18及50 mg MWCNTs的15 mL离心管内,振荡涡旋2 min后,以8 000 r/min的转速离心10 min,取上清液过0.22 μm有机滤膜,待上机测定。
1.2.2 标准溶液的配制
用乙腈将丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺标准物质配制成1 μg/mL 5种农药混合标准溶液,于-18 ℃避光保存;根据试验要求,按照1.2.1的样品前处理步骤处理空白茶叶样品制得空白样品基质,用空白基质溶液配制质量溶度为0.1,0.5,1.0,5.0,10.0,20.0和50.0 ng/mL的5种农药的混合标准工作溶液。
1.2.3 液相色谱-质谱条件
液相条件:Agilent Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm)。进样体积2 μL,流速0.3 mL/min,柱温30 ℃。流动相A为0.1%甲酸水;流动相B为乙腈。液相梯度洗脱:0~1 min,70% A;1~5 min,70%~10% A;5~8 min,10% A;8~9 min,10~70% A;9~11 min,70% A。
质谱条件:离子源采用电喷雾电离正模式(positive electrospray ionizationm,ESI+),离子源温度450 ℃;气帘气压20 psi;辅助气压50 psi;雾化气压50 psi;电喷雾电压4 500 V;碰撞室入口电压9 V;碰撞室出口电压15 V。扫描方式采用多反应监测(multiple reaction monitoring,MRM)模式。
2 结果与分析
2.1 质谱条件优化
将5种农药标准物质配制成50 ng/mL混合标准溶液,在正离子模式下,采用多反应监测模式,确定5种农药的母离子、定性离子、定量离子、去簇电压、碰撞电压。5种农药质谱条件参数优化结果见表1。用空白基质配制50 ng/mL 5种农药的色谱图见图1。
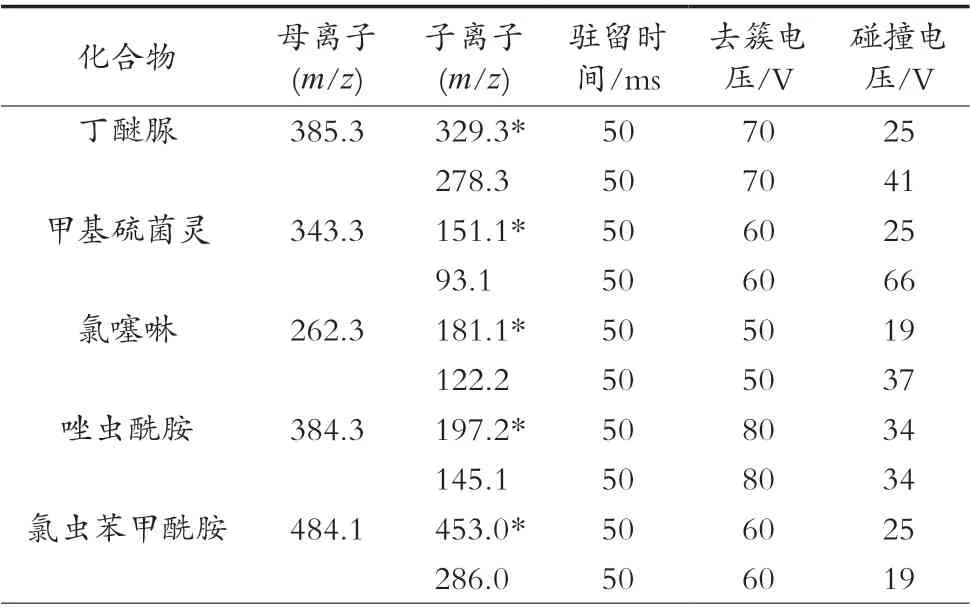
表1 5种化合物质谱参数
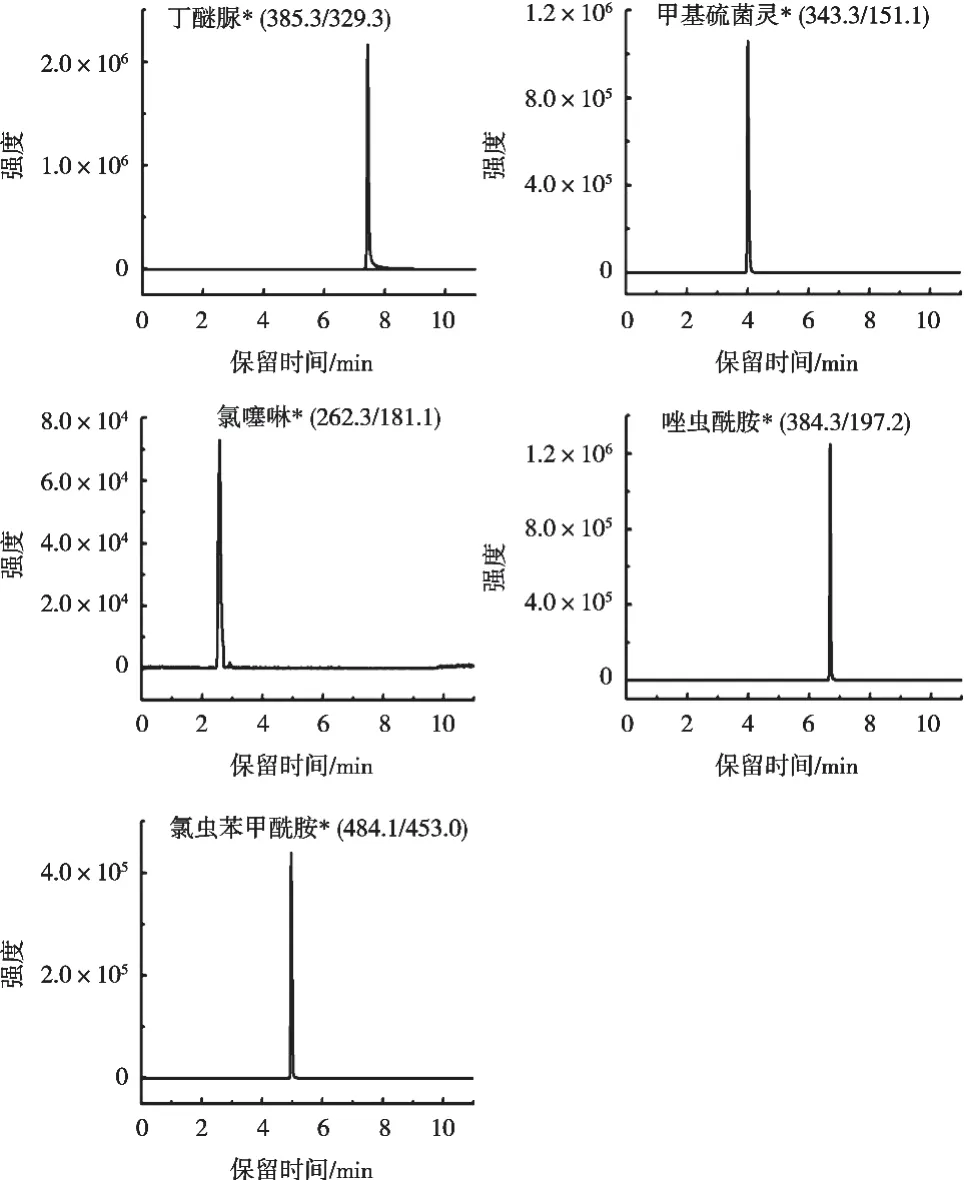
图1 空白基质配制50 ng/mL 5种化合物的色谱图
2.2 提取溶剂的选择
茶叶样品的基质复杂,色素含量较多,使用适当的提取溶剂,有利于除去样品中的杂质,提高检验结果的准确性。甲醇、乙腈、酸化乙腈、乙酸乙酯、丙酮是农药残留提取过程中常用有机试剂。试验比较甲醇、乙腈、酸化乙腈(含1%醋酸,V/V)、乙酸乙酯、丙酮作为提取溶剂时对5种农药残留的提取效率。试验发现,使用丙酮、酸化乙腈、乙腈作为提取溶剂时,5种农药残留的回收率均较好,但是丙酮提取时样品的颜色较深,不利于后续的净化,乙腈对大部分农药均有较高的溶解性,乙腈作为提取剂提取的杂质较少[14],在乙腈中加入一定量乙酸,维持溶液pH,可减少待测药物的降解[15],因此选用酸化乙腈(含1%醋酸,V/V)作为提取溶剂。
2.3 流动相的选择
比较甲醇-水、乙腈-水、乙腈-0.1%甲酸水作为流动相时对各物质的响应的影响。试验发现乙腈-0.1%甲酸水作为流动相按照一定比例梯度洗脱的效果最佳,加入微量的酸更有利于各物质的离子化,峰形较好,响应较高,因此流动相选用乙腈-0.1%甲酸水。
2.4 净化剂的选择
茶叶中富含咖啡因、茶多酚、有机酸、色素等物质,为有效的除去杂质,以提高检测的准确性,净化过程是一个关键的步骤。试验方法采用PSA、C18及MWCNTs作为吸附剂,PSA能有效除去基质中的茶多酚、有机酸等机型杂质[16],C18能有效除去基质中的色素、维生素等非极性物质[17],MWCNTs能有效去除色素和平面结构等干扰物质[18]。试验以空白样品中加入50 μg/kg 5种农药混标,制备6个平行样,按照1.2.1的方法制备样品,上机测定回收率,采用正交试验L9(34)确定PSA、C18及MWCNTs的最佳使用量。由正交试验结果可以看出,各组试验的回收率在60.8%~89.0%之间,丁醚脲、唑虫酰胺、氯虫苯甲酰胺中C18对其回收率的影响最大,PSA次之,MWCNTs的影响最小;甲基硫菌灵、氯噻啉中C18对其回收率的影响最大,MWCNTs次之,PSA的影响最小。丁醚脲、甲基硫菌灵、唑虫酰胺、氯虫苯甲酰胺对PSA、C18、MWCNTs的最佳用量均分别是200,200和50 mg,氯噻啉对PSA、C18、MWCNTs的最佳用量分别是200,200和100 mg,氯噻啉对MWCNTs使用量的K2、K3值比较接近,综合考虑,试验PSA、C18、MWCNTs的最佳用量均分别是200,200和50 mg。具体结果见表2和表3。
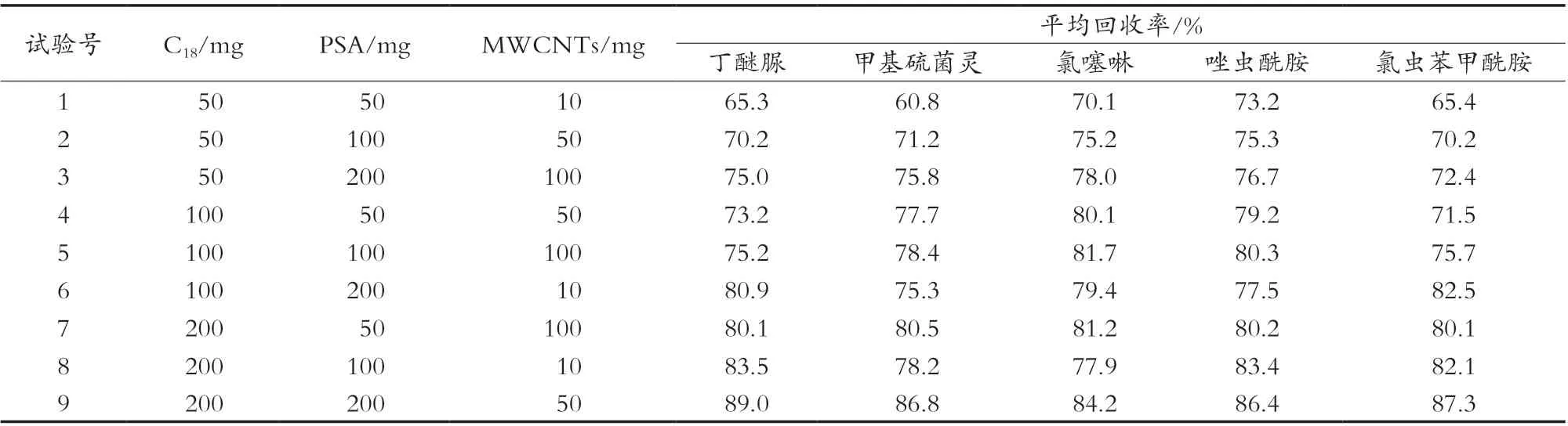
表2 正交试验设计及结果
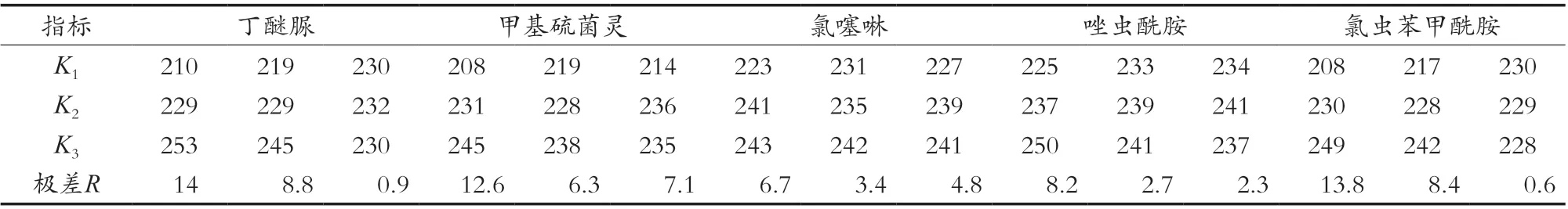
表3 正交试验结果分析
2.5 基质效应
在检测农药残留时基质效应对结果的准确性和重复性影响较大。基质效应主要是在前处理过程或样品本身引入的杂质干扰导致目标化合物的信号减弱和增强。方法采用相对响应强度的比值来评价基质效应的强弱,即ME=B/A,A表示分析物在纯溶剂的响应值,B表示分析物在空白基质中的响应强度。ME小于0.9为基质效应减弱,大于1.2为基质效应增强[19]。方法分别以空白茶叶提取液与乙腈溶剂配制50 ng/mL 5种农药混标以考察样品的基质效应,结果表明5种农药的ME值为0.613~0.825,均为基质减弱效应,因此采用基质配标消除基质效应对测定结果的影响。
2.6 方法的标准曲线、检出限和定量限
用空白茶叶基质溶液配制质量溶度为0.1,0.5,1.0,5.0,10.0,20.0和50.0 ng/mL的5种农药的混合标准工作溶液,采用外标法定量,5种农药在0.1~50 ng/mL线性关系良好,具体结果见表3。
对空白茶叶基质添加5种农药混合标准品,用空白基质提取液逐级稀释,以3倍信噪比(rSN)和10倍信噪比(rSN)分别作为方法的检出限(limit of detection,SLOD)和定量限(limit of quantification,SLOQ),具体结果见表4。
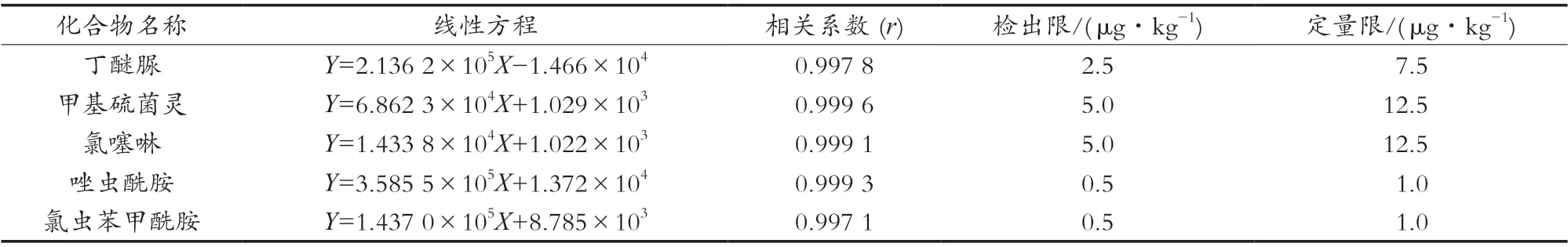
表4 5种农药的线性方程、检出限及定量限
2.7 回收率和精密度
在空白茶叶样品中添加适量的5种农药标准溶液,每个加标浓度制备6个平行样,5种农药的平均回收率为81.0%~97.6%,相对标准偏差(relative standard deviation,SRSD)在5.6%~9.9%,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》对回收率和相对标准偏差的要求,表明该方法能够满足丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺5种农药的检测,具体结果见表5。
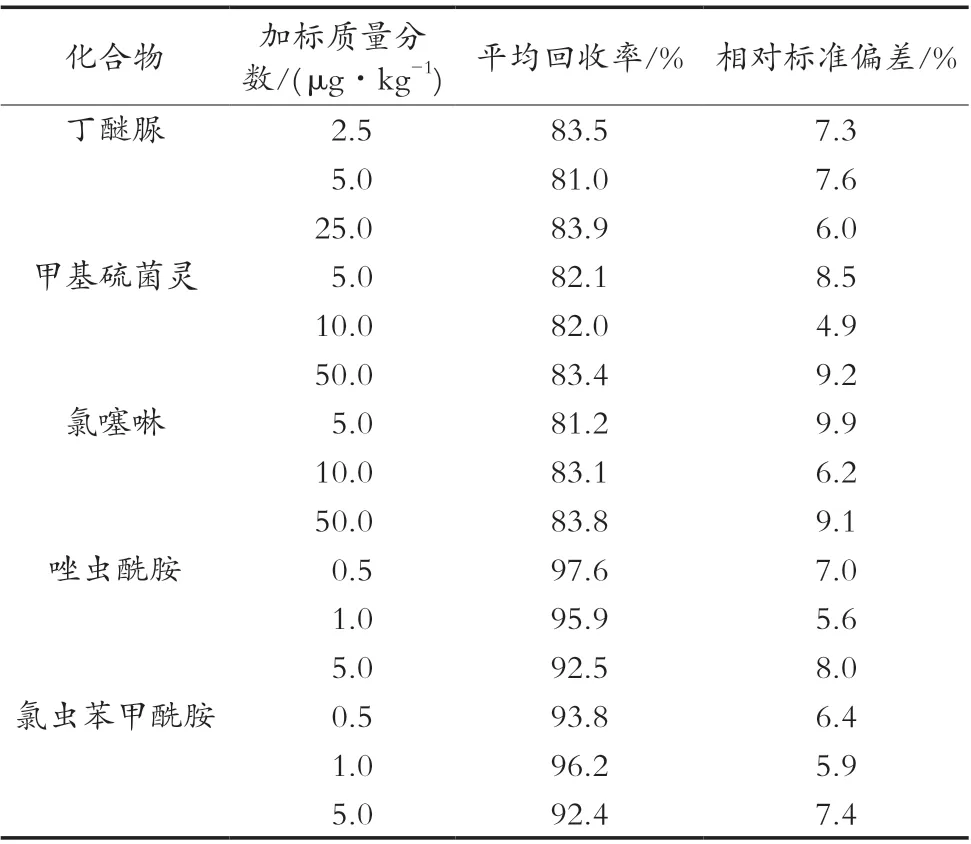
表5 5种农药的回收率和相对标准偏差
2.8 实际样品的测定
以试验建立的方法对市售151批茶叶进行检测,其中:丁醚脲检出24批次,检出率为15.9%,其值为0.001 3~2.224 9 mg/kg;甲基硫菌灵检出9批次,检出率为6.0%,其值为0.004 3~0.073 6 mg/kg;氯噻啉均未检出,检出率为0;唑虫酰胺检出127批次,检出率为84.1%,其值为0.001 2~0.670 8 mg/kg;氯虫苯甲酰胺检出27批次,检出率为17.9%,其值为0.000 8~0.028 3 mg/kg。丁醚脲、氯噻啉、唑虫酰胺检出值均在GB 2763—2021中规定的限值范围内,甲基硫菌灵、氯虫苯甲酰胺在GB 2763—2021中均未规定限量值,但均有一定程度检出,说明有部分茶农在茶叶种植过程中使用甲基硫菌灵、氯虫苯甲酰胺,因此存在着一定风险。
3 结论
试验采用多壁碳纳米管/QuEChERS净化方法与高效液相色谱-串联质谱法相结合,建立茶叶中丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺5种农药残留的检测方法。研究表明,该方法的相关系数为0.997 1~0.999 6,检出限在0.5~5 μg/kg;在茶叶空白基质中进行加标试验,平均回收率为81.0%~97.6%,SRSD为5.6%~9.9%。该方法操作简单、灵敏度高、重现性好、准确可靠,能够满足日常检测要求,可为国内食品监管部门监测茶叶中丁醚脲、甲基硫菌灵、氯噻啉、唑虫酰胺、氯虫苯甲酰胺5种农药残留提供一种可行的参考方法和理论支持。
