正交试验优化川明参多糖超临界CO2萃取工艺
2022-08-19魏瑞霖朱晨赖朋曾智康段树华陈晟
魏瑞霖,朱晨,赖朋,曾智康,段树华,陈晟
西华大学 食品与生物工程学院(成都 611730)
川明参(Chuanminshen violaceumSheh et Shan),别名明参、明沙参、土明参,是我国特有的单种属植物,为伞形科川明参属植物的干燥根,是四川道地中药材,在其主产地常被用作滋补佳品食用,具有病后补虚和强筋健骨等功效[1-4]。川明参中含有多糖、香豆素、黄酮、甾醇、蛋白质和氨基酸、有机酸、酚类等化学成分[5-10],其中多糖类化合物是川明参中最主要成分,含量在占80%以上,已有的研究表明川明参多糖具有抗突变、镇咳、祛痰、免疫调节、抗疲劳和抗氧化等功效[11-16],可作为医药和保健食品而被广泛运用,如何更加有效地萃取川明参多糖已成为愈加重要的问题。
目前常用的萃取川明参多糖的方法有热水浸提法和热回流法[17-18],但这些方法在萃取过程中具有耗能大、耗时久、萃取温度高从而降低多糖活性等缺点。而超临界CO2萃取具有污染低、能耗低、耗时短、得率高、萃取温度不高、不容易引起多糖物质的变性等优点[19-21],近几年超临界CO2萃取也被广泛地运用到植物活性物质的萃取之中,但对于川明参多糖物质的萃取还未见有其报道。
试验采用超临界CO2萃取法进行川明参多糖物质的萃取,并采用苯酚-硫酸法[22]测定其多糖含量,详细地研究了超临界CO2萃取法萃取川明参多糖的工艺条件,为川明参多糖的开发利用提供了参考依据。
1 材料与方法
1.1 试验材料与仪器
新鲜川明参2021年由四川参巴中市购买所得,由西华大学张良副教授鉴定为伞形科川明参属植物川明参Chuanminshen viloaceumSheh et Shen.的干燥根。葡萄糖、无水乙醇、浓硫酸、苯酚、石油醚(分析纯,成都市科龙化工试剂厂)。
ZN-200A高速中药粉碎机(长沙市岳麓区中南制药机械厂);TB-214型分析天平[赛多利斯科学仪器(北京)有限公司];HH-S4数显恒温水浴锅(金坛市医疗仪器厂);SpectraMax i3x多功能酶标仪[美谷分子仪器(上海)有限公司];Nicolet iS10近红外光谱仪(上海斯迈欧分析仪器有限公司);HA100-50-0.5型超临界萃取装置(江苏华安科研仪器有限公司);DHG-9035A恒温鼓风干燥箱(上海一恒科学仪器);YR-PTB真空泵(上海亚荣生化仪器厂);RE-52AA旋转蒸发器(上海亚荣生化仪器厂)。
1.2 试验方法
1.2.1 川明参多糖超临界CO2萃取醇沉工艺流程
新鲜川明参→干燥→粉碎→过筛→脱脂、脱色、除小分子糖→超临界CO2萃取→旋转蒸发有机溶剂→离心→醇沉→干燥→粗多糖
1.2.2 样品预处理
将新鲜川明参清洗掉表面泥土等污垢后,置于恒温鼓风干燥箱中,于40 ℃干燥至恒重,随后运用中药粉碎器对其进行粉碎,过0.425 mm筛,除去蛋白质及小分子物质后干燥,密封于4 ℃冰箱中保存。
1.2.3 川明参多糖含量的测定
采用苯酚-硫酸法测定川明参中粗多糖含量。
1.2.3.1 标准曲线的绘制
精密称取50.0 mg于105 ℃干燥至恒重的葡萄糖对照品于50 mL容量瓶中,用蒸馏水溶解并定容至50 mL,配制成质量浓度为1.0 mg/mL的葡萄糖标准储备液,密封,于4 ℃冰箱中保存,备用。分别精密移取2,4,6,8,10和12 mL葡萄糖标准储备液于100 mL容量瓶中定容摇匀,配制成质量浓度分别为0.02,0.04,0.06,0.08,0.10和0.12 mg/mL的葡萄糖标准溶液。分别吸取2 mL标准溶液于10 mL具塞试管中,迅速加入1.0 mL 5%苯酚溶液,摇匀,再小心加入5.0 mL浓硫酸,摇匀。室温下静置5 min,再水浴加热15 min,水浴温度为90 ℃。取出冷却至室温,用酶标仪在490 nm波长处测定吸光度,测量时以蒸馏水作为空白对照。以葡萄糖质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线[23]。
1.2.3.2 供试品溶液的制备
采用水提醇沉法制备粗多糖,醇沉方法参考张梅等[17],并有所改动。称取一定量预先处理的川明参粉末加入萃取罐中,运用夹带剂罐将一定浓度、料液比的无水乙醇送入萃取罐,在一定萃取压力、萃取时间、萃取温度条件下进行萃取,萃取完毕后取出,迅速采用旋转蒸发仪器将其中有机溶剂蒸出,干燥后加无水乙醇至体积分数为90%沉淀多糖,放置过夜,离心,沉淀部分用蒸馏水溶解,稀释一定倍数得川明参多糖待测液。
1.2.3.3 多糖萃取率计算
川明参多糖萃取率按式(1)计算。

式中:Y为川明参多糖萃取率,%;c为样品测定液中葡萄糖的质量浓度,mg/mL;f为稀释倍数;m为试验所取的川明参粉末质量,g。
1.2.4 夹带剂单因素试验
准确称取适量预先处理的川明参粉末,选取不同浓度夹带剂(90%乙醇,70%乙醇,50%乙醇和30%乙醇)和料液比[1∶1,1∶2,1∶3和1∶4(g/mL)],进行单因素试验,分别考察不同条件夹带剂对超临界CO2萃取川明参多糖萃取率的影响。结果显示,初始的单因素条件分别为萃取夹带剂浓度70%乙醇,料液比1∶3(g/mL)。
1.2.5 萃取单因素试验
在上述夹带剂单因素试验结果下进行以下试验。
1.2.5.1 萃取温度
固定萃取时间1.5 h、萃取压力20 MPa,考察不同萃取温度(35,40,45和50 ℃)对川明参多糖萃取率的影响。
1.2.5.2 萃取时间
固定萃取温度40 ℃、萃取压力20 MPa,考察不同萃取时间(1,1.5,2和2.5 h)对川明参多糖萃取率的影响。
1.2.5.3 萃取压力
固定萃取温度40 ℃、萃取时间1.5 h,考察不同萃取压力(15,20,25和30 MPa)对川明参多糖萃取率的影响。
1.2.6 川明参多糖超临界CO2萃取的正交试验设计
在前面单因素试验的基础上,采用三因素三水平,按L9(33)正交设计进行川明参多糖超临界CO2萃取正交试验,各因素及水平设计如表1所示,每组试验重复3次。

表1 正交试验因素与水平
1.2.7 超临界CO2萃取次数对多糖萃取率的影响
对通过正交试验所得最佳萃取工艺进行萃取次数的试验,考察不同次数(1,2,3和4次)对川明参多糖萃取率的影响。
1.2.8 川明参多糖超临界CO2萃取与传统萃取法的比较
分别对超临界CO2萃取法、传统热浸提法进行川明参多糖的萃取率的测定,比较二者的优劣。
1.2.9 数据分析
每组单因素试验平行进行3次,取平均值,数据利用Origin 8.0进行绘图;使用SPSS 24.0数据分析软件对正交试验结果进行分析处理。
2 结果与分析
2.1 标准曲线的绘制
以葡萄糖浓度为横坐标,相应的吸光度为纵坐标进行线性回归,得到回归方程y=9.048 57x+0.156 6,R2=0.998 13。试验结果表明,葡萄糖质量浓度在0.02~0.12 mg/mL之间与吸光度呈现良好的线性关系。

图1 葡萄糖标准曲线
2.2 夹带剂单因素试验结果
2.2.1 夹带剂对川明参多糖萃取率的影响
表2显示了在不同夹带剂浓度的使用下,川明参多糖萃取率的变化情况。图2反映了不同夹带剂浓度对川明参多糖萃取率的影响趋势。可见,在夹带剂为90%乙醇时达到最佳多糖萃取率。夹带剂的加入能够与CO2流体相容,大大地提高川明参多糖在CO2流体中的溶解度,因而增加其多糖萃取率,因此,选择夹带剂90%乙醇进行后续试验考察。

表2 夹带剂对川明参多糖萃取率的影响
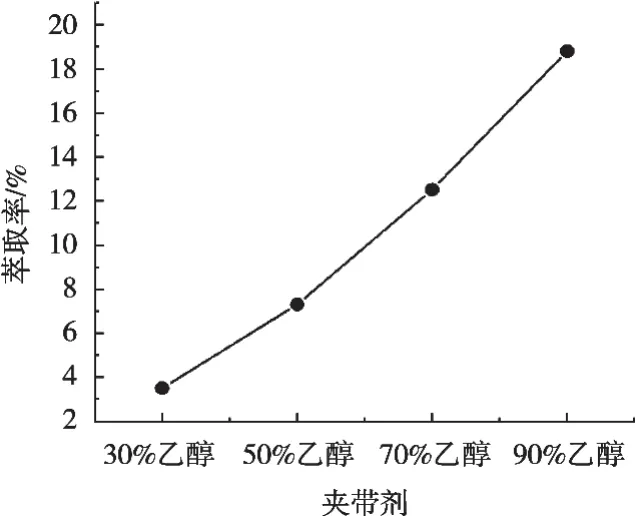
图2 夹带剂浓度对川明参多糖萃取率的影响
2.2.2 夹带剂料液比对川明参多糖萃取率的影响
表3显示了在不同料液比下,川明参多糖萃取率的变化情况。图3显示了料液比对多糖萃取率的影响趋势。根据图3的走势情况可以看到,随着料液比变化至1∶3(g/mL),多糖萃取率液呈线性增长,但随后多糖萃取率呈下降趋势,这可能是因为过大的液体比反而使得萃取不完全,导致多糖萃取率的降低,因此在料液比1∶3(g/mL)的条件下可取得最大多糖萃取率,所以在接下来单因素试验中选择夹带剂90%乙醇、料液比1∶3(g/mL)进行试验。

表3 料液比对川明参多糖萃取率的影响
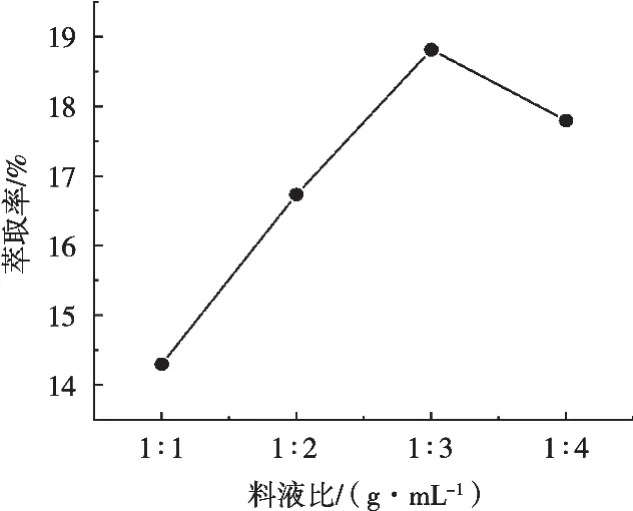
图3 料液比对川明参多糖萃取率的影响
2.3 萃取单因素试验
根据2.2小节所得结果,在夹带剂90%乙醇、料液比1∶3(g/mL)的条件下进行如下试验。
2.3.1 萃取温度对川明参多糖萃取率的影响
表4显示了在不同萃取温度下,川明参多糖萃取率的变化情况。通过图4走势可以得到,随着萃取温度的升高,川明参多糖萃取率明显增加,在萃取温度为50 ℃时达到最大值,此时得率为21.6%。在一定温度范围内,多糖溶质分子溶出速度随着温度升高而加快,萃取率上升。当萃取温度超过45 ℃后,川明参多糖萃取率虽然仍在增加,但增加曲线斜率开始下降,这可能是温度过高导致部分多糖发生降解。因此,选择萃取温度40,45和50 ℃进行后续正交试验考察。

表4 萃取温度对川明参多糖萃取率的影响

图4 萃取温度对多糖萃取率的影响
2.3.2 萃取时间对川明参多糖萃取率的影响
表5显示了在不同萃取时间下,川明参多糖萃取率的变化情况。通过图5走势可以得到,随着萃取时间的增加,川明参多糖萃取率明显增加,在萃取时间为2 h时达到最大值,此时得率为19.98%。浸提时间超过2 h之后,多糖萃取率有所下降。这可能是因为:多糖溶解需要一定的时间才能达到平衡,在达到平衡前,随着时间的增加,多糖溶解更多,萃取率也随之增大;但在达到平衡后,多糖的溶出量基本稳定[23],萃取率增加幅度变小,浸提时间再延长甚至可能导致多糖不稳定而发生降解,进而导致萃取率下降。因此,选择萃取时间1.5,2和2.5 h进行后续正交试验考察。
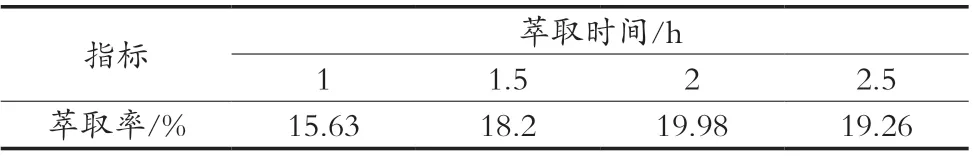
表5 萃取时间对川明参多糖萃取率的影响

图5 萃取时间对川明参多糖萃取率的影响
2.3.3 萃取压力对川明参多糖萃取率的影响
表6显示了在不同萃取压力下,川明参多糖萃取率的变化情况。通过图6走势可以得到,在一定压力范围内,随着萃取压力的升高,超临界CO2流体密度增大,溶解能力增强,从而提高了川明参多糖萃取率,不过当压力增大到一定的程度后,超临界CO2流体接近于液态流体,其密度不再随压力变化[24],对川明参多糖萃取率影响也变小,故在压力达到30 MPa时,川明参多糖萃取率反而开始下降。另外,考虑到设备操作、生产成本和安全问题,一般也不宜将压力设置得太高。所以将试验的较适宜萃取压力定为25 MPa。因此,选择萃取压力15,20和25 MPa进行后续正交试验考察。
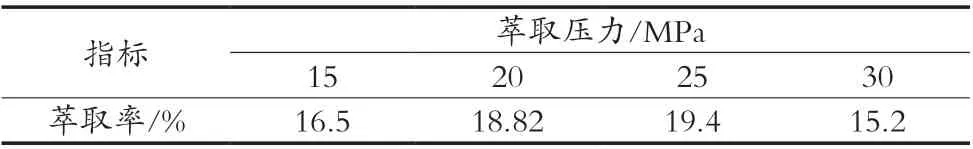
表6 萃取压力对川明参多糖萃取率的影响
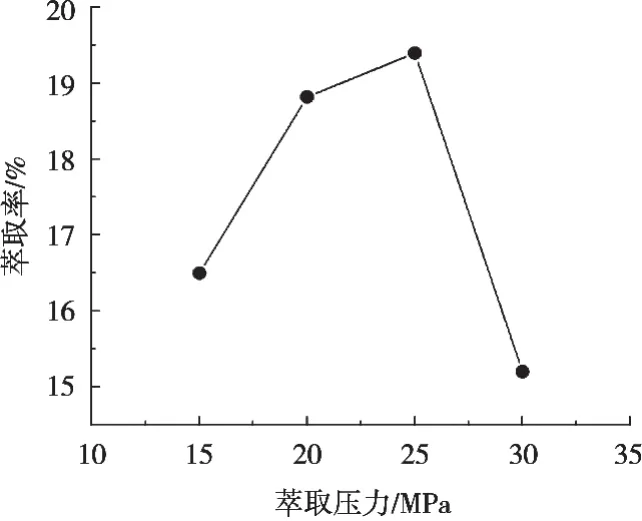
图6 萃取压力对川明参多糖萃取率的影响
2.4 正交试验结果
正交优化试验结果如表7所示。由结果可知,所考察的3个因素中各因素对多糖萃取率的影响顺序是A>C>B,即萃取温度>萃取压力>萃取时间,其水平优劣次序分别为A3>A2>A1,B2>B3>B1,C3>C2>C1。对正交试验结果进行方差分析,其结果见表8。从方差分析结果可以看出,A因素即萃取温度对川明参多糖萃取率具有极显著影响(P<0.01),C因素即萃取压力对川明参粗多糖萃取率具有显著影响(P<0.05),因素B萃取时间对川明参粗多糖萃取率影响不显著。因此直观分析结合方差分析结果确定,川明参多糖最佳萃取工艺条件为A3B2C3,即萃取温度50℃,萃取时间2 h,萃取压力25 MPa。
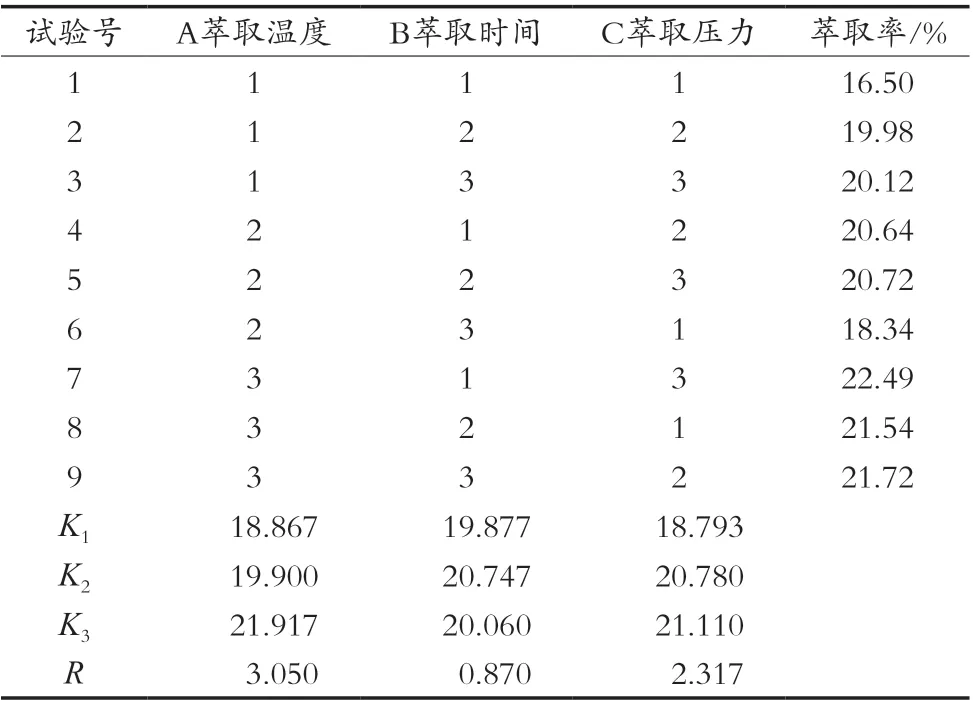
表7 正交试验结果
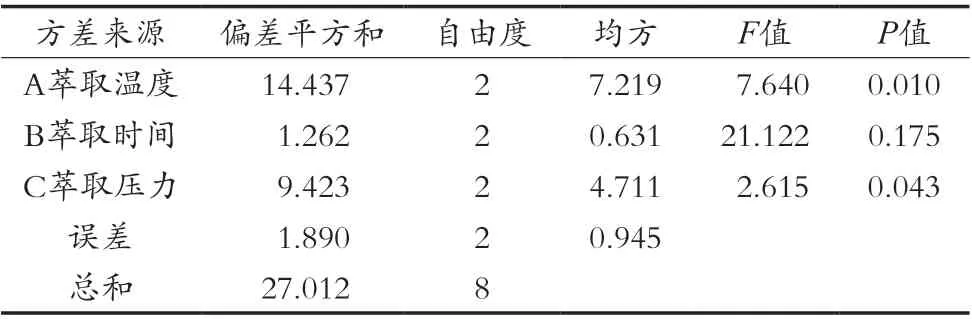
表8 方差分析结果
根据上述优化萃取条件,在最佳因素组合A3B2C3(萃取温度50 ℃,萃取时间2 h,萃取压力25 MPa)条件下进行3组平行试验,川明参粗多糖萃取率结果见表9。

表9 在A3B2C3试验条件下的多糖萃取结果
由表9验证试验结果可知,川明参多糖最佳萃取工艺条件为A3B2C3,即萃取温度50 ℃,萃取时间2 h,萃取压力25 MPa,此时川明参多糖最佳萃取率为23.81%。
2.5 超临界CO2法萃取次数对川明参多糖萃取率的影响
如图7所示,超临界CO2萃取次数达到2次时已达到基本完全萃取,考虑到经济以及时间成本,故将2次萃取定为川明参多糖最佳萃取次数。

图7 萃取次数对川明参多糖萃取率的影响
2.6 超临界CO2法与常规传统热浸提法的比较
传统热浸提法:称取一定量预处理完毕后的川明参粉末,放入烧杯中并加入1∶35(g/mL)料液比的蒸馏水,搅拌均匀后浸泡30 min后放入100 ℃水浴锅中浸提8.00 h,萃取2次,测定其川明参多糖的萃取率。将传统热浸提法结果与超临界CO2法结果相比较,结果见表10。
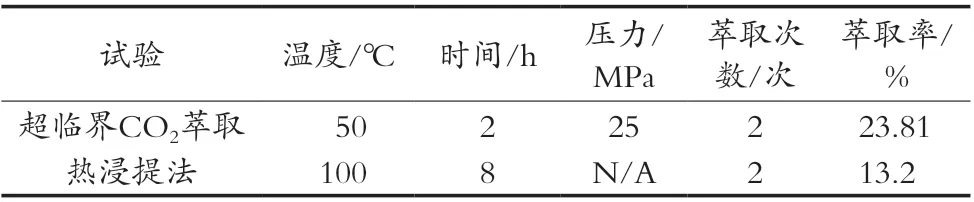
表10 超临界CO2萃取与传统热浸提结果
3 结论
试验通过单因素试验和正交试验,首次将超临界CO2萃取运用于川明参粗多糖的萃取试验,主要得到以下结论:
1) 设计超临界CO2萃取夹带剂选择试验,得到运用夹带剂90%乙醇,料液比1∶3(g/mL)的乙醇溶液作为萃取夹带剂可得到最佳川明参粗多糖萃取率。
2) 运用SPSS软件对试验数据进行多元线性回归分析,结果显示,在选定的水平范围内所考察的3个因素对川明参粗多糖萃取率的影响分别为萃取温度>萃取压力>萃取时间。通过正交试验结果表明最佳萃取工艺为萃取温度50 ℃,萃取时间2 h,萃取压力25 MPa,其中萃取温度对川明参粗多糖萃取率具有极显著影响(P<0.01),萃取压力对川明参粗多糖萃取率具有显著影响(P<0.05)。
3) 研究得到的萃取工艺与传统水提工艺相比,克服了后者由于高温从而容易破坏多糖分子活性、萃取时间过长等缺点,并且由于萃取系统采用CO2气体,使得对环境的污染降低,且更加节能。通过验证试验加以检验,按最优萃取工艺萃取2次的粗多糖得率为23.81%,从而证明通过研究得到的萃取工艺是稳定、可靠的。
