弱絮凝性下面啤酒酵母菌株的选育
2022-08-18刘小航阮玉磊宿萌付晓芬贺秀丽郭立芸武晓乐郭学武肖冬光陈叶福
刘小航,阮玉磊,宿萌,付晓芬,贺秀丽,郭立芸,武晓乐,2,郭学武,2,肖冬光,2,陈叶福,2*
1(天津科技大学 生物工程学院,天津,300457)2(工业发酵微生物教育部重点实验室(天津科技大学),天津,300457) 3(北京燕京啤酒股份有限公司技术中心,啤酒酿造技术北京市重点实验室,北京,101300)
在啤酒工业中,啤酒酵母菌株的絮凝能力是评价啤酒酵母菌株优劣的一个重要指标[1]。在啤酒主发酵结束前,强絮凝性酵母对酵母泥分离回用有利,但若酵母提前絮凝,则会引起发酵迟缓或停滞,最终嫩啤酒含糖量高,风味不理想。此外,絮凝太完全也会降低嫩啤酒中的酵母数,影响二次发酵等后熟进程[2-5]。选育弱絮凝性啤酒酵母菌株可达到延长酵母增殖稳定期,降低啤酒中乙醛含量,提升风味质量等目的。
研究显示,涉及到啤酒絮凝性相关研究多为强絮凝性酵母菌株选育,弱絮凝性啤酒酵母育种实例较少。张建早等[6]先通过甲基磺酸乙酯诱变后利用连续培养方法对酵母进行驯化,得到了1株突变株S16,其絮凝能力比出发菌株提高了2.21倍。随着絮凝相关遗传机制不断清晰,基因工程和代谢工程手段不断丰富,通过分子操作可有效调控酵母的絮凝特性[7-8],如通过不同启动子控制絮凝基因的表达,可成功对絮凝时机和强度进行控制[9]。但当前由于消费者和行业本身负面态度,通过基因工程手段育种在食品行业仍难以被接受[10]。目前酵母育种途径多样,相比于传统物理化学诱变选育等方法,常压室温等离子体诱变(atmospheric and room temperature plasma,ARTP)以操作简便、安全性高等优势在微生物遗传与育种领域上备受青睐[11-12]。WANG等[13]以KF-7为出发株,通过ARTP结合基因组改造和杂交策略,获得1株耐多种胁迫的絮凝工业酿酒酵母菌株E-158。冯鹏鹏等[14]以工业酵母680bg为出发株进行ARTP诱变,获得诱变菌株ARTP-162,其高级醇产量比出发株降低了约21%,且其他基本发酵性能无太大变化。
本研究以下面啤酒酵母L-1为出发菌株,对其进行ARTP诱变,并结合优化后的絮凝能力检测方法对诱变菌株进行初筛与二轮复筛,以期筛选出絮凝能力减弱且其他发酵性能较优、遗传性能较稳定的菌株,为后续工业啤酒酵母的选育和投入到工业啤酒的生产应用奠定研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂
啤酒酵母菌株L-1,由北京燕京啤酒股份有限公司提供。
冰乙酸,天津化学试剂一厂;醋酸钠,天津大茂化学试剂厂;次甲基蓝,天津百世化工有限公司;CaSO4,天津市风船化学试剂科技有限公司;水合茚三酮、乙醛标准品,上海阿拉丁生化科技股份有限公司;麦芽糖标准品、麦芽三糖标准品,大连美仑生物技术有限公司。
1.1.2 培养基
麦芽汁培养基:14°P 麦芽汁,由北京燕京啤酒股份有限公司提供;CaSO4缓冲液:将6.80 g醋酸钠、0.51 g CaSO4、4.05 g冰乙酸溶于1 L蒸馏水中,调节pH至4.5。
1.1.3 仪器与设备
ARTP-Ⅱ型诱变仪,北京思清源生物科技有限公司;ZXJD-A1270生化培养箱,上海智城分析仪器制造有限公司;Agilent 7890C气相色谱仪、Agilent 1100 液相色谱仪,美国安捷伦公司;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;BX43 型光学显微镜,日本奥林巴斯公司。
1.2 实验方法
1.2.1 ARTP诱变
将L-1菌株培养至对数前中期并对其进行诱变,诱变过程及仪器参数参考文献[14]。
1.2.2 啤酒发酵实验
1.2.2.1 种子液扩培
一级种子液:取1环酵母菌株,接种于含5 mL 14°P麦汁的试管中,25 ℃静置培养12 h。二级种子液:将一级种子液接种至含45 mL 14°P麦汁的250 mL三角瓶中,25 ℃静置培养24 h。三级种子液:将二级种子液接种至含250 mL 14°P麦汁的500 mL三角瓶中,25 ℃静置培养24 h。
1.2.2.2 啤酒发酵
初筛:将二级种子液离心后按1.6×107CFU/mL 的接种量接种至含70 mL 14°P麦汁的大试管中(规格为:30 mm×200 mm),10 ℃静置培养4 d。第一轮复筛:发酵体系与接种量同于初筛,培养时间由4 d增至7 d,每个样品3个平行。第二轮复筛:将三级种子液离心后并用无菌水洗涤1次获得菌泥,按1.6×107CFU/mL的接种量接种至含有900 mL 14°P麦汁的1 L量筒,10 ℃静置培养,每个样品3个平行。
1.2.3 絮凝能力的检测
将ASBC(American Society of Brewing Chemists)吸光度法[15]进行优化后对酵母菌株的絮凝能力进行检测。将发酵液混匀,分别取相同菌浓度(OD600值为6.5~7)发酵液于15 mL离心管,记为A、B;A管离心取沉淀,分别移取9 mL 蒸馏水和1 mL 250 mmol/L EDTA(pH=4.5),使菌泥悬浮且振荡混匀,取1 mL悬液稀释10倍,测OD600并将该值记为ODA;B管离心取沉淀,先加10 mL 0.051%CaSO4溶液悬洗菌泥后并离心取沉淀,之后再加CaSO4缓冲液洗涤,涡旋振荡器上振荡15 s后离心管竖直放置6 min。取1 mL顶部液体稀释3倍,测OD600并将该值记为ODB。絮凝值F按公式(1)计算:
(1)
式中:F,酵母菌株的絮凝能力,%;ODA,对A管处理后所测得的OD600值;ODB,对B管处理后所测得的OD600值
1.2.4 啤酒酵母死亡率的测定
使用次甲基蓝染色法[16]测定酵母细胞死亡率。
1.2.5 α-氨基氮含量的测定
根据茚三酮显色法[17]对发酵液中游离的α-氨基氮进行测定。
1.2.6 糖类含量的测定
使用液相色谱法测定发酵液中主要糖类含量[18]。
1.2.7 真正发酵度和酒精度的测定
根据GB/T 4928—2008《啤酒分析方法》测定。
1.2.8 风味物质含量的测定
使用气相色谱仪对蒸馏后的发酵液中风味物质进行测定。
气相色谱条件:色谱柱Agilent CP-WAX(50 m×250 μm×0.25 μm),载气为高纯氮气(>99.999%);柱流速1 mL/min;进样口温度250 ℃;检测器温度148.8 ℃;程序升温:起始温度35 ℃,保持1 min,以3 ℃/min 升至70 ℃,保持15 min, 再以3.5 ℃/min 升至190 ℃,保持22 min;进样体积1 μL;分流进样,分流比30∶1。
1.2.9 诱变菌株的遗传稳定性实验
将诱变菌株于麦芽汁斜面培养基中连续15次传代培养,挑取第1、5、15代菌株,通过1 L量筒发酵检测其絮凝能力及其他各项性能的稳定性。
2 结果与分析
2.1 ARTP 诱变条件的确定
将出发株L-1培养至对数成长前中期,对其进行ARTP诱变并绘制致死曲线,结果如图1所示。随着诱变时长的增加,酵母细胞的致死率也随之提高:诱变时间为40 s时,酵母细胞的致死率为90.9%,诱变时间为55 s时,酵母细胞的致死率为100%,因此选定40 s作为诱变的处理时间。

图1 ARTP诱变L-1的致死率曲线Fig.1 Lethal curve of L-1 induced by ARTP
2.2 诱变菌株的筛选
2.2.1 弱絮凝性菌株的初筛
将出发株L-1进行ARTP诱变40 s后稀释涂布于平板中(确保每个平板所长出来单菌落个数约为100个)。为获得生长性能良好的诱变株,从平板上共近4 000个单菌落中挑选出630个形态较大且边缘较为光滑的单菌落。此后将630株诱变株同出发株L-1分成15批次,置于大试管培养4 d后,对其絮凝能力进行检测,所得絮凝值频数分布结果如图2所示。相比于L-1絮凝能力而言,有413株诱变株的絮凝能力未得到大幅度改变(增幅或降幅小于10%),而所获弱絮凝性诱变株个数较少,其中诱变株絮凝能力降幅大于5%的有82株,因此选择此82株诱变株进入到后续的复筛过程中。

图2 初筛菌株的絮凝值频数分布图Fig.2 Frequency distribution diagram of flocculation value of primary screening strains注:絮凝值比值=诱变株絮凝值/出发株L-1絮凝值
2.2.2 诱变菌株的第一轮复筛
因获得的诱变菌株较多,且在初筛时未做平行,故将82株弱絮凝性初筛菌株进行第一轮复筛,同时增测死亡率这一指标。值得说明的是,在初筛中,培养4 d后各发酵液中CO2的累计排放量少,说明此时发酵液中仍有较多可发酵性糖未被消耗,基于此现象结合已有的文献报道[19],猜测这也许会导致初筛中絮凝能力指标的测定误差较大。为此,在第一轮复筛中,将培养时间增至为7 d。
2.2.2.1 絮凝能力的测定
第一轮复筛实验所测絮凝能力结果如图3所示,同样的,选择絮凝能力降幅大于5%的诱变菌株进入到第二轮次复筛中,在第一轮复筛中,获得了50株弱絮凝性第一轮复筛株。除菌株73外,大部分菌株絮凝能力相比于L-1降低了约6%~10%。

图3 诱变菌株絮凝能力的第一轮复筛结果Fig.3 Flocculation ability of mutagenic strains in first re-screening
2.2.2.2 死亡率的测定
发酵结束时,将50株弱絮凝性第一轮复筛株酵母泥进行收集并测定其死亡率,结果如图4所示。在大试管体系发酵中,大部分弱絮凝性第一轮复筛株的死亡率低于L-1,同时由于死亡率较高的菌株310在前阶段发酵实验中均表现出较好的发酵性能,考虑到实验的误差较大,为此选取死亡率降幅较大的35株弱絮凝性第一轮复筛株和菌株310,进行第二轮量筒复筛。
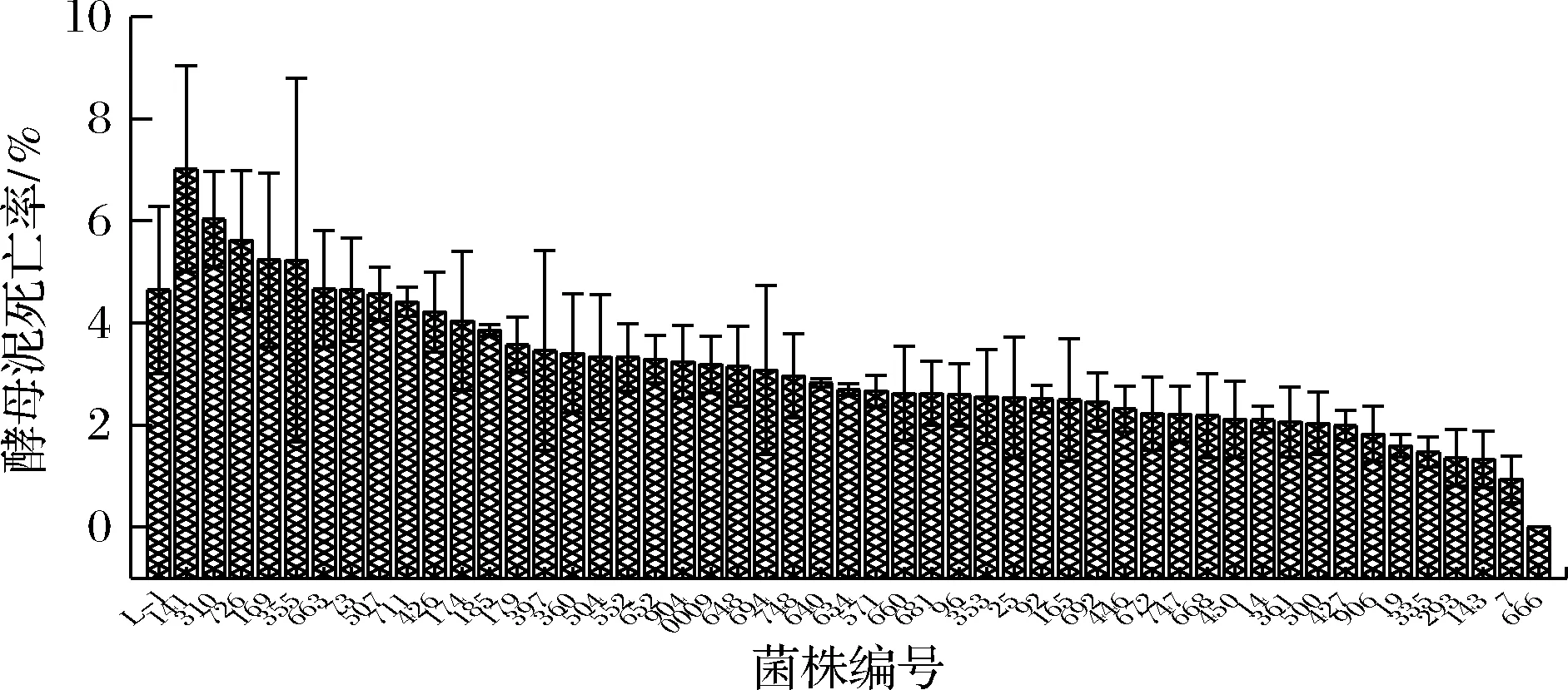
图4 诱变菌株死亡率的第一轮复筛结果Fig.4 Mortality of mutagenic strains after first re-screening
2.2.3 诱变菌株的第二轮复筛
对获得的36株弱絮凝性第一轮复筛株进行第二轮复筛,并在主酵结束时对酵母泥的絮凝能力、死亡率、发酵液中α-氨基氮、主要糖类及风味物质的含量等指标进行检测。由于菌株数目较多及发酵体系的扩大,采用三批次独立的实验来完成第二轮复筛。在三批次独立的实验中,由于第一批次发酵时长为9 d,考虑到发酵时间较长,在不改变絮凝能力等指标有效检测时机条件下,将第二、三批二轮复筛主酵时长调为7 d。
2.2.3.1 絮凝能力的测定
在量筒发酵主酵结束时,对各菌株进行絮凝能力的检测,各批次絮凝能力误差较小,所得结果如图5所示。在第二轮复筛中,36株第二轮复筛株的絮凝能力相比于L-1降低了2%~8%。

图5 诱变菌株絮凝能力的第二轮复筛结果Fig.5 Flocculation ability of mutagenic strains in second re-screening
2.2.3.2 死亡率的测定
在量筒发酵主酵结束时,将36株弱絮凝性第二轮复筛株酵母泥进行收集并测定其死亡率,结果如图6所示。L-1的死亡率为2.45%,相比于出发株,除了菌株310的死亡率(4.41%)有了较大幅度的提升以外,其余各诱变菌株的死亡率均有了不同程度的降低。
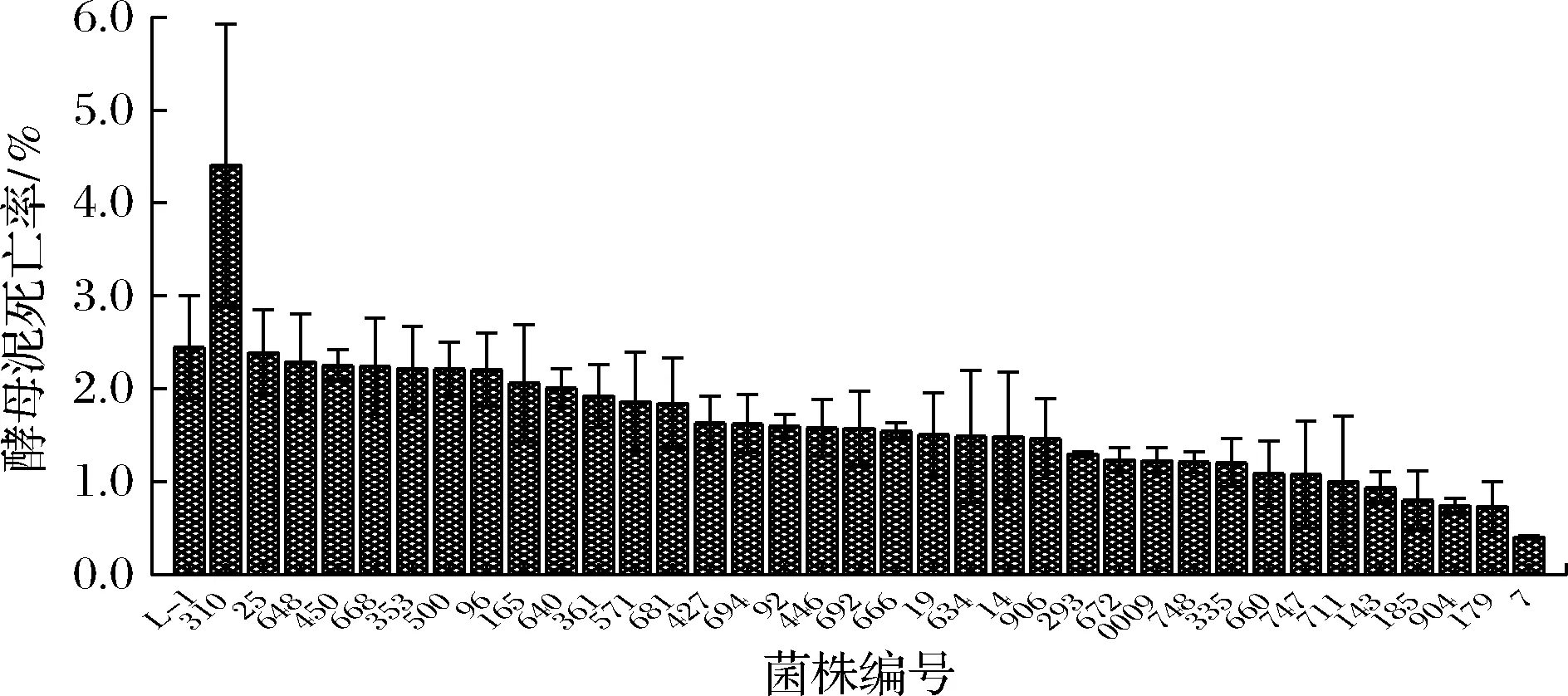
图6 诱变菌株死亡率的第二轮复筛结果Fig.6 Mortality of mutagenic strain after second re-screening
2.2.3.3 α-氨基氮含量的测定
发酵液游离的α-氨基氮是影响啤酒中高级醇含量与啤酒质量的关键因素之一,因此,啤酒酵母消耗α-氨基氮能力也是评价优质酵母的重要指标之一,为此通过测定主酵结束时发酵液中游离的α-氨基氮含量来判断各菌株消耗α-氨基氮的能力。
在第二轮复筛时,对发酵液中α-氨基氮含量差异较大。在第一批主酵9 d时(图7-a),L-1发酵液中α-氨基氮含量为57.87 mg/L,菌株310发酵液中α-氨基氮含量为43.28 mg/L,相比于L-1降低了25.21%,说明菌株310消耗α-氨基氮的能力强于L-1。相比于第一批实验,第二、三批主酵7 d时发酵液中的α-氨基氮含量均有了较大幅度的提升。在第二批二轮复筛中(图7-b),L-1发酵液中α-氨基氮含量为89.27 mg/L,菌株179发酵液中α-氨基氮含量为68.28 mg/L,相比于L-1降低了23.51%,说明菌株179消耗α-氨基氮的能力强于L-1。在第三批二轮复筛中(图7-c),L-1发酵液中α-氨基氮含量为88.2 mg/L,菌株450发酵液中α-氨基氮含量为121.3 mg/L,相比于L-1提高了37.53%,说明除菌株450外,其他各诱变株消耗α-氨基氮的能力均不弱于L-1。

a-第一批;b-第二批;c-第三批图7 第二轮复筛α-氨基氮含量测定结果Fig.7 Determination results of α-amino nitrogen content in the second re-screening.
2.2.3.4 主要糖类含量的测定
啤酒酵母消耗碳源能力是评价优质酵母的重要指标之一。理论上在相同时间内,消耗碳源能力越强的酵母,会产生更多乙醇。为此通过测定主酵结束时发酵液中主要糖类的含量来判断各菌株消耗碳源的能力。
在第二轮复筛时,对发酵液中主要糖类的含量如图8所示,同时由于在主酵7和9 d时,发酵液中的果糖及葡萄糖几乎消耗完全,故未呈现。在第一批主酵9 d时,L-1发酵液中麦芽糖与麦芽三糖含量分别为10.89、11.09 g/L,低于各诱变株。菌株经诱变后,碳源消耗能力不强于出发菌株L-1。在第二批主酵7 d时,L-1发酵液中麦芽糖与麦芽三糖含量分别为21.79、13.36 g/L,菌株179发酵液中的麦芽糖与麦芽三糖含量分别为19.52、10.95 g/L,由此可知菌株179消耗碳源的能力稍强于L-1。在第三批主酵7 d时,L-1发酵液中麦芽糖与麦芽三糖含量分别为26.66、14.35 g/L,菌株361发酵液中的麦芽糖与麦芽三糖含量分别为20.74、12.98 g/L,293的发酵液中麦芽糖与麦芽三糖含量分别为18.68、12.42 g/L,由此可知菌株293与361消耗碳源的能力稍强于L-1。

a-第一批;b-第二批;c-第三批图8 第二轮复筛麦芽糖与麦芽三糖含量测定结果Fig.8 Content of maltose and maltotriose in the second re-screening
2.2.3.5 真正发酵度与酒精度的测定
主酵结束后测定了L-1及各诱变株的酒精度和真正发酵度,结果见表1~表3。
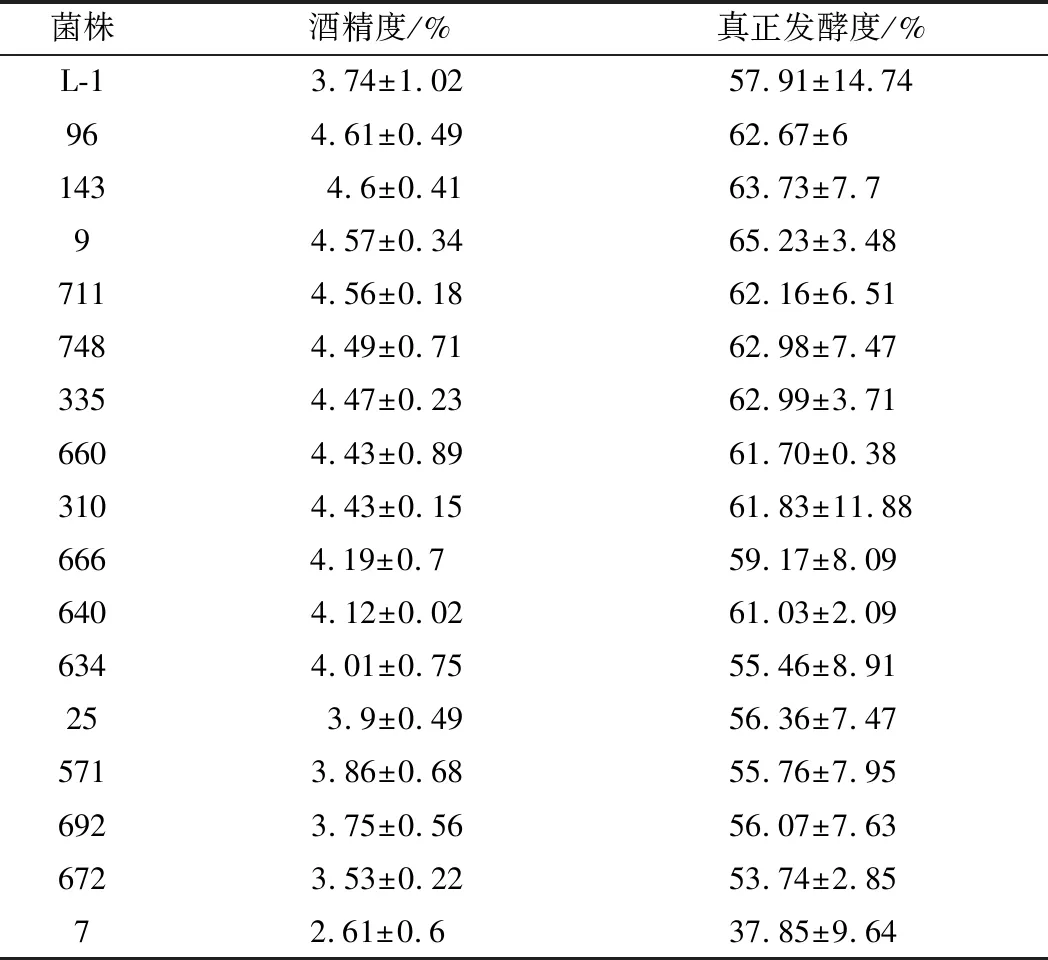
表1 第一批二轮复筛酒精度与真正发酵度测定结果Table 1 Alcohol content and true fermentation degree of the first batch of second re-screening
由表1可知,在第一批主酵9 d时,L-1酒精度为3.74%,真正发酵度为57.91%,以L-1为对照,除菌株25、571、692、672、7外,其余各诱变株的此两项指标均有不同程度的提升,其中菌株7的基本发酵性能明显弱于出发株L-1。
由表2可知,在第二批主酵7 d时,L-1酒精度为2.82%,真正发酵度为47.14%,以L-1为对照,菌株353、446、179、906此两项指标均有不同程度的提升。

表2 第二批二轮复筛酒精度与真正发酵度测定结果Table 2 Alcohol content and true fermentation degree of the second batch of second re-screening
由表3可知,在第三批主酵7 d时,L-1酒精度为2.78%,真正发酵度为40.85%,以L-1为对照,除菌株450外,其余各诱变株的此两项指标均有不同程度的提升。

表3 第三批二轮复筛酒精度与真正发酵度Table 3 Alcohol content and true fermentation degree of the third batch of second re-screening
2.2.3.6 风味物质含量的测定
啤酒主酵结束后,检测了各诱变株及L-1发酵液中主要的风味物质。由表4可知,在第一批主酵7 d时,以L-1为对照,除菌株672与692外其余各突变株发酵液中的乙醛含量有了不小程度的提升,各主要高级醇含量变化差异不明显。

表4 第一批二轮复筛各菌株主要风味物质 单位:mg/L
由表5可知,在第二批主酵7 d时,菌株179发酵液中的乙醛与异戊醇等物质含量均低于L-1。

表5 第二批二轮复筛各菌株主要风味物质 单位:mg/L
由表6可知,在第三批主酵7 d时,菌株293、361发酵液中的乙醛含量明显低于L-1,而主要高级醇含量无明显变化。

表6 第三批二轮复筛各菌株主要风味物质 单位:mg/L
2.3 目的菌株遗传稳定性实验
在前阶段初筛与二轮复筛实验中,基于诱变菌株的絮凝能力、死亡率、消耗碳源与α-氨基氮能力、基本发酵能力以及对应的发酵液中风味物质的含量等一系列指标,挑选出了3株性能优良的目的菌株进行遗传稳定性分析。如表7所示,随着传代次数的增加,目的菌株絮凝能力、死亡率及对应的发酵液中主要风味物质含量没有太大的变化,表明了该3株目的菌株遗传性能较为稳定。
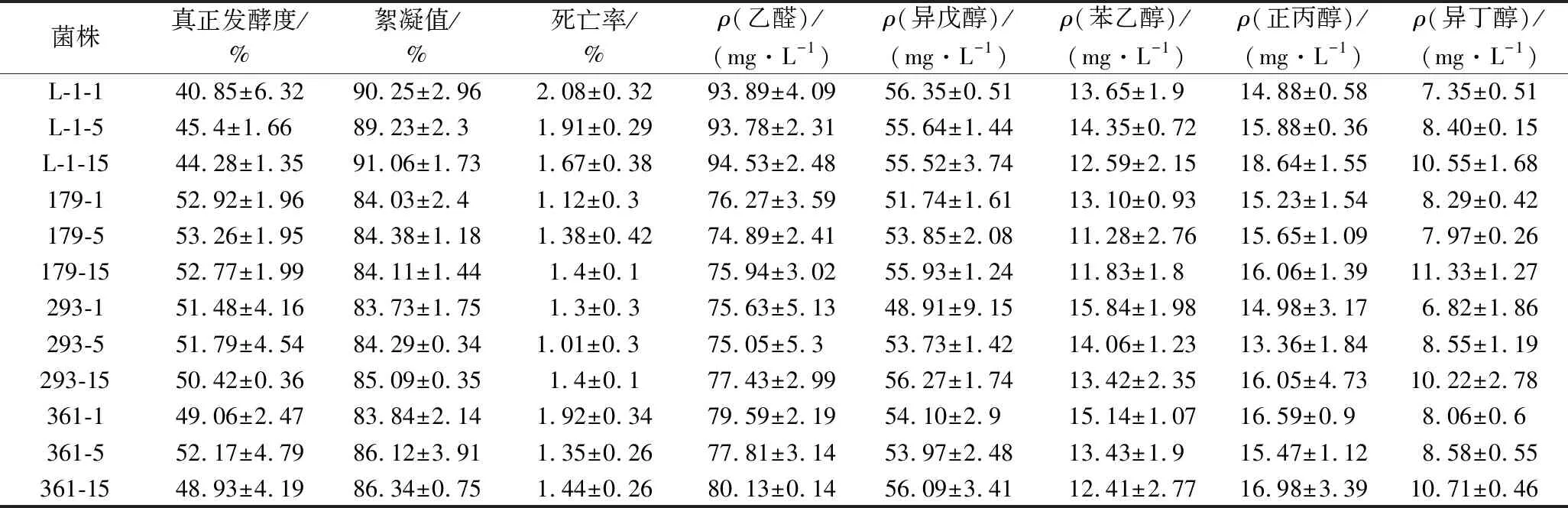
表7 目的菌株遗传稳定性分析实验Table 7 The genetic stability analysis experiment of the target strain
3 结论
在啤酒行业中,良好絮凝能力的啤酒酵母决定着啤酒高质量的生产。近年来,ARTP诱变育种在食品领域仍是较热门的诱变育种方法。本研究以L-1为出发菌株对其进行ARTP诱变并获得630株诱变株,结合优化的絮凝能力检测方法,通过大试管与1 L量筒体系进行初筛与第一、二轮次复筛,得到了179、293、361三株目的菌株,相比于出发菌株L-1,3株目的菌株絮凝能力分别降低了6.67%、6.67%和5.56%,死亡率分别降低了31.21%、34.57%和16.93%。同时其对应发酵液中乙醛含量均有不同幅度的降低,降幅分别为19.53%、19.17%和15.83%,此外,3株目的菌株的基本发酵性能也有不同幅度的提升,其对应的发酵液中高级醇含量变化不大,筛选出的菌株具有一定的实际应用潜力。
