巨噬细胞在正常及受损耳蜗中的表型研究综述
2022-08-18王芹赵芳芳郑体花郑庆印
王芹 赵芳芳 郑体花 郑庆印
滨州医学院特殊教育学院(烟台 264003)
耳蜗是感受声音的感觉器官,负责将声刺激转化为神经系统的信号。柯蒂氏器作为耳蜗中的听觉感受器,由感觉细胞、支持细胞和盖膜等组成[1]。当耳蜗感觉细胞受到各种急性和慢性的损伤,如听觉过度刺激、耳毒性药物和年龄相关退化时,耳蜗会产生炎症反应,而这种反应是防御机制中不可或缺的组成部分[2]。
巨噬细胞作为耳蜗主要的免疫细胞,参与炎症修复和稳态维持,在局部耳蜗免疫中发挥重要作用。本文主要探讨巨噬细胞与耳蜗的关系,为炎症导致听力损失的临床治疗提供一种新的思路。
1 巨噬细胞在耳蜗中的起源与分布
巨噬细胞是单核白细胞家族的一部分,包括单核细胞、小胶质细胞、树突状细胞和组织巨噬细胞。组织巨噬细胞包括常驻巨噬细胞和浸润性巨噬细胞。耳蜗中的常驻巨噬细胞被认为是内耳最主要的免疫细胞,负责监控局部微环境和修复受损组织[3]。炎症刺激使循环单核细胞浸润至耳蜗,并活化成巨噬细胞。
Takayuki等发现胚胎期耳蜗中存在两种常驻巨噬细胞,一种是起源于卵黄囊的巨噬细胞,另一种是起源于胚胎肝脏体循环的巨噬细胞[4]。这些巨噬细胞群在出生前就驻留在耳蜗中,并在成熟耳蜗局部发挥免疫功能[5]。出生后发育过程中,在耳蜗基底膜检测到具有巨噬细胞前体表型的免疫细胞,这些细胞可分化为巨噬细胞[6]。成熟耳蜗巨噬细胞是完全分化的细胞,没有增殖潜能,可由循环单核细胞重新填充[7]。稳定状态下,成熟耳蜗巨噬细胞的主要来源包括卵黄囊巨噬细胞、胚胎肝脏单核细胞和骨髓单核细胞[4]。当耳蜗受损时,不同来源的巨噬细胞发挥它们的功能。了解耳蜗巨噬细胞的来源有助于研究者探究巨噬细胞在耳蜗的具体分布及变化。
1.1 巨噬细胞在发育期耳蜗的分布及动态变化
巨噬细胞在发育期耳蜗中分布较广,如基底膜、柯蒂氏器、螺旋韧带,螺旋缘和螺旋神经节区域。Hu等发现,在发育期耳蜗的柯蒂氏器和基底膜区域存在两组巨噬细胞[6,8]。一组位于基底膜鼓阶侧,这些巨噬细胞在出生后第1天呈圆形,并在第4天开始发生特异性分化。顶回巨噬细胞呈树突状,中回巨噬细胞呈不规则形状,突起短,底回巨噬细胞进一步分化为变形虫状,如图1所示。另一组巨噬细胞位于基底膜中阶侧支持细胞间隙[9]。随着感觉上皮的成熟,巨噬细胞出现从底回到顶回的梯度退化,最终出现细胞凋亡。巨噬细胞在柯蒂氏器发育过程中的具体作用仍不是很清楚,但可以猜测,基底膜中阶侧巨噬细胞的退化参与了感觉上皮的成熟。
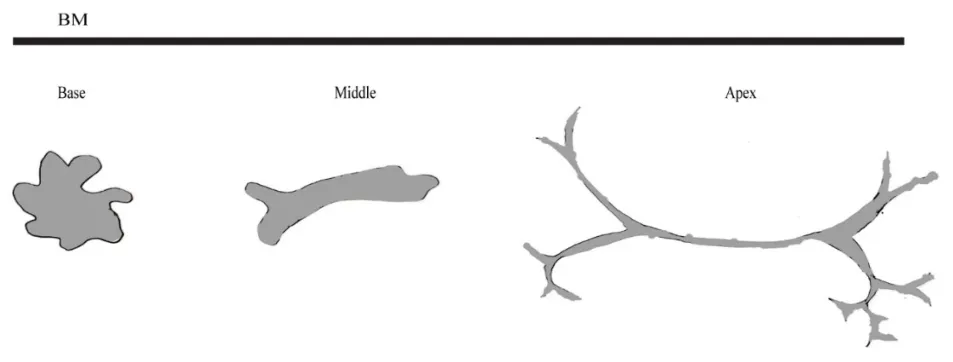
图1 基底膜鼓阶侧巨噬细胞形态示意图。BM:基底膜。Fig.1 Schematic representation of macrophage morphology in the scala tympanic side of the basilar membrane.BM:Basilar Membrane.
此外,他们还发现,位于螺旋韧带、骨螺旋板以及靠近蜗轴的螺旋神经节区域的巨噬细胞形态从最开始的膨大球体形状变成更多的分支与突起,而细胞数量却随着耳蜗成熟而相对减少[6]。可见,发育期耳蜗巨噬细胞处于动态变化之中。
1.2 稳定状态下,巨噬细胞在成熟耳蜗中的分布
与发育期耳蜗比较而言,巨噬细胞也存在于除柯蒂氏器以外的耳蜗大部分区域。
位于基底膜鼓阶侧的巨噬细胞,沿基底膜整个长轴分布。在稳定状态下,这些巨噬细胞的表型同发育期耳蜗基底膜鼓阶侧巨噬细胞的表型一致[10]。
耳蜗外侧壁区域主要包括螺旋韧带和血管纹。螺旋韧带巨噬细胞在矢状面分布并不均匀,螺旋韧带外侧缘可见密集的巨噬细胞,在前庭膜亦存在少量巨噬细胞[11]。最新研究显示,Seong等证实血管纹附近的巨噬细胞较少,尤其是血管纹下方的巨噬细胞[11]。这种特异性分布对于其功能的影响并未见报道,有待进一步验证。
位于血管纹的巨噬细胞参与构成耳蜗血-迷路屏障。血-迷路屏障主要由血管内皮细胞、周细胞、基底膜、血管周巨噬细胞通过细胞间紧密连接组成[12],可将体循环和内淋巴液隔开以选择性阻挡生物大分子进入内耳,从而维持内耳微环境稳定。巨噬细胞不仅负责免疫功能,在调节血-迷路屏障的完整性和通透性方面也发挥重要作用[13,14]。血管周巨噬细胞存在于毛细血管周围,是一种兼具巨噬细胞和黑色素细胞特征的细胞。血管周巨噬细胞胞体膨大,其长轴沿毛细血管分布,向四周突起细长分支,呈树枝状,其足突伸出与微血管壁紧密接触,将毛细血管包裹起来,以选择性阻止大分子物质的通过。Zhang等[15]的研究也表明血管周巨噬细胞可以通过调节血-迷路屏障的通透性来建立和维持正常的耳蜗内电位。
稳定状态下,巨噬细胞也存在于骨螺旋板、螺旋神经节和靠近蜗轴的神经纤维区域。螺旋神经节的迁移、成熟和存活在很大程度上依赖于周围的胶质细胞[16]。胶质细胞在听力起始和听神经成熟中至关重要。Brown等[17]发现在早期听神经发育过程中,巨噬细胞减少会使胶质细胞数量增多,导致髓鞘形成异常和血管纹的短暂水肿,从而影响听力。因此,这些区域的巨噬细胞很可能与听神经的成熟和听力损失发生有关。
成熟的柯蒂氏器缺乏组织巨噬细胞[6,18-20]。缺少这种免疫细胞可能是有益的,因为柯蒂氏器是由规则排列的感觉细胞和支持细胞组成的完整结构,任何免疫细胞的入侵都可能改变其力学结构和微环境,从而破坏其功能完整性。
2 耳蜗急性炎症中的巨噬细胞
有文献报道,噪音暴露、耳毒性药物和人工耳蜗植入等因素会引起耳蜗急性损伤。耳蜗炎症被认为是导致感音神经性听力损失的重要致病因素[21]。通过构建耳蜗炎症模型,Seong等[11]发现巨噬细胞和单核细胞在炎症耳蜗中的数量增多。在炎症信号的作用下,单核细胞迁移到耳蜗并参与组织免疫反应[22,23]。
2.1 巨噬细胞在耳蜗急性炎症中的分布变化
如前所述,成熟耳蜗巨噬细胞是完全分化的免疫细胞。听觉损伤后,不发生增殖[22]。单核细胞主要是通过哺乳动物耳蜗侧壁、蜗轴和神经节区域的血管系统迁移到耳蜗大部分区域[7,20],特别是螺旋韧带和螺旋缘发现大量巨噬细胞[22-26]。然而柯蒂氏器没有炎性细胞的浸润[20]。并且,Seong等[11]也发现血管纹附近及下方的区域几乎没有巨噬细胞的迁移。如图2所示。
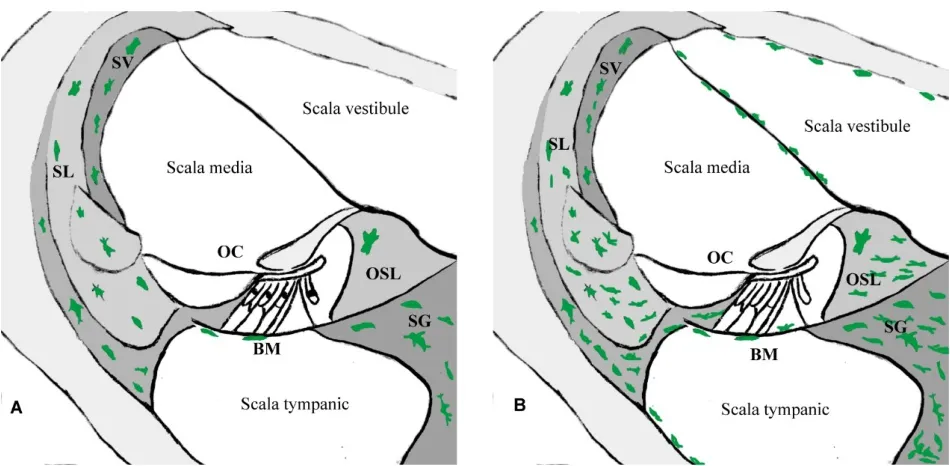
图2 正常和受损耳蜗横截面上的巨噬细胞。A:正常耳蜗中含有常驻巨噬细胞,它们分布在非感觉支持组织中。B:耳蜗受损之后巨噬细胞数量增加,并且出现在耳蜗的大部分区域:血管纹(SV),螺旋韧带(SL),螺旋器(OC),基底膜(BM),骨螺旋板(OSL),螺旋神经(SG)。点状区域表示缺乏耳蜗巨噬细胞。Fig.2 Macrophages on normal and damaged cochlear crosssections.A:the normal cochlea contains resident macrophages,which are distributed in non-sensory supporting tissues.B:stria vascularis(SV),spiral ligament(SL),the Organ of Corti(OC),Basilar Membrane(BM),Osseous Spiral Lamina(OSL),Spiral Ganglion(SG).Punctate areas indicate a lack of macrophages.
2.2 巨噬细胞在耳蜗炎症中的分子调控
炎症刺激耳蜗内皮细胞分泌细胞间粘附分子,募集单核细胞到受损耳蜗中。单核细胞分化成巨噬细胞后,能够吞噬和分泌更多的分子,进一步激活免疫反应。
ICAM-1是一种细胞粘附分子,主要介导单核细胞与血管内皮细胞的粘附,帮助其迁移至耳蜗。据报道,ICAM-1的表达在噪声暴露后1天呈上升趋势,在2~4天达到最大值,在噪声暴露后14天恢复到耳蜗噪声暴露前的水平,阻断ICAM-1可以防止因噪声暴露引起的听力损失[23,27]。
巨噬细胞是内耳唯一表达CX3CR1的细胞。CX3CR1也是一种粘附分子,其配体Fractalkine是一种表达在神经元和内皮细胞上的膜结合糖蛋白[28]。噪音创伤后,在Fractalkine信号的参与下巨噬细胞可以促进受损突触的修复[29]。Kaur等[30]发现Fractalkine介导了巨噬细胞和耳蜗神经元之间的相互作用。Fractalkine信号通路的中断减少了巨噬细胞向感觉上皮和螺旋神经节募集,也导致了毛细胞死亡后螺旋神经元的丢失。
Tlr4是一种模式识别受体[18,21],它可以识别病原体或损伤相关的分子如TNF-α,IL-1β和IL-6,有助于免疫应答启动。Toll样受体通路基因能够对听觉创伤做出反应,但Tlr4基因敲除不影响耳蜗的听力功能[19,31]。Tlr4的缺失抑制巨噬细胞表达MHC-II,从而降低巨噬细胞抗原呈递的活性[20]。
除此之外,在Wakabayashi等的研究中,发现使用IL-6R的中和抗体可以阻断噪声损伤后释放的IL-6的影响,使噪音损伤后第3天巨噬细胞的浸润明显减少,螺旋神经节细胞死亡减少[24]。
这些结果表明单核细胞的浸润是多种分子共同作用的结果。噪音暴露6小时后,细胞因子如TNF-α、IL-1β、IL-6等表达上调[24],这可能是常驻巨噬细胞和纤维细胞活化的结果。噪音暴露后3-7天,耳蜗巨噬细胞数量达到峰值,暴露后第7天和第14天逐渐减少。这种差异表明早期产生的炎症介质很少来自浸润的巨噬细胞[32]。相反,耳蜗纤维细胞和常驻巨噬细胞可能通过释放细胞因子和趋化因子参与耳蜗早期免疫应答。这些细胞因子、趋化因子和细胞粘附分子最初表达水平的升高可能介导了炎症细胞的募集。它们表达后一个高峰的出现尚不清楚,但我们推测可能与耳蜗炎症修复过程有关。
2.3 耳蜗急性炎症时,巨噬细胞和支持细胞的协同作用
多项研究表明,巨噬细胞并不是内耳唯一的吞噬细胞,支持细胞也在清除毛细胞死亡或凋亡碎片中发挥重要作用。支持细胞为柱状,位于基底膜上,并到达感觉上皮的表面,以填充毛细胞之间的空隙。毛细胞不与基底膜接触,但位于支持细胞的胞体上,构成双层上皮的上层[1]。从腔面侧观察,毛细胞被支持细胞包围,形成特有的镶嵌式花纹[33]。Liu等[34]提出了柯蒂氏器中巨噬细胞处理死亡毛细胞的假设表现:当毛细胞受损或死亡时,毛细胞残体缩回到网状板下,并被活化的巨噬细胞吞噬和清除。此时,构成网状板的支持细胞更像是一种动态吞噬体[35,36]。当原本位于支持细胞之间的毛细胞出现损伤,变性甚至死亡时,毛细胞的位置被支持细胞占据,并融合在一起,形成一种“吞噬体”,配合活化的巨噬细胞执行功能。
通过巨噬细胞和支持细胞的协同作用,死亡毛细胞被迅速降解和移除。这种从耳蜗中快速清除受损细胞的过程,对于保护存活的细胞免受受损或死亡细胞释放的有毒分子的伤害至关重要。
3 衰老耳蜗中的巨噬细胞
衰老是一种慢性炎症,所有内耳结构都会出现相应退化,特别是毛细胞和螺旋神经节的丢失。Verschuur等[37]分析360人的听力阈值,发现与炎症水平之间存在关联,即炎症水平较高的听力阈值比炎症水平较低的阈值约高17dB HL,此相关性随着年龄的增大而增强。说明老年性听力损失与炎症显著相关。这种慢性炎症激活了耳蜗巨噬细胞[38]。Hu等[10]对年龄相关性听力损失小鼠模型的研究发现,对慢性毛细胞丢失产生免疫反应的主要巨噬细胞群体是成熟的、完全分化的常驻巨噬细胞,而不是最近浸润的单核细胞。这一特点与急性耳蜗损伤参与免疫反应的巨噬细胞类型不一样。
随着年龄的增长,感觉上皮巨噬细胞的数量和形态呈现动态变化[10],顶回巨噬细胞总数逐渐增多,底回巨噬细胞总数逐渐减少,且减少趋势较增多趋势明显,10~12月龄和3~5月龄的巨噬细胞平均大小明显比1月龄的更大一些。感觉上皮的巨噬细胞活性也随着毛细胞的丢失而逐渐降低。这一变化与毛细胞退化的阶段有关,表明巨噬细胞的活动可能与毛细胞状态有关。巨噬细胞的数量和形态变化与毛细胞退化的相互作用,也是值得进一步探讨的内容。
在慢性衰老的条件下,耳蜗内的巨噬细胞数量减少可能是先于毛细胞的丢失。可以推测,巨噬细胞的活化可能也是导致年龄性听力损失的一种促进因素。耳蜗的急性损伤是否也表现出这样一种现象还需要进一步的实验验证。
4 总结
结构与功能相适应,对巨噬细胞在耳蜗不同部位不同发育阶段的表型研究,有助于进一步探究巨噬细胞和耳蜗的关系。在研究新生小鼠发育到成熟的过程,发现耳蜗巨噬细胞在耳蜗中的分布、数量都发生了动态的变化,这种变化是否受到局部微环境的调控以及怎样调控还有待研究。对耳蜗局部微环境与耳蜗巨噬细胞的关系研究也可以为炎症相关听力损失提供一种新的研究思路。
