ATP检测技术在自来水处理中的应用
2022-08-17杨石红赵益杰
杨石红, 赵益杰, 宋 飞, 文 闻
(1.昆明通用水务自来水有限公司, 云南 昆明 650021; 2.威立雅(中国)环境服务有限公司北京分公司, 北京 100073;3.海口威雅水务有限公司, 海南 海口 570203)
为保障饮用水卫生安全,自来水公司通常根据《生活饮用水卫生标准》(GB 5749—2006)对出厂水和管网水的菌落总数、总大肠菌群等微生物指标进行检测。但这些指标都有一定的局限性:它们的检测方法均属于培养法,检测耗时长(1~3 d);这些检测都只能在实验室里面进行,不能进行现场检验;菌落总数并不能真正检测总的细菌数,而只能检测部分可以培养的异养菌,还有大量有活性但不能被培养的细菌(VBNC)不能被检出[1]。因此,仅采用这些指标越来越难以满足不断提高的水质管理需求:①自来水处理系统从源头到水龙头,都需要了解微生物总量的变化情况,以便进行更加科学的消毒处理;②需要及时了解水厂消毒工艺运行效果,从而要求对微生物进行快速测定;③管网中水力条件的改变,可能导致水中微生物稳定状态的变化,需要使用快速检测手段来掌握微生物状态;④在用户投诉以及管道泄漏等紧急情况下,除了余氯、浊度等指标的现场检测手段以外,特别需要微生物的现场检测,以便初步判断是否存在微生物污染风险。
三磷酸腺苷(ATP)存在于从微生物到高等动植物所有生物体细胞中,是所有活细胞中主要的能量载体,为细胞代谢提供所需能量,正常生物体细胞内的ATP含量是相对稳定的。ATP含量可以直接反映细胞活性以及微生物的数量,可以代表真正的细菌总数[2]。以荧光染色技术为基础的ATP测定仪具有便携快速的特点,可以在生产现场于数分钟之内完成单个样品检测,并通过水样浓缩使灵敏度达到菌落总数(平皿法)的水平。它在食品卫生、工业水处理以及自来水水质管理等领域得到广泛应用。笔者在本文中探讨了ATP检测技术在自来水处理中的应用。
1 材料与方法
1.1 主要仪器
1.1.1检测仪器和方法原理
所采用的ATP测试仪为HACH TX1315 便携式生物毒性分析仪,主机包含照度计和通讯模块,第二代ATP测试套装(通用型)。
活性微生物细胞经过破壁处理后,释放出的ATP和萤光素酶催化反应而发光,使用照度计来测量发光的强度(RLU),从而对样品中 ATP 浓度进行定量分析,反应式如下:
(1)
检测时,用套装内的注射器过滤装置过滤50 mL(Vsample)水样,在滤头上加入1 mL破壁剂Ultralyse,然后用注射器将其推入9 mL UltraLute荧光酶溶液中,混匀,取100 μL混合液用照度计测量照度(RLUcATP),同时取100 μL ATP标准溶液(100 000 pg/mL)测量照度(RLUATP1),样品ATP的值表示为:
(2)
1.1.2其它设备和检测方法
游离氯测定使用余氯仪 HACH DR300, 菌落总数按照《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)配置所有器皿试剂并测试。
1.2 应用研究方法
先验证ATP检测仪器的精密度和检出限,然后对水厂出厂水和管网水进行初步常规测定,建立基准线,再应用到供水管网敏感取样点、二次供水等场景,讨论检测结果对于水质管理的意义。
2 结果与讨论
2.1 方法的基本参数验证
2.1.1仪器精密度检查
使用同一管网水样品,过滤50 mL,进行6次重复检测,检测的结果见表1。
检测平均值为1.06,标准偏差为0.07,相对标准偏差为6.6%,这对于微生物检测来说,方法有足够的精密度。
2.1.2方法检出限的确定
根据标准《环境监测 分析方法标准制修订技术导则》(HJ 168—2010),按照样品分析的全部步骤,重复11次空白试验,将各测定结果换算为ATP值,结果见表2(平均校准值RLU=14 809)。计算得到11次平行测定的标准偏差s=0.08,MDL=0.21。

表2 ATP检测的标准偏差Tab.2 MDL of ATP detection pg·mL-1
2.2 水厂出水常规检测
采用同一方法,对10个水厂的出厂水取3个平行样并检测ATP,同时检测菌落总数。菌落总数结果均为0 CFU/mL,ATP检测结果(n=3)见图1。
从图1可以看出,不同出厂水的ATP含量略有差异,除了1#水厂,其余各水厂的组内平行样结果差异不大(相对偏差小)。其中4#水厂、7#水厂、3#水厂、8#水厂的平均ATP含量均小于1.0 pg/mL。

图1 出厂水ATP常规检测的平均值和最值图Fig.1 Average value and maximum/minimum value of ATP routine detection of treated water
参考文献[3]中的方法,建立一个基准线(参考限值),以便判断后续的检测结果是否在正常范围内。根据实际的检测结果,这些样品的菌落总数都未检出,水质满足当前标准要求,而个别出厂水ATP检测结果却出现明显偏高的现象。这可能是水中的消毒剂接触时间不够造成,也可能是水中有其他的微生物或不当操作造成的。个别偏高的值和其他数值有显著性差异,应该被当做水质异常而视为离群值,在计算基准线时予以去除。
将这些数据从小(x1)到大(x30)排列后,计算平均值:

查Grubbs临界值表,检测数量p=30时,1%临界值为3.236,5%临界值为2.908,G30>3.236,所以最大值x30为离群值。
按此方法逐步确认剩余数据的最大值是否为离群值,结果表明x29不是离群值。

2.3 管网水常规检测
对管网水日常22个取样点的31个样品测量ATP含量和菌落总数。大部分取样点第1次ATP测试结果很低,所以对这些取样点只测试1次;少部分取样点第1次测试结果比较高,所以这些取样点测试2次以上。这些样品的菌落总数结果为0 cfu/mL,ATP的检测结果平均值如图2所示。

图2 管网水的ATP检测平均值和最值Fig.2 Average value and maximum/minimum value of ATP detection of pipe network water

古代打官司不准代理,有身份的官员、士大夫、妇女可以由家人代为诉讼,诉讼双方当事人必须亲自到庭。也不准“教唆词讼”,不准教别人如何打官司。为人起草诉状是可以的,但是不得加减情节和诉讼请求。
从数值上看,管网水的ATP基准线小于水厂,似乎不合乎情理,但这可能是两方面的原因造成的:管网水大都来自7#水厂,而7#水厂的平均值为0.58 pg/mL;而水厂的基准线是剔除离群值后的所有水厂数据的平均值和标准偏差的计算结果,其中有几个水厂的检测结果比较高但又不是离群值。因此,采用所有水厂的结果来计算限值的方法有一定局限性,应该每个水厂单独考虑,并分析比较ATP检测结果存在显著差异的水厂之间的运行差异。
2.4 敏感取样点管网水检测
选取包含以下4个特征的8个管网水取样点:2019—2021年微生物超标2次以上的管网水;老旧区域管网水;输水距离最远(19.5 km)的管网水;在不同时间取样4次并检测ATP、菌落总数、余氯和浊度,菌落总数均未检出的点位。8个取样点管网水中ATP检测结果如图3所示。

图3 敏感取样点管网水的ATP检测平均值和最值Fig.3 Average value and maximum/minimum value of ATP detection of pipe network water at sensitive sampling points
以上管网点样品的余氯平均值为0.44 mg/L,最小值为0.15 mg/L;浊度平均值为0.24 NTU,最大值为0.44 NTU。ATP的检测结果只有1次(2.68 pg/mL),超过参考限值1.73 pg/mL,该样品的余氯为0.15 mg/L,大于管网水要求限值0.05 mg/L。这说明:①以前的微生物超标情况确属于偶发现象,或者生物膜突然脱落被检出[5],或者操作过程偶发影响因素所致;②最远端的取样点距水厂19.5 km,但是ATP的最大值是1.01 pg/mL,该处管道系1996年建设的灰口铸铁管,数据表明管道内的水质受水龄和管材影响很小。③离水厂最近的老旧管道(1997年建设的灰口铸铁管),其出水ATP的4次检测值均小于1.0 pg/mL,水质未受老旧管道影响;④这些取样点微生物指标的稳定,很有可能与水中较高的余氯水平有关。但余氯也不宜控制得太高,否则会有消毒副产物增加和嗅味超标的风险[6]。
2.5 不同工艺出水和出厂水中ATP的变化
在实验室里模拟不同水龄管网水并测试ATP。在水厂取原水、沉淀水、滤后水和出厂水,分别测定其ATP,以考察不同工艺出水中微生物量的变化;在滤后水中加入一定量的次氯酸钠溶液,使余氯大于出厂水的余氯量,和沉淀水、出厂水一起放置一定时间测试菌落总数和ATP,以便了解在不同余氯的情况下,水中微生物量的变化情况,检测结果如表3所示。
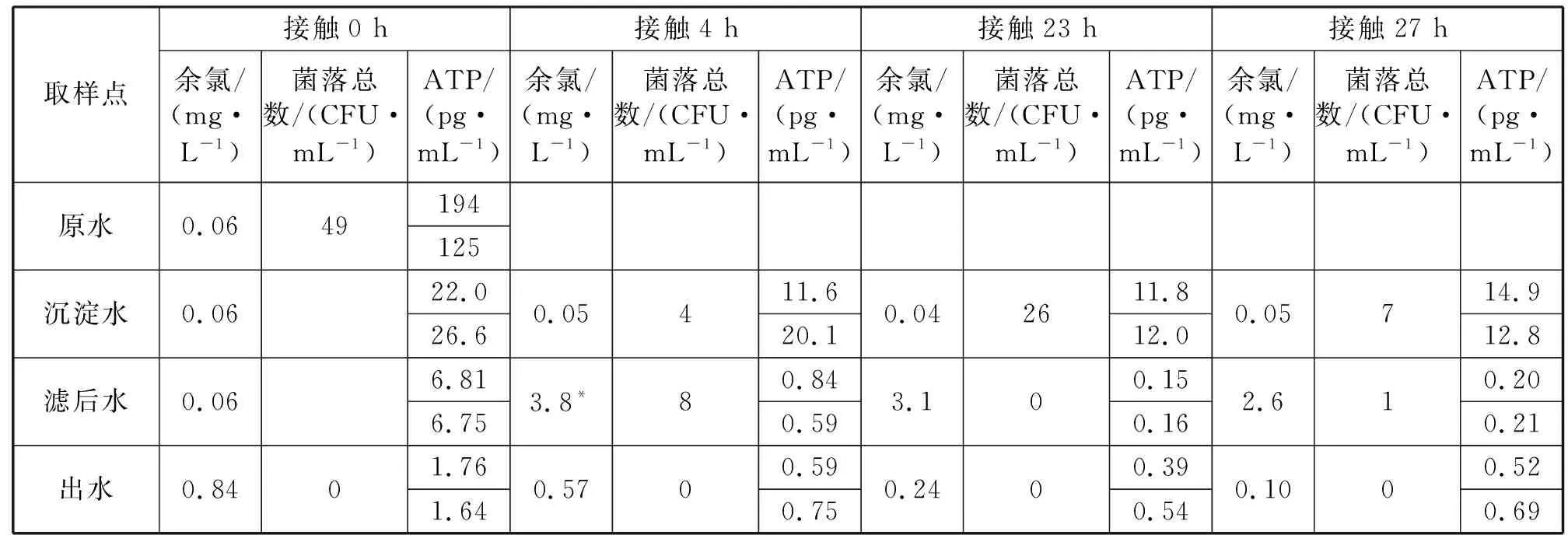
表3 不同消毒剂接触时间下ATP的变化趋势Tab.3 Variation of ATP under different disinfection contact time
从检测结果看,接触0 h时,原水、沉淀水和滤后水余氯读数为0.06 mg/L,但实际上当天原水水样未加氯,滤后水取样点在加氯点前,所以原水、沉淀水和滤后水的余氯视为未检出。ATP含量沿着生产工艺线明显降低,沉淀水和滤后水无法及时送回实验室,未测定菌落总数,原水和出厂水的菌落总数为当日日常取样的检测结果。从数值上看,从原水到出厂水,ATP的变化远远大于菌落总数的变化,推测是两种方法测定原理的差异,菌落总数是1 mL样品经过营养琼脂培养48 h后检测的结果,检测的只是能培养的异养好氧菌,而ATP含量反映的是50 mL样品过滤后所有的生物量,后者显然比前者有更强的代表性。放置水样的测定结果也证明了这一点。
滤后水取回实验室加氯后测得的余氯值为3.8 mg/L,此时(4.0 h)测定的菌落总数和未加氯的沉淀水的菌落总数分别为4和8 CFU/mL,实际上不能据此分辨消毒效果。相比之下,沉淀水和滤后水的ATP含量却有很大差异,而加氯后的滤后水的ATP含量和出厂水接近。
继续放置和测定沉淀水(无氯)、滤后水(高氯)和出厂水(低氯),23 h后滤后水和出厂水的余氯进一步降低,ATP含量也进一步降低,滤后水的降低更加明显,这可能是因为高浓度的余氯持续接触的结果。而未加氯的沉淀水的ATP含量基本不变。
考虑到最长的管网水停留时间(约20 h),实验选取27 h的极端情况进行测试。放置27 h后,滤后水和出厂水的余氯继续下降,但ATP含量已经没有下降的空间。数据结果说明当前出厂水的余氯完全能抑制管网中微生物生长。实验表明,氯的浓度和接触时间的乘积(CT值)与ATP含量降低程度成明显负相关,这可以解释管网水的ATP含量整体上低于出厂水。
因此,实验结果表明,ATP检测除具有检测快速、取样量大且更有代表性的优点以外,消毒前后ATP含量的变化比菌落总数的变化更大,用ATP含量来评估消毒效果更为科学。
2.6 二次供水中ATP和菌落总数之间的关系
测试了供水区域内部分二次供水取样点的ATP,包括水池进出水和龙头水,同时检测菌落总数,一共71组数据。统计菌落总数和ATP之间的关系见图4,其中图4.a为所有样品检测结果,包括大量未检出菌落总数的样品,图4.b仅为菌落总数高于100 CFU/mL样品。

图4 菌落总数与ATP之间的相关性Fig.4 Correlation between bacteria and ATP
从图4.a看,有很多样品在菌落总数为0或者低于限值的情况下,仍有很高的ATP含量。也就是说,菌落总数在低于限值的情况下,ATP仍可能被检出且在较高浓度水平。这可能是因为低浓度的微生物在水中分布不均匀,菌落总数取1 mL测试,ATP取50 mL进行测试,两者所取样品中微生物的单位含量不尽相同;另外一种可能是因为在微生物低浓度水平,平皿计数法检测菌落总数有极大的选择性,只能检出部分微生物,因此彼此之间的一致性在这一浓度水平下并不好。从图4.b看,在菌落总数为100~1 000 CFU/mL的水样里,菌落总数和ATP含量仍然没有良好的线性关系。
Narsaiah等[7]的实验表明,ATP含量和菌落总数之间只针对指定菌种在一定浓度范围内有一定相关性,比如在Bacillus、Pseudomonas、and Staphyllococcus这3种菌的人工合成样测试中,发现它们在菌落总数的对数为2~8时,ATP含量和菌落总数有明显的对数线性关系,相关系数达到0.88。而在出厂水和管网水这种微生物水平本来就很低的样品中,很难找到ATP含量和菌落总数的对应关系,也就很难找到菌落总数限值(100 CFU/mL)所对应的ATP含量数值。
ATP含量作为一个衡量水中微生物综合情况的指标,应该摆脱菌落总数而建议一个独立的参考限值,也可以建立一个运行控制基准线。在日常的水质管理中,如果ATP含量超出这个基准线,就可以及时检查水厂生产运行情况、管网污染等问题,同时进行其他常规指标检验。
3 结论与建议
① ATP检验技术用于自来水中微生物的检测,和菌落总数相比具有检测更快速、检测细菌更全面、操作更方便的特点,可以用于对水厂消毒效果的确认,从而及时调整工艺;也可以用于水质管理的应急检验,以便及时发现可能的微生物污染。
② ATP含量和菌落总数在出厂水和管网水样品中没有明显的相关性,不能参考菌落总数的标准限值计算ATP含量的限值。在具体应用中,需要根据检测对象的水质特点,建立独立的基准线,通过基准线去评估检测结果是否正常。
