潮间带沉积物厌氧烃降解细菌的多样性及Desulfovibrio subterraneus ND17的分离鉴定
2022-08-17张琪邓晔邵宗泽王万鹏
张琪 ,邓晔 ,邵宗泽,王万鹏*
( 1.山东大学 海洋研究院,山东 青岛 266237;2.自然资源部第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门361005;3.中国科学院生态环境研究中心,北京 100085)
1 引言
潮间带位于海陆交界处,大潮高潮最高潮线和大潮低潮最低潮线之间,是典型的近海生态系统。来自于海洋和陆地的各类营养物质,很容易在潮间带地区汇集并累积,使得潮间带相比其他环境有更高的初级生产力和更丰富的微生物资源。潮间带作为海陆交界处易受到来自于海洋的石油污染,海洋石油烃污染的来源主要包括人类活动(如海上运输、废水排入、地表径流、海上油气田的开发等)、自然渗漏(海底的石油渗漏等)以及大气沉降[1-2],在潮间带地区,微生物能够有效地分解来自陆地和海洋积聚在此的有机物[3]。好氧条件下石油烃降解菌的研究开展较早且较深入,而厌氧条件下的相关研究包括微生物的种类、功能基因和降解机制等都处于初始阶段[4-8]。
20世纪末,科学家们陆续从烃污染的土壤、沉积物(淡水和海洋)和油藏等缺氧的生境中分离获得了降解石油烃的单菌和菌群[9-11]。在厌氧条件下,微生物无法利用氧气作为末端电子受体获取ATP,但可以利用硝酸盐[12]、硫酸盐[13]、三价铁[14]以及高价锰[15]等作为末端电子受体进行呼吸作用氧化多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)等有机物,还有研究发现,在产甲烷条件下存在多环芳烃的降解现象[16-18]。硫是地球上最丰富的元素之一,它主要以黄铁矿(FeS2)或石膏(CaSO4)的形式存在于岩石和沉积物中,在海水中以硫酸盐的形式存在。硫酸盐在自然环境特别是在许多厌氧生境中含量丰富并显著地影响着环境中的微生物活动[19]。在缺氧环境中,硫酸盐还原菌(Sulfate-Reducing Bacteria,SRB)可以利用硫酸盐作为电子受体氧化烷烃、多环芳烃等有机污染物[20-22],因此研究硫酸盐还原条件下海洋沉积物中厌氧石油烃类的降解对碳硫等元素的循环也至关重要。为探究近海潮间带地区沉积物中参与厌氧烃降解过程的细菌类群,本研究以青岛女岛湾潮间带沉积物深层样品为研究对象,给予混合烃为碳源及硫酸盐作为电子受体进行厌氧富集培养,分析厌氧石油烃降解菌的多样性并分离单菌进行功能验证,以期获得高效的石油烃降解菌。
2 材料与方法
2.1 实验材料
样品采集于青岛女岛湾潮间带(36.22°N,120.51°E)表层0.5 m以下的沉积物,共6管。泥样呈黑褐色,稍有刺鼻气味,有黏性。采集的样品置于无菌的50 mL离心管,低温运输,4℃保存备用,并另取5 g置于离心管中放入−20℃冰箱内进行冷冻,用于提取原位样本的环境DNA。
2.2 厌氧富集培养
2.2.1 培养基
基础盐培养基(MSM):NH4Cl 0.33 g/L、KCl 0.5 g/L、CaCl20.5 g/L、MgSO4·7H2O 3.0 g/L、NaCl 22.0 g/L、Na2SO43.0 g/L、PIPEs buffer(哌嗪-1,4-二乙磺酸)5.0 g/L,加入1 mL的刃天青溶液(1.0 g/L)作为氧气指示剂,pH 调至 6.8±0.2。
Medium 63 培养基:K2HPO40.5 g/L、NH4Cl 1.0 g/L、Na2SO41.0 g/L、CaCl2·2H2O 0.1 g/L、MgSO4·7H2O 2.0 g/L、FeSO4·7H2O 0.5 g/L,加入 1 mL 的刃天青溶液(1.0 g/L)作为氧气指示剂,pH调至6.8±0.2。
混合烃溶液:萘、菲、芘各0.01 g分别溶于1 mL十二烷和1 mL十六烷中,制成混合烃类碳源,过滤除菌。
将基础盐培养基分装到规格为150 mL的厌氧血清瓶中,每瓶70 mL,用丁基橡胶塞盖紧,并用铝盖压紧封口。121℃高温灭菌20 min后,加入过滤除菌的微量元素溶液、维生素溶液、磷酸盐缓冲溶液和混合烃溶液(体积比为0.5%)。利用高纯度氮气抽换气的方式将厌氧瓶里的空气去除,顶空气体充入氮气,除氧效果以溶液澄清无色为准。若培养基进氧颜色变粉,需及时补加适量半胱氨酸盐酸盐溶液。
2.2.2 以硫酸盐为电子受体的厌氧富集
取5 g原位样品用灭菌后的基础盐培养基重悬,使用无菌注射器将重悬样品注射到准备好的厌氧血清瓶中,用作厌氧富集的培养基去除,作为氮源,作为末端电子受体,顶空气体为N2。每日摇匀两次并进行观察,发现氧气指示剂有变色现象时,及时补加半胱氨酸盐酸盐溶液去除培养基内残余氧气。静置于32℃培养箱培养,每隔1个月进行一次转接。在后期培养中,适量补加硫酸亚铁溶液,目的是将还原为后与形成FeS黑色沉淀,以此作为生长表征。
2.3 原位和富集样本的高通量测序及分析
样本DNA在提取前首先要保证菌量足够,电子显微镜观察菌群具有一定的活性,在不断传代的过程中发现新转移的培养基内24 h就可以生成硫化亚铁沉淀。本实验中,提取DNA的样本分别为6个原位沉积物样本(QD_1Y,QD_2Y,······,QD_6Y)及其富集传代培养 8 个月的 6 个样本(QD_1F,QD_2F,······,QD_6F)。
采用德国QIAGEN公司的环境基因组提取试剂盒(QIAGEN,Düsseldorf,Germany)提取样品总 DNA,在1%浓度的琼脂糖凝胶电泳下显示明亮 DNA 条带,并通过 Nanodrop 2000 超微量分光光度计检测DNA质量,提取的DNA送至上海美吉生物医药科技有限公司进行测序分析。采用细菌引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S 基因序列的V3−V4区进行扩增子测序,测序数据经拼接、质控、去接头之后获得优化序列。按照97%的相似性阈值将序列聚类为不同的操作分类单元(Operational Taxonomic Unit, OTU)分析,并在各分类水平分析每个样品的群落组成以及多样性指数。
2.4 脱硫弧菌的分离及烃降解率的测定
2.4.1 厌氧平板分离
在基础盐培养基中加入1.5%琼脂制成固体培养基,加热灭菌后待培养基冷却至50℃以下,加入过滤好的混合烃混匀后迅速倒平板,抽取20 μL前期厌氧富集的培养物涂板,密封,将平板倒置于厌氧培养袋中,放入产气包以吸收袋内残余氧气,将其置于32℃培养箱中培养。此操作在厌氧操作箱内完成。1周左右培养皿中长出菌落,挑取单菌落进行三区划线获得纯培养菌株。
2.4.2 分离纯菌的分子生物学鉴定
纯菌DNA使用赛百盛细菌基因组DNA提取试剂盒进行提取。利用细菌16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和 1492R(5′-ACGGCTACCTTGTTACGACT-3′)对 16S rRNA 全长进行扩增,PCR产物送至厦门铂瑞测序部进行测序。将16S rRNA 基因序列拼接后上传至EzBioCloud(https://eztaxon-e.ezbiocloud.net/)与数据库中的序列进行比对,确定与其最为相近的模式菌株[23]。
2.4.3 烷烃和芳烃的降解率测定
使用 Medium 63培养基测定单菌对烷烃和芳烃的降解率,分别加入二十四烷和菲作为碳源进行培养。每种碳源在每个时间段设置3个平行,分别在0 d、15 d、30 d、45 d、60 d对培养基内剩余未利用碳源进行萃取。通过正己烷萃取收集培养液中的烃类,加入无水硫酸钠进行除水,再用正己烷稀释适当倍数。经0.22 μm孔径聚酰胺微孔滤膜过滤后,将其转移至2 mL顶空瓶上机进行GC-MS检测,测定样品中各类碳源的剩余量以计算降解率。
3 结果
3.1 原位样本和厌氧富集菌群的细菌α多样性
在样本厌氧富集过程中加入混合烃作为碳源,硫酸盐作为电子受体,每隔1个月进行一次稀释传代培养。在经过8个月的培养后,烃类降解实验验证发现富集物中有稳定的烃降解菌群的存在。收集此时的菌群样品作为富集样本,进行扩增子测序。使用Uprase[24]对测序、拼接后获得的序列进行聚类,共获得711 293条序列。
稀释曲线表明随着读数的增加,原位和富集样本的Richness指数上升幅度趋于平缓,该测序深度已经能够较为精确地反映样品中的多样性趋势(图1)。Ace指数和Chao1指数是估计群落中含有OTU数目的指数,相比于原位样本,富集样品的Ace指数和Chao1指数都有所下降,代表群落中物种数量下降,不能在厌氧条件下利用烃的细菌被逐渐淘汰。Shannon指数和Simpson指数是衡量群落物种多样性的指数,也是物种丰富度和物种均匀度的综合指标。Shannon指数越大,说明群落多样性越高。Simpson指数值越大,说明群落多样性越低。可以看出富集样品细菌群落的多样性在不断降低,这表明细菌种类在减少,菌群趋于单一,不能适应环境的细菌被逐渐淘汰,保留下来的可能是直接或间接参与厌氧硫酸盐还原的烃降解菌(图2)。
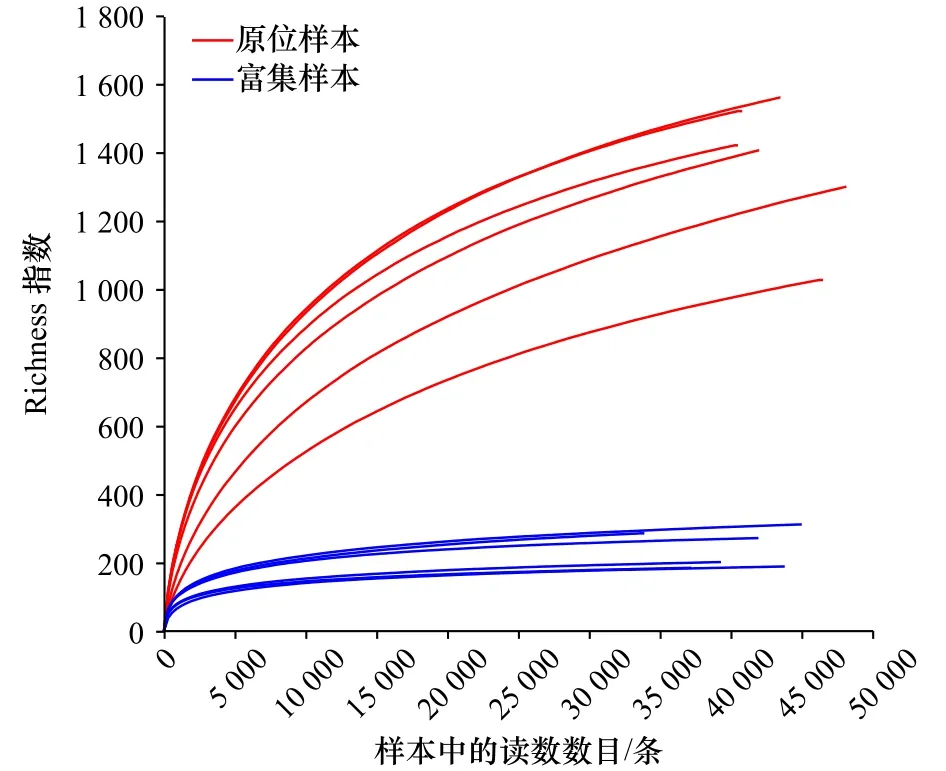
图1 原位和富集样本的细菌序列稀释曲线Fig.1 Rarefaction curves of bacterial sequences for in situ and enriched samples

图2 原位和富集样本的细菌Alpha多样性Fig.2 Bacterial Alpha diversity for in situ and enriched samples
按照97%的相似性阈值将序列聚类为不同的OTUs,OTU通常被视为微生物分类学分析的物种单元,我们使用Sliva数据库对每一个OTU的代表序列进行了注释,结果表明,原位6个样品所获得的细菌序列归属细菌域的55个门,124 个纲,267个目,364个科,564个属和997个种。通过细菌物种组成分析,原位样品中弯曲杆菌门(Campliobacterota)丰度最高,在6个样品中相对丰度为8.2%~63.9%。此外,门水平上相对丰度大于1%的还包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、脱硫杆菌门(Desulfobacterota)、绿 弯 菌门(Chloroflexi)、 厚 壁菌门(Firmicutes)和酸杆菌门(Acidobacteriota)。从属水平来看,原位样品中优势的种属为硫单胞菌属(Sulfurimonas)和硫菌属(Sulfurovum),相对丰度均超过10%,其他相对丰度超过1%的优势菌属还包括:黄杆菌属(Lutibacter)、海杆菌属(Marinobacter)、盐水微菌属(Salinimicrobium)、需盐杆菌属(Salegentibacter)、伍斯菌属(Woeseia)和盐单胞菌属(Halomonas)(图3)。
相较于原位样本,加入混合石油烃为碳源的富集样本中细菌的种类和数量都发生了较大的变化。6个富集样本中所获得的细菌序列归属于细菌域的31个门,56个纲,88个目,111个科,159个属和239个种,远低于原位样本中的细菌种类。在门水平上,最优势菌群由弯曲杆菌门转变为脱硫杆菌门,其相对丰度达到30%以上,拟杆菌门 在富集样本中的丰度也提高到10%以上。科水平上的优势菌为脱硫叠球菌科(Desulfosarcinaceae),其相对丰度大于20%;海洋滑动菌科(Marinilabiliaceae)和脱硫杆菌科(Desulfobacteraceae)的相对丰度也高于5%(图3)。其中,脱硫叠球菌科和脱硫杆菌科为典型的SRB,在厌氧条件下被证明是耦合硫酸盐还原降解丁烷和十二烷的主要参与者[25]。海洋滑动菌科(Marinilabiliaceae)大部分为专性厌氧或兼性厌氧菌,目前关于其对石油烃的利用未见报道,但根据海洋滑动菌科中已报道的单菌推测此类群可以利用硫酸盐或者亚硫酸盐作为电子受体[26],在厌氧环境中可能具有降解有机物的潜在能力,能够直接降解烃或者利用烃降解过程的中间代谢物进行传代生长。

图3 原位和富集样本中不同分类水平的细菌群落组成柱形图Fig.3 Barplots of bacterial community composition at different taxonomic levels in in situ and enriched samples
3.2 原位样本和厌氧富集菌群的细菌β多样性
β多样性是度量不同样本(组)间菌群组成的相似度大小、菌群组成与分布差异的参数。主坐标分析 (Principal Co-ordinates Analysis, PCoA),是一种非约束性的数据降维分析方法,可用来研究样本群落组成的相似性或差异性。我们采用基于Weighted UniFrac的PCoA方法分析样本间的组成差异(图4)。PCoA图显示原位样本之间的距离大于富集样本之间的距离,原位样本彼此之间较为离散,而富集样本之间更聚集,这说明原位样本间的细菌组成存在较大差异性,而在富集样本中差异性较小。且原位样本与富集样本在图中分散两侧,说明经过石油烃富集后的富集样本与原位样本之间的菌群组成已存在差别。
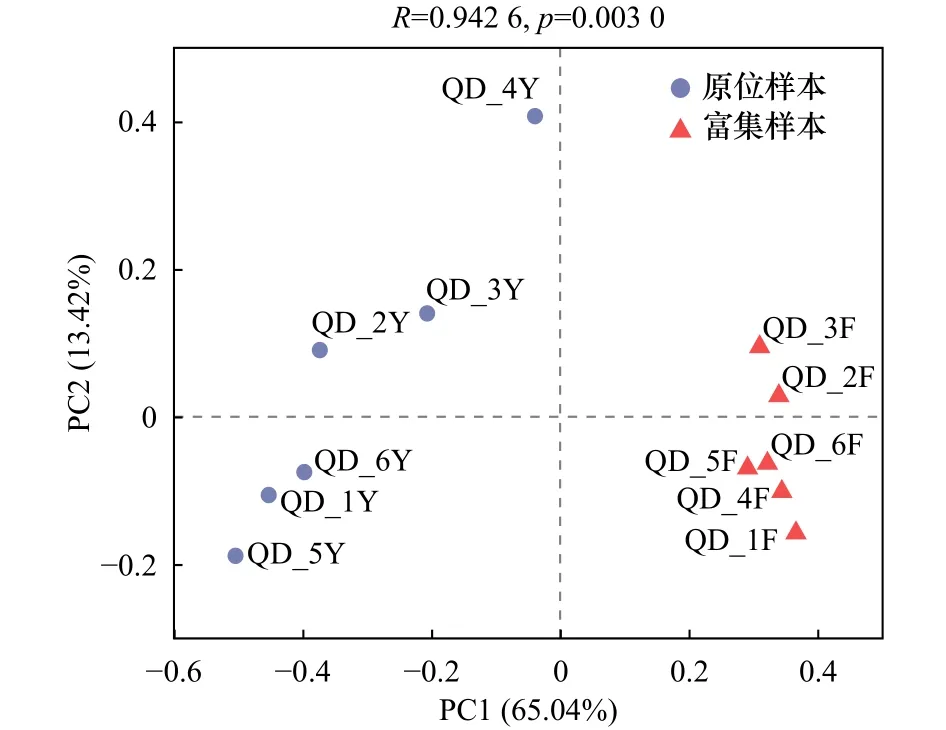
图4 基于Weighted UniFrac的PCoA结果Fig.4 Results of PCoA based on Weighted UniFrac
采用“wilcoxon秩和检验”双尾检验方法,基于样本中群落丰度数据,比较原位和富集样本细菌群落中表现出的丰度差异的物种,进行假设性检验。由图5可以看出,在95%的置信区间内,门水平上的原位和富集样本间菌群分布和丰度存在较大差异,其中脱硫杆菌门在富集样本中的比例明显上调,而弯曲杆菌门和变形菌门所占比例大幅下降,在原位和富集样本间的相对丰度存在显著差异(p<0.05)。
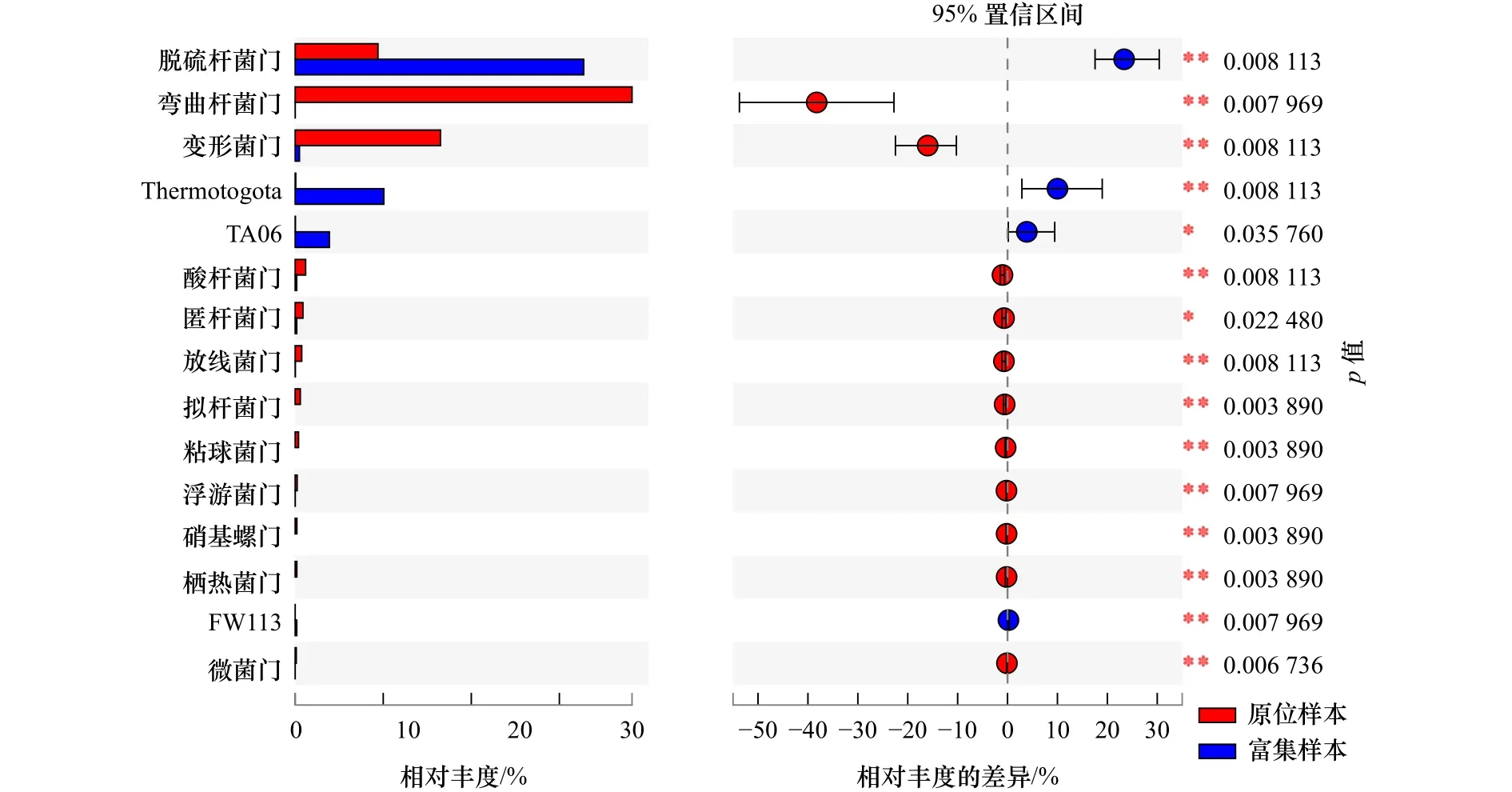
图5 原位和富集样本组间群落丰度显著性差异检验Fig.5 Test for significant differences in community abundance between in situ and enriched sample groups
3.3 菌株ND17的分离及系统发育分析
在进行厌氧纯菌分离时,观察厌氧瓶内有黑色的硫化亚铁沉淀生成,打开厌氧瓶的橡胶塞时有硫化氢的气味。这些都是典型的硫酸盐还原菌的特征。
平板培养时发现部分菌落为黑色圆点,多生长在平板内部,革兰氏染色阴性,长度为2 μm 左右,长杆状,有鞭毛,能够自由活动。提取菌株DNA,将扩增后的16S rRNA产物进行测序。测序结果与Ezbio-Cloud网站上的序列比对,发现其与菌株脱硫弧菌Desulfovibrio subterraneusHN2T的16S rRNA基因序列的相似性为99.93%,平均核苷酸(ANI)值为98.46%。通过 MEGA-X软件[27]采用邻接法(Neighbor-joining)[28]构建系统发育树,菌株ND17与Desulfovibrio subterraneusHN2T聚类在一起且形成稳定的分支(图6)。

图6 菌株ND17基于16S rRNA基因序列的系统发育分析Fig.6 Phylogenetic analysis of strain ND17 based on 16S rRNA gene sequences
3.4 Desulfovibrio subterraneus ND17的烃降解率
为进一步表征Desulfovibrio subterraneusND17对烃类的利用效果,长链烷烃以二十四烷为代表,多环芳烃以菲为代表,分别测定了ND17对两者的降解速率。并且为了验证厌氧烃降解和硫酸盐还原之间的耦联情况,在对照组内加入20 mmol/L的钼酸钠,其他条件不变。钼酸钠是硫酸盐还原菌的竞争性抑制剂,可以抑制电子传递给硫酸钠,从而解除厌氧烃降解与硫酸根还原的耦合关系,可作为烃降解组的对照。没有钼酸钠的实验组电子传递过程可以进行,烃降解正常进行,硫酸根得到电子发生还原反应。经过测定,菌株ND17在两个月内对于菲的降解率可达到35.7%,对于二十四烷的降解率可达53.9%,而对照组碳源浓度则没有明显变化(图7)。
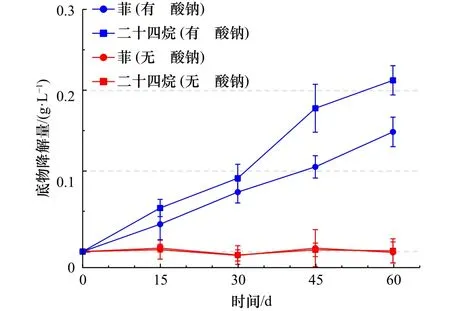
图7 菌株ND17对菲和二十四烷的降解速率的测定Fig.7 Determination of degradation rates of phenanthrene and eicosanoids by strain ND17
4 讨论
微生物降解石油烃在海洋沉积物、石油污染海域、原油和废水等生境中一直发挥着巨大的作用[4,29]。Lü等[30]曾测量了多种PAHs在国内海岸线潮间带沉积物样品中的分布情况,结果表明,多环芳烃的疏水性使其很容易在潮间带地区沉积,在沉积物中的总浓度可以达到2.3~1 031.7 ng/g(干重)。然而在潮间带地区降解长链烷烃和三环以上(包括菲)PAHs厌氧菌的种类和群落结构仍鲜有报道,对于在严格厌氧条件下烃降解菌的分离和培养仍是难题。Qian等[31]曾发现脱硫弧菌属(Desulfovibrio)和石化菌属(Petrimonas)可以协同降解菲,并未分离脱硫弧菌的单菌进行研究。Zhang等[32]曾报道分离出一株可以利用硫酸盐作为电子受体厌氧降解菲的硫还原地杆菌(Geobacter sulfurreducensstrain PheS2),是第一株分离到的可以耦合硫酸盐还原降解菲的纯菌株。由此可见,厌氧条件下对于高环芳烃降解菌的分离与培养仍然为热点和难点。好氧菌在近海表层沉积物石油烃的降解中起主要作用,但深入表层以下沉积物中的石油烃必须经过厌氧微生物的降解过程去除。
本次研究对青岛女岛湾潮间带地区深层沉积物进行厌氧富集,经高通量测序后对原位和富集样本的细菌多样性进行了分析。相比于原位样本,富集样本中细菌的种类和数量明显减少,与原位样本的群落组成有着较大的差异性,优势菌群也转变为以脱硫叠球菌科和脱硫杆菌科为主的硫酸盐还原菌,所占比例达35%。在此前研究中,Kleindienst等[25]通过高通量测序和同位素标记实验揭示了脱硫杆菌科中存在4个SRB的分支,在丁烷和十二烷的降解中发挥着主要作用。这也暗示SRB是一类重要的厌氧烃降解菌,其降解范围广泛。菌株ND17作为一种典型的SRB,表现出对于烷烃和多环芳烃的降解并耦合硫酸盐还原的能力。在最开始的分离过程中,由于分离培养基的限制以及无法模拟原位条件和每种菌的适宜培养条件,分离鉴定出来的菌比较有限,主要包括变形菌门、厚壁菌门以及放线菌门的部分菌种。经后续实验验证,发现菌株ND17对各种烃类的响应时间明显短于其他菌株,有较广的石油烃降解范围,并能利用Fe3+和AQDS作为电子受体降解长链烷烃。此外,脱硫弧菌科在原位样本中的丰度达到5%,这也表明脱硫弧菌类群在复杂的潮间带沉积物环境中,具有降解各类有机物适应环境的潜力。
脱硫弧菌属除了石油烃降解的能力,还在沉积物中木质素、几丁质和纤维素的降解中发挥了重要作用。孙超等[33]在对漳州九龙江河口红树林沉积物中降解纤维素、几丁质和木质素的厌氧细菌定向富集和平板分离纯化的研究中发现,脱硫弧菌属在降解木质素的优势菌属中占比为22.1%,在降解几丁质的优势菌属中占比为9.6%;齐明明等[34]在对厦门观音山潮间带海水和沉积物环境利用以鱼鳞、海带叶片、虾壳、几丁质和壳聚糖为有机底物进行富集时发现,脱硫弧菌属也占到了较高的比例,结合本文研究,可以推测脱硫弧菌属在多种难降解有机物和石油烃类等污染物的利用中都发挥了较大的作用。
