红枣多酚提取工艺优化、成分及抗氧化活性分析
2022-08-16刘慧燕方海田胡海明辛世华杨小萍刘洪涛
马 妮,刘慧燕, ,方海田,,胡海明,辛世华,杨小萍,刘洪涛
(1.宁夏大学食品与葡萄酒学院,宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川 750021;2.宁夏工商职业技术学院旅游管理学院,宁夏银川 750021;3.湖北中医药大学基础医学院,湖北武汉 430065)
红枣(Ziziphus jujubaMill.)属鼠李科,是已知最古老的药用植物之一[1],作为最大的枣生产国,中国每年生产约45 万吨红枣,生产量占全球的90%[2]。我国的枣树大部分种植在北方地区,其中宁夏为红枣的传统栽培区之一[3],且宁夏红枣因其独特的风味和高营养价值而备受推崇[4]。最近的研究表明,枣果实含有多种功能性化合物,如VC、氨基酸、三萜酸、多糖和多酚等[5-6],红枣多酚作为红枣中主要的活性成分之一,具有抗氧化、心脏保护、抗癌、抗炎、抗衰老和抗菌等多种生物活性[7-9]。
酚类物质是植物为保护自身免受环境压力而产生的二次代谢物,具有很强的抗氧化活性,其能够补充和增加抗氧化维生素和酶的功能,对过量活性氧引起的氧化应激具有一定的防御作用[10],而人类摄入富含多酚的食物,可改善血管健康,从而显著降低高血压和心血管疾病的发生风险[11]。目前国内外对红枣的研究多集中在红枣多糖、红枣益生菌发酵产品等,而对于红枣多酚的相关研究较少。随着科学技术的发展,多酚物质的提取方法得到不断优化,提取多酚常见的方法主要有水提法、有机溶剂提取法、酶解法、超声波辅助提取法、微波辅助提取法、超临界流体萃取法等[12-13],而超声波以其高效简便、绿色安全等优点而被广泛应用,刘皓涵等[14]经超声辅助酶解提取工艺提取欧李多酚,提取量为42.63 mg/g;谢佳函等[15]采用超声辅助提取工艺使得红豆皮中的多酚化合物提取量增大为(145.28±2.21)mg/g。
为高效获取红枣多酚,本文通过超声波辅助提取法研究红枣多酚的提取工艺,采用单因素实验和响应面试验设计,考察甲醇浓度、超声时间、超声温度、料液比对红枣多酚得率的影响,具有时间短、操作简单、提取量高等优点。利用高分辨液-质联用仪测定红枣多酚组成成分,并通过检测其对DPPH 自由基和超氧阴离子自由基的清除作用评价其抗氧化活性,旨在为红枣多酚类物质的提取、分析及红枣资源的充分开发利用提供理论参考,从而提高红枣资源的利用率。
1 材料与方法
1.1 材料与仪器
宁夏灵武长枣 将红枣去核切片后进行干燥,用振动式药物超微粉碎机粉碎成红枣粉末,常温避光储藏,市售;福林酚试剂、无水碳酸钠 国药集团化学试剂有限公司;D101 大孔吸附树脂 东鸿化工有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、吩嗪硫酸甲酯(PMS)、VC、氯化硝基四氮唑蓝(NBT)、没食子酸、还原型辅酶Ⅰ(NADH)阿拉丁试剂(上海)有限公司。
LTQ Orbitrap XL Domain35A 高分辨液-质联用仪 Theromo Fisher 公司;Spectra Max iD 3 多功能酶标仪 美谷分子仪器(上海)有限公司;WZJ-30 振动式药物超微粉碎机 济南天方机械有限公司;OSB-2200 旋转蒸发仪 上海爱朗仪器有限公司;具四氟节门层析柱(Φ4.6 cm×45.7 cm)欣维尔;SHZD(Ⅲ)循环水式多用真空泵 郑州科达机械仪器设备有限公司;BTP-9EL00X 冷冻干燥 德祥科技有限公司;超声波清洗器 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 没食子酸标准曲线的绘制 参照Mosic 等[16]的方法略有修改,配制0.1 mg/mL 没食子酸溶液,得对照品溶液。向10 mL EP 管中分别移入0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mL 对照品溶液,补加1 mL H2O 后加入0.5 mL 福林酚试剂,混合均匀后静置4 min,再加入1.5 mL 10%碳酸钠溶液,随后补加蒸馏水使得总反应体系为5 mL。在45 ℃下恒温水浴1 h,于760 nm 处测量样品的吸光值,绘制样品标准吸收曲线,得到标准曲线回归方程:y=5.6093x+0.0556,R2=0.9992。
1.2.2 红枣多酚的提取及测定 选择提取溶剂为70%甲醇溶液,称取10 g 红枣粉末,设置一定的超声温度、超声时间、料液比进行提取,5000 r/min、4 ℃离心15 min 后转移上清,于旋转蒸发仪浓缩至50 mL,以便于后续红枣多酚得率的测定。
将提取的红枣多酚粗提液按照合适比例稀释后,以1.2.1 方法测量吸光度,根据下式(1)计算多酚得率:

式中:C 为红枣多酚质量浓度(mg/mL);V 为粗提液的体积(mL);N 为稀释的倍数;m 为红枣枣粉质量(g)。
1.2.3 红枣多酚提取单因素实验 根据1.2.2 的方法,将超声温度(30、40、50、60、70、80 ℃)、超声时间(10、20、30、40、50、60 min)、料液比(1:10、1:20、1:30、1:40、1:50、1:60 g/mL)、甲醇浓度(40%、50%、60%、70%、80%、90%)作为单因素条件,探究其对红枣多酚得率的影响,每组实验重复3 次。试验过程中的不变水平值为:甲醇浓度80%,超声温度50 ℃,超声时间30 min,料液比1:30 g/mL。
1.2.4 红枣多酚提取响应面优化试验 在单因素实验的基础上,采用Design-Expert 8.0.6 响应面设计软件(具体因素按照表1)进行四因素三水平Box-Behnken 响应面优化试验。

表1 Box-Behnken 因素水平设计Table 1 Factors and levels of Box-Behnken design
1.2.5 红枣多酚分离纯化 采用D101 大孔树脂湿法装柱,将红枣多酚粗品按照1:2 的比例用100 g D101 大孔树脂(湿重)过柱子进行纯化[17]。控制样液流速3 mL/min,先用去离子水洗至洗脱液无多糖、色素、蛋白质等杂质,再用75%乙醇进行多酚化合物的洗脱,洗脱流速2 mL/min,直至洗脱液不含有多酚类物质[18]。将乙醇洗脱液收集,转移到旋转蒸发仪减压浓缩至相应体积,取出样品置于-80 ℃预冻后进行真空冷冻干燥,收集干燥样品,于干燥器内密封保存。
准确称取少量纯化后的红枣多酚粉末,加入蒸馏水用玻璃棒搅拌至溶解后用50 mL 容量瓶定容,得到备用液。按下式(2)计算多酚纯度:

式中:C 为备用液浓度(mg/mL);V 为多酚定容体积(mL);M 为纯化后红枣多酚干重(mg)。
1.2.6 红枣多酚组成的液质分析
1.2.6.1 样品前处理 称取10 mg 纯化后的红枣多酚提取物,得到1 mg/mL 以甲醇为溶剂的样品溶液,用0.22 μm 微孔滤膜过滤,最后保存于棕色瓶中备用。
1.2.6.2 色谱条件 Agilent EC-C18色谱柱(4.6 mm×150 mm,2.7 μm);流动相A 为0.1%甲酸溶液;流动相B 为乙腈;柱温30 ℃;进样量5 μL[19];梯度洗脱条件见表2。
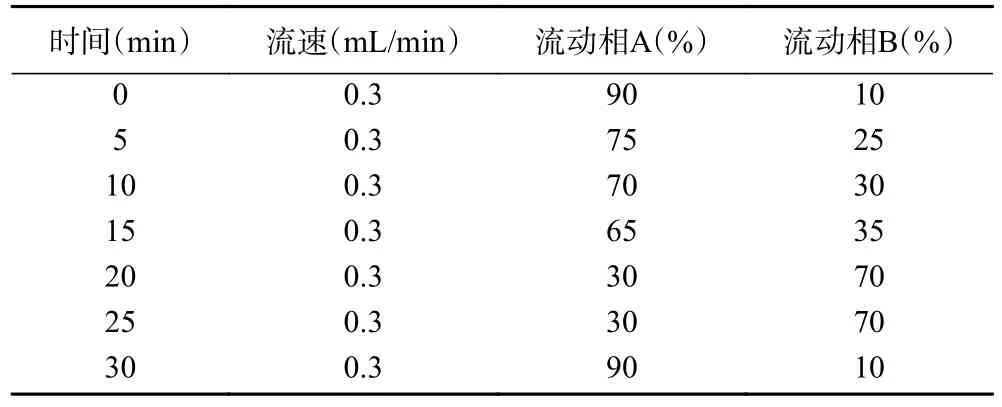
表2 梯度洗脱程序Table 2 Gradient elution procedure
1.2.6.3 质谱条件 电喷雾ESI 离子源;负离子模式,多反应监测模式MRM;雾化气为氮气;雾化气温度350 ℃;干燥气温度350 ℃;干燥气流速6 L/min;喷雾器压力35 psi;V cap 电压3500 V;雾化气流速9 L/min;碰撞电压1000 V;扫描范围设置为m/z 100~2000[19]。
1.2.7 红枣多酚抗氧化能力的测定
1.2.7.1 DPPH 自由基清除能力测定 参考Bai 等[20]报道方法略有修改,先配制不同浓度梯度(0、0.05、0.1、0.2、0.3、0.5、0.7、0.9、1.0 mg/mL)的多酚样品溶液和VC溶液,后配制0.1 mmol/L 的DPPH 甲醇溶液,在试管中先加入2 mL DPPH 甲醇溶液再加入2 mL 多酚样品溶液,混匀后置于37 ℃,避光反应30 min,结束后测定517 nm 处吸收值,计算DPPH自由基的清除率。
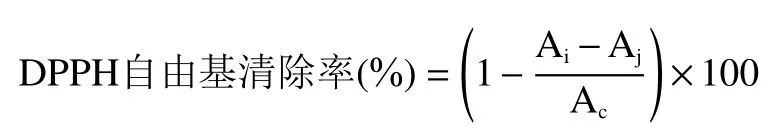
式中,Ac:2 mL 蒸馏水+2 mL DPPH 甲醇溶液的吸光值;Ai:2 mL 样品溶液+2 mL DPPH 甲醇溶液的吸光值;Aj:2 mL 样品溶液+2 mL 甲醇的吸光值。
1.2.7.2 超氧阴离子自由基清除活性测定 参考秦裕景[21]报道方法略有修改,向96 孔板中依次加入50 μL 338 μmol/L NADH 溶液和50 μL 30 mmol/L PMS 溶液,充分混匀后加入50 μL 72 μmol/L NBT溶液,混匀后加入50 μL 不同浓度梯度(0、0.05、0.1、0.2、0.3、0.5、0.7、0.9、1.0 mg/mL)的样品溶液和VC溶液,再次混匀,室温反应15 min 后用酶标仪在560 nm 处测定其吸光值,记为As,用相同体积的PBS 溶液代替样品溶液,测定其吸光值,记为Ac。

式中,Ac:对照吸光度;As:样品吸光度。
1.3 数据处理
所有实验均重复3 次,采用Prism 8.0.2 和Design Expert 8.0.6 进行数据的处理和绘图分析,使用MestReNova14.2.0 进行质谱数据分析。
2 结果与分析
2.1 红枣多酚提取工艺优化
2.1.1 单因素实验
2.1.1.1 超声提取温度对多酚提取的影响 如图1,温度的升高可以很好的促进多酚的溶出,当超声提取温度为50 ℃时,多酚得率最高。但温度高于此温度后,红枣多酚的得率却有所降低。这是由于过高的提取温度会导致多酚类物质分解,同时温度过高还会加快多酚的氧化速度,破坏酚类物质的空间结构,从而导致红枣多酚得率降低[22]。因此50 ℃为最佳提取温度。
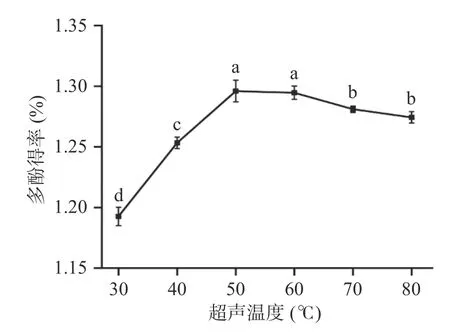
图1 超声温度对多酚得率的影响Fig.1 Effect of ultrasonic temperature on polyphenol yield
2.1.1.2 超声提取时间对多酚提取的影响 如图2,随着处理时间的延长,多酚得率呈线性增大,当处理时间为40 min 时,多酚得率最高。分析原因可能是随着处理时间延长,枣粉与提取剂接触更加充分,并伴随超声产生机械效应,使得多酚可以更加有效地从枣粉中释放出来[22],因此多酚得率在提取时间为40 min 时达到最大。但继续延长超声时间,多酚得率并未继续增加,推测超声过程中多酚类物质已经基本被释放出来,且在提取过程中多酚会与空气接触,空气中的氧气会破坏酚类物质,氨基酸、多糖等其他物质也会被释放,导致多酚得率降低[23]。因此40 min为最佳超声提取时间。
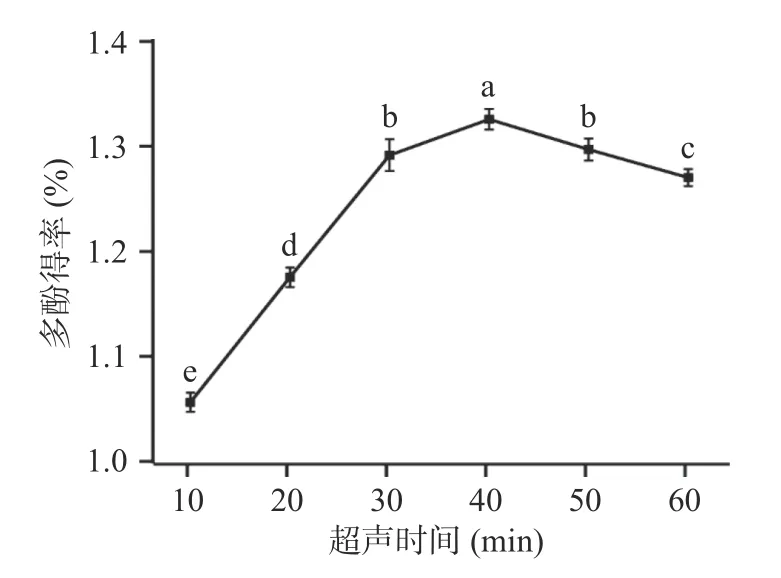
图2 超声时间对多酚得率的影响Fig.2 Effect of ultrasonic time on polyphenol yield
2.1.1.3 料液比对多酚提取的影响 如图3,随着料液比增大,红枣多酚的得率会逐渐增大。当料液比为1:40(g/mL)时,多酚得率最大,继续增大料液比,多酚得率未增加。推测适当的料液比可使物料之间的接触面积增大,多酚类物质能够充分的溶出,但达到最佳料液比后,红枣中的酚类物质基本上被释放,即使继续增加料液比,也不会提高多酚的得率,反之,溶剂的增多还会导致红枣中其它醇溶性成分溶出,阻碍了多酚成分的继续释放。进一步考虑,溶剂体积过大会导致空气中的氧气进入溶剂,随着氧气增多,提取出的多酚会被氧化,而且溶剂用量过多在后续处理过程中会增加回收难度,同时减少溶剂的使用利于节能环保。因此1:40(g/mL)为最佳液料比。

图3 料液比对多酚得率的影响Fig.3 Effect of material-liquid ratio on polyphenol yield
2.1.1.4 甲醇体积分数对多酚提取的影响 如图4,甲醇浓度增加,红枣多酚得率增加,当甲醇浓度达到70%时,红枣多酚得率达到最高,继续增加甲醇浓度红枣多酚得率不再增加,而是降低后趋于平缓,说明溶液中多酚类物质达到饱和状态。而且甲醇浓度过高导致反应环境极性降低,其他物质也可能被提取出来,不利于多酚的溶出[23],且甲醇浓度越高,提取成本越高。因此本实验最终确定甲醇浓度为70%。
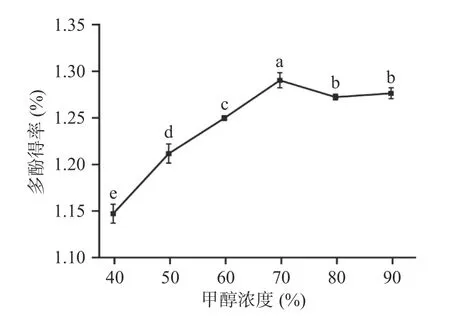
图4 甲醇浓度对多酚得率的影响Fig.4 Effect of methanol concentration on polyphenol yield
2.1.2 响应面法试验结果
2.1.2.1 响应面试验结果 综合考虑,在单因素实验的基础上,利用Box-Behnken 试验进行四因素三水平响应面优化分析,响应面试验分组及结果见表3,试验所得方差分析见表4。
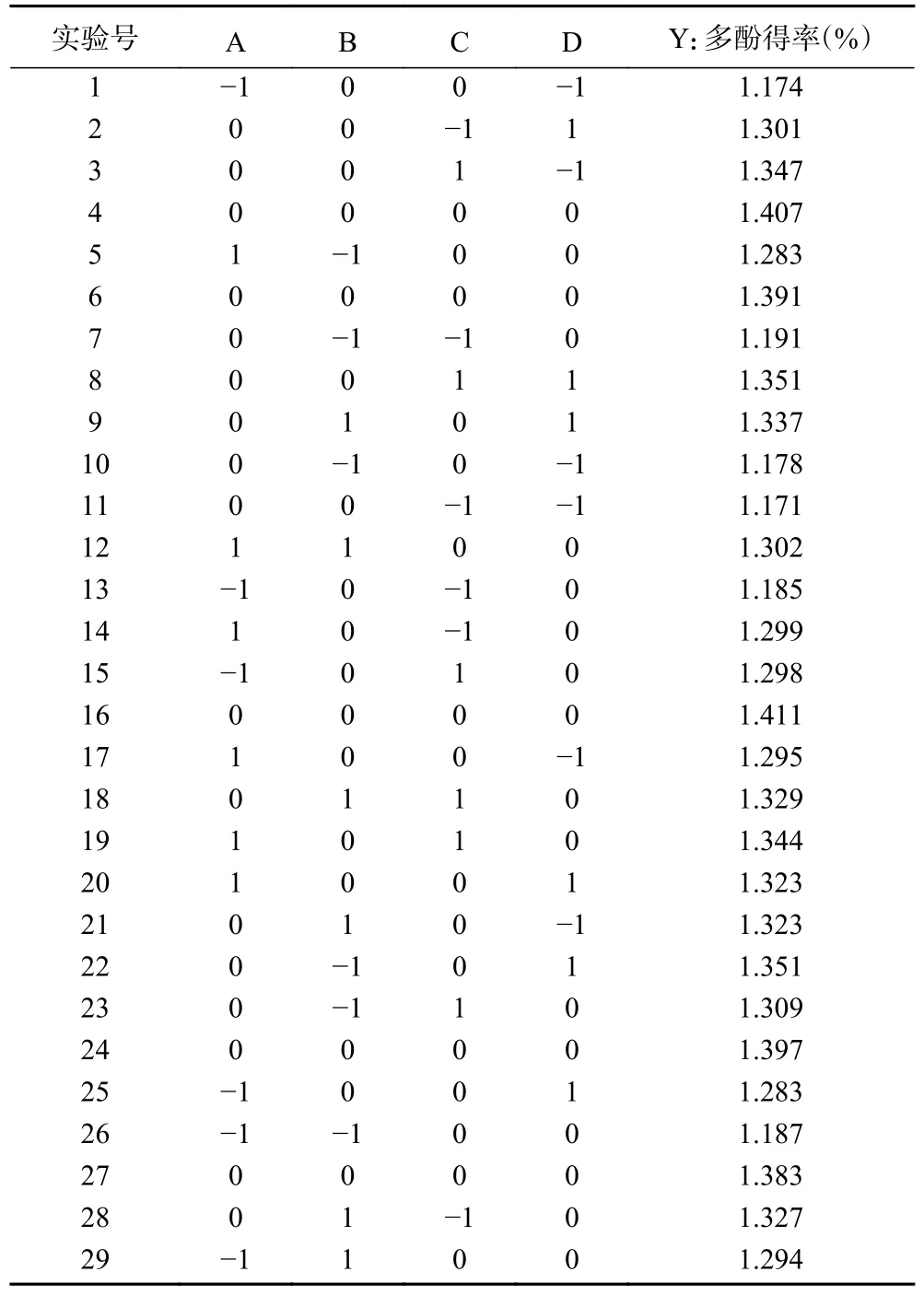
表3 Box-Behnken 试验方案及结果Table 3 Scheme and results of Box-Behnken test

表4 多酚得率的响应面试验方差分析Table 4 Analysis of variance of polyphenol yield for response surface experiment
以多酚得率为响应值,回归分析见表4,对各因素进行回归拟合后,得到编码值的回归方程为:
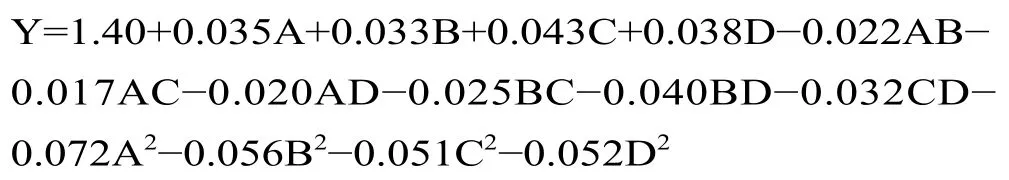
表3 为回归模型的方差分析,该模型F=43.26(P<0.0001),二次回归模型极显著,在统计学上有意义。失拟项(P=0.2425>0.05)不显著,没有产生失拟现象,说明该回归方程拟合度良好,表明模型合理。从表3 中分析可知该模型的校正系数R2=0.9774,由此可以表明该模型响应值的变化有97.74%是由所选因素引起的[24]。调整确定系数R2adj为0.9548,R2Pre为0.8848,差值小于0.2。结果表明红枣多酚提取过程中以多酚得率变化建立的该模型与实际情况的拟合程度较高,试验误差较小,利用响应面优化红枣多酚提取条件的实验方案是具有可行性。根据F值大小可知,各因素对红枣多酚得率影响的主次因素C>D>A>B,即超声温度>料液比>甲醇浓度>超声时间。
2.1.2.2 响应面优化与分析 根据回归方程,各因子间的响应面分析如图5、图6、图7 所示,3 个交互作用图的响应值都随变量的增大而不断增大,到达某一值后,响应值又随变量增加而减小,并且响应面图开口朝下,说明存在最大值;相应地,等差线图均呈现椭圆形,可以直观地看出各因素交互作用变化明显,对多酚得率的影响达到显著水平。
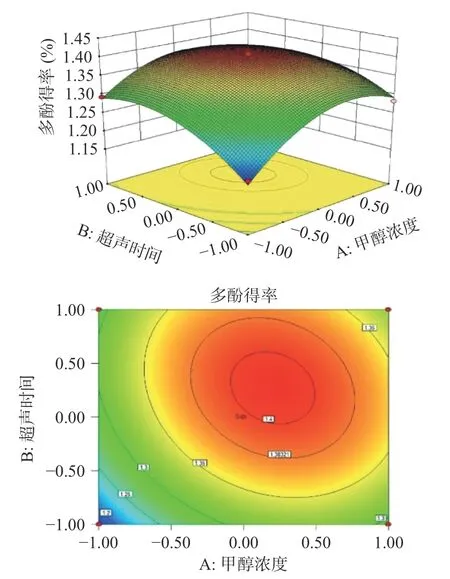
图5 超声时间和甲醇浓度对多酚得率影响的响应面和等高线Fig.5 Response surface and contour lines of the influence of ultrasonic time and methanol concentration on polyphenol yield
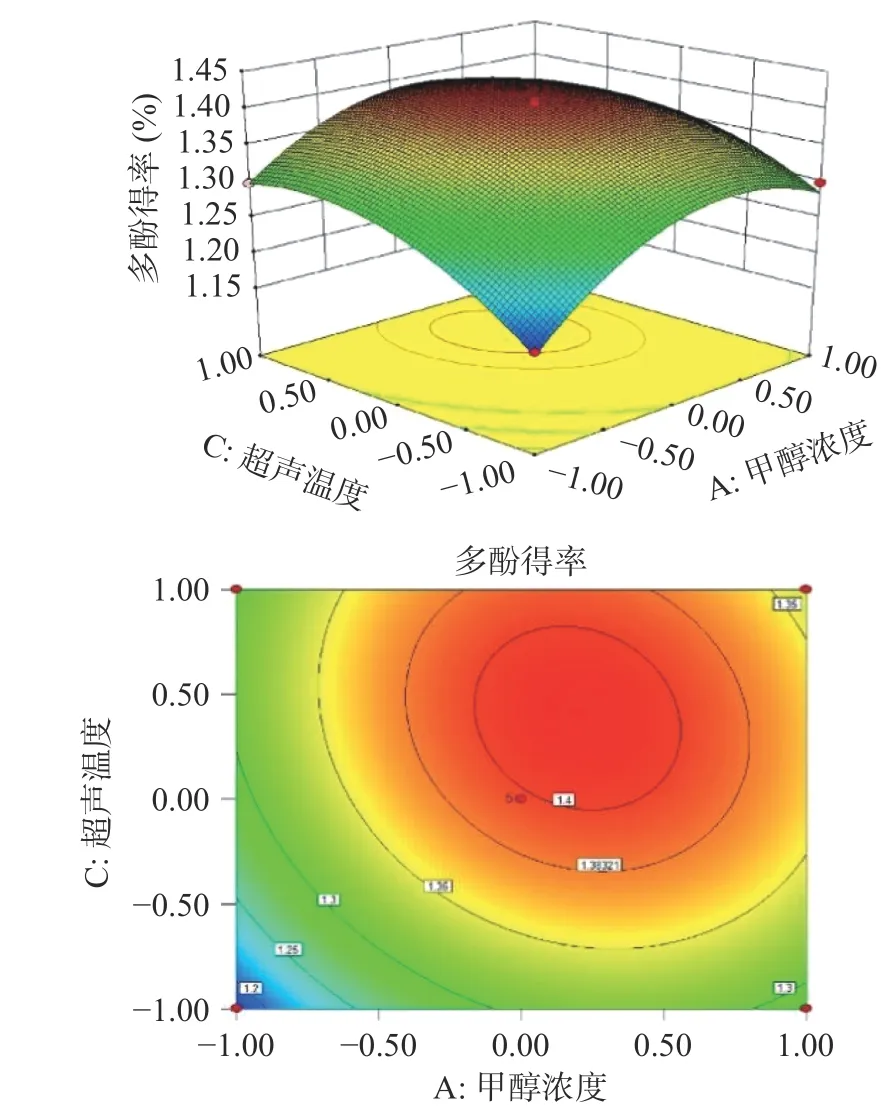
图6 超声温度和甲醇浓度对多酚得率影响的响应面和等高线Fig.6 Response surface and contour lines of the influence of ultrasonic temperature and methanol concentration on polyphenol yield

图7 料液比和甲醇浓度对多酚得率影响的响应面和等高线Fig.7 Response surface and contour lines of the effects of solid-liquid ratio and methanol concentration on polyphenol yield
对响应面结果进行优化分析,得到红枣多酚提取的最佳工艺条件为:甲醇浓度71.62%,超声时间41.25 min,超声温度63.04 ℃,料液比1:41.96(g/mL),在此条件下得到的多酚得率预测值为1.413%。本文使用超声波辅助提取红枣多酚,对超声时间和甲醇浓度进行了优化,为了验证模型预测理论值的准确性和真实性,同时为了方便实际操作,将最佳提取工艺的条件进行调整:甲醇浓度70%,超声时间40 min,超声温度60 ℃,料液比1:40(g/mL)。在此优化条件下进行3 次平行试验,得到多酚得率为1.397%±0.08%。与理论预测值基本接近,说明响应面优化得到的提取条件具有一定的可行性。
2.2 大孔树脂纯化结果分析
本文使用D101 大孔树脂对红枣多酚粗品进行纯化,红枣多酚粗品纯度为6.19%,本文使用D101大孔树脂对红枣多酚粗品进行纯化,经纯化后纯度为27.57%,较纯化前提高了4.45 倍。尝试将红枣多酚液体用AB-8 大孔树脂纯化,用聚酰胺树脂进行二次纯化,这些方法均不能提高红枣多酚纯度,原因可能是红枣多酚进行一次纯化后再进行二次纯化,会由于暴露时间过长,与空气中的氧气接触就越充分,从而导致红枣多酚被氧化降解。
2.3 红枣多酚组成分析
本试验采用负离子模式对红枣中提取成分进行扫描,图8 是样品在负离子模式下的质谱总离子流图(total ion chromatogram,TIC)。
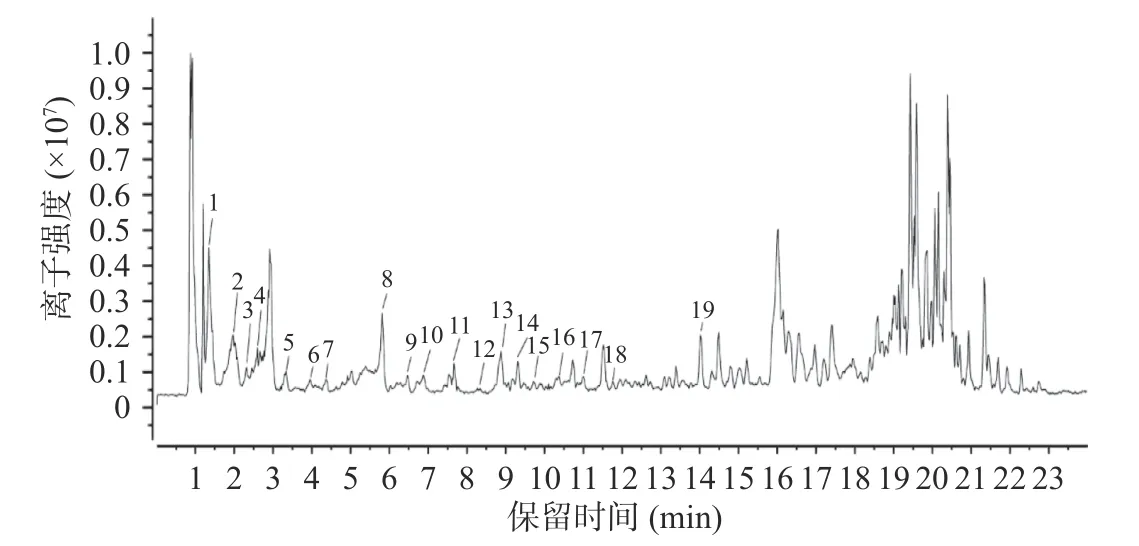
图8 总离子流图Fig.8 Total ion flow diagram
结合红枣多酚总离子流色谱图,成分的鉴定从多个电子数据库获得,包括HMDB、MassBank 和mzCloud。将谱图信息与从电子数据库收集的信息相匹配,再结合现有研究报道,本实验共鉴定出19 种化合物(见表5),包括酚酸及其衍生物、黄酮类化合物和三萜类化合物。

表5 负离子模式下红枣多酚鉴定出的成分分析结果Table 5 Analysis results of identified components of jujube polyphenols in negative ion mode
如图8,保留时间在18~21 min 为溶剂峰,其余未标注的为数据库未匹配到的化合物或现有文献未报道的化合物。由于多酚类化合物分子量范围较大,仅仅依靠HPLC-MS 无法准确的推测化合物类型,需进一步分析化合物的碎片离子以此推测化合物,同时对于多酚类物质的空间构象和基团之间的连接方式也不能给出准确信息,因此为了更加准确鉴定红枣多酚的组成成分及其结构还需采用其他更为先进的分析鉴定技术。本实验仅对红枣多酚做了一级质谱的测定,对其组分也只是做了初步推断,并没有对二级质谱中的碎片信息以及裂解规律进行分析,为了准确确定红枣多酚中化合物的种类,进行二级质谱的测定很有必要。
2.4 红枣多酚抗氧化能力测定
2.4.1 DPPH 自由基清除能力 为了更好地验证酚类物质的抗氧化能力,本文采用DPPH 自由基清除率来评价红枣多酚的抗氧化活性。如图9所示,红枣多酚对DPPH 自由基具有一定的清除能力,但低于同浓度的VC。多酚浓度在0.05~0.3 mg/mL 范围内时红枣多酚对DPPD 的清除能力随浓度增大而增大,当多酚浓度为0.3 mg/mL 时清除能力最大,为77.63%,之后随着多酚浓度的增大,清除能力不再有较大的变化。吴本培等[32]在对3 种不同新疆红枣主栽品种的多酚粗提物抗氧化活性进行比较发现,3 种红枣多酚粗提物的不同部位均具有清除DPPH自由基的能力,其中哈密大枣在3 种枣品中抗氧化能力最优,其枣皮和枣肉的DPPH 自由基清除能力较为接近,为80.08%~82.22%,而枣核的清除能力最低,仅10.0%左右。

图9 红枣多酚及VC 对DPPH 自由基的清除作用Fig.9 Scavenging effect of jujube polyphenols and VC on DPPH free radical
2.4.2 超氧阴离子自由基清除能力 如图10 所示,在浓度为0.05 mg/mL 时,红枣多酚对超氧阴离子自由基的清除率为25.14%,而相同浓度下VC对超氧阴离子清除率为55.82%,且随着浓度的增大,清除能力逐渐增强;当浓度为1.0 mg/mL 时,红枣多酚对超氧阴离子自由基的清除率达最大,为82.48%,相同浓度下VC对超氧阴离子清除率为95.41%,说明红枣多酚虽然具有较好的体外清除自由基能力,但是其抗氧化活性仍要弱于VC。在张瑞妮等[33]对红枣多酚的体外抗氧化活性研究中发现,在浓度为0.2~1 mg/mL 范围内时,红枣多酚对羟自由基具有较强的清除作用,清除能力随其浓度的升高而增加,红枣多酚对超氧阴离子自由基的清除能力和同浓度的VC接近。
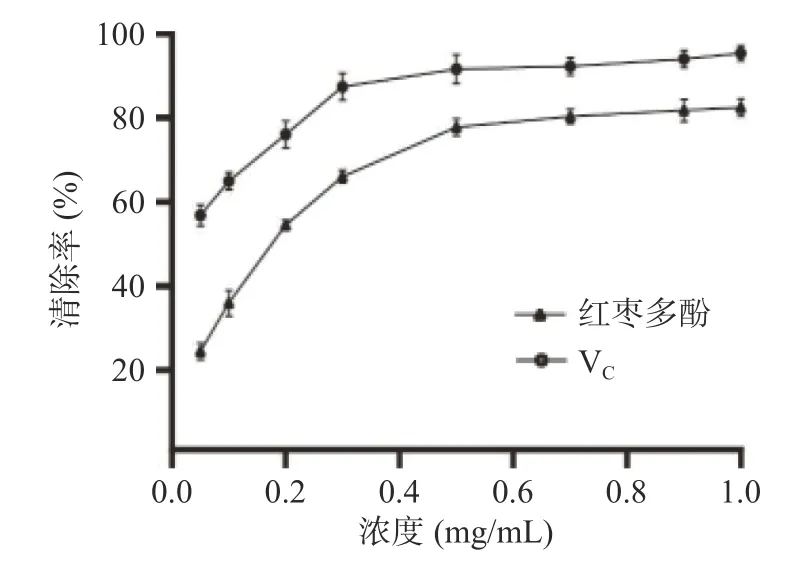
图10 红枣多酚及VC 对超氧阴离子自由基的清除作用Fig.10 Scavenging effect of jujube polyphenols and VC on superoxide anion free radical
3 结论
本实验选用宁夏灵武长枣为原材料,通过单因素实验结合响应面共同探索最优的红枣多酚提取条件,得到最佳提取工艺:甲醇浓度70%,超声时间40 min,超声温度60 ℃,料液比1:40(g/mL)。结果显示:红枣多酚得率为1.397%,红枣多酚粗品纯度为6.19%,经D101 大孔树脂分离纯化后,纯度为27.57%,较粗品提高了4.45 倍。抗氧化实验证明:红枣多酚对DPPH 自由基和超氧阴离子自由基具有清除作用,在一定质量浓度范围内表现出良好的抗氧化活性。通过HPLC-MS 对红枣多酚成分进行分析,共鉴定出19 种物质,其中包括酚酸及其衍生物、黄酮类化合物和三萜类化合物。本文可为红枣资源的开发利用提供理论基础,以此提高红枣的综合利用率,增加红枣的综合利用价值。但在本文中仍存在一些问题尚未解决,包括在分析红枣多酚成分时并未对其进行定量分析;在研究其抗氧化能力时未深入探究各成分对多酚抗氧化活性的贡献率,因此在今后可继续深入研究。
