肺癌相关Sweet综合征1例并文献回顾
2022-08-16陈宇晗念家云徐咏梅王笑民北京中医药大学研究生院北京0009北京中医医院肿瘤科北京0000
陈宇晗,念家云,高 宇,徐咏梅,富 琦,王笑民 (.北京中医药大学研究生院,北京 0009;.北京中医医院肿瘤科,北京 0000)
Sweet综合征是一种罕见的免疫系统疾病,又称急性发热性嗜中性皮病。1964年,Sweet[1]第一次描述Sweet综合征为一种突发性疾病。1986年,Su等[2]制定了2个主要标准和4个次要标准组成的诊断细则,1994年Von den Driesch据此修改,制定了目前被广泛接受的Sweet综合征诊断标准[3]。Sweet综合征大致分为三类:特发性Sweet综合征、副肿瘤性Sweet综合征、药物诱发的Sweet综合征。副肿瘤性Sweet综合征主要出现在急性髓性白血病患者中,在肺癌患者中十分罕见[4]。我们发现了1例肺癌相关Sweet综合征患者,该患者表现为瘙痒、无痛红斑,经类固醇激素治疗后好转,现报告如下。
1 资料与方法
1.1 临床资料
患者,男,65岁,因不明原因发热、关节痛、肌痛、结膜炎及颜面、颈、双臂、上身出现瘙痒性红疹(图1)于2020年8月就诊于当地医院。患者有长期的吸烟史和养鸽史。入院后被诊断为下呼吸道感染和左肺上叶占位,予头孢噻肟舒巴坦抗感染治疗,同时分别对肺部肿物及皮损进行病理活检,结果提示肺部低分化腺癌(形态类似淋巴瘤),皮肤活检提示真皮内血管周围炎(中性粒细胞聚集,T淋巴细胞及浆细胞浸润,部分血管扩张,局部出血)。虽然在抗感染治疗后患者体温略有下降,但很快反弹。2020年9月患者转至我院,病原学检查提示耐甲氧西林金黄色葡萄球菌感染、鲍曼不动杆菌感染和真菌感染;外周血常规:中性粒细胞占比88.3%,白细胞计数15.39×109/L~25.7×109/L;C-反应蛋白248.9 mg/L;降钙素原1.04 ng/mL;血沉105 mm/h。同时伴有低氧血症(动脉氧分压62.4 mmHg)、贫血(血红蛋白60 g/L)和低蛋白血症(白蛋白17.9 g/L)。胸部CT提示左肺上叶肿瘤35.4 mm×23.2 mm(cT2bN3M0:Ⅲb期)、双侧胸腔积液和双肺间质纤维化。排除成人Still病、淋巴瘤、多形性日光疹与皮肌炎后,病理会诊为真皮层中性粒细胞浸润及水肿(图2),符合Sweet综合征的特点,诊断为肺癌相关Sweet综合征。

图1 背部红斑
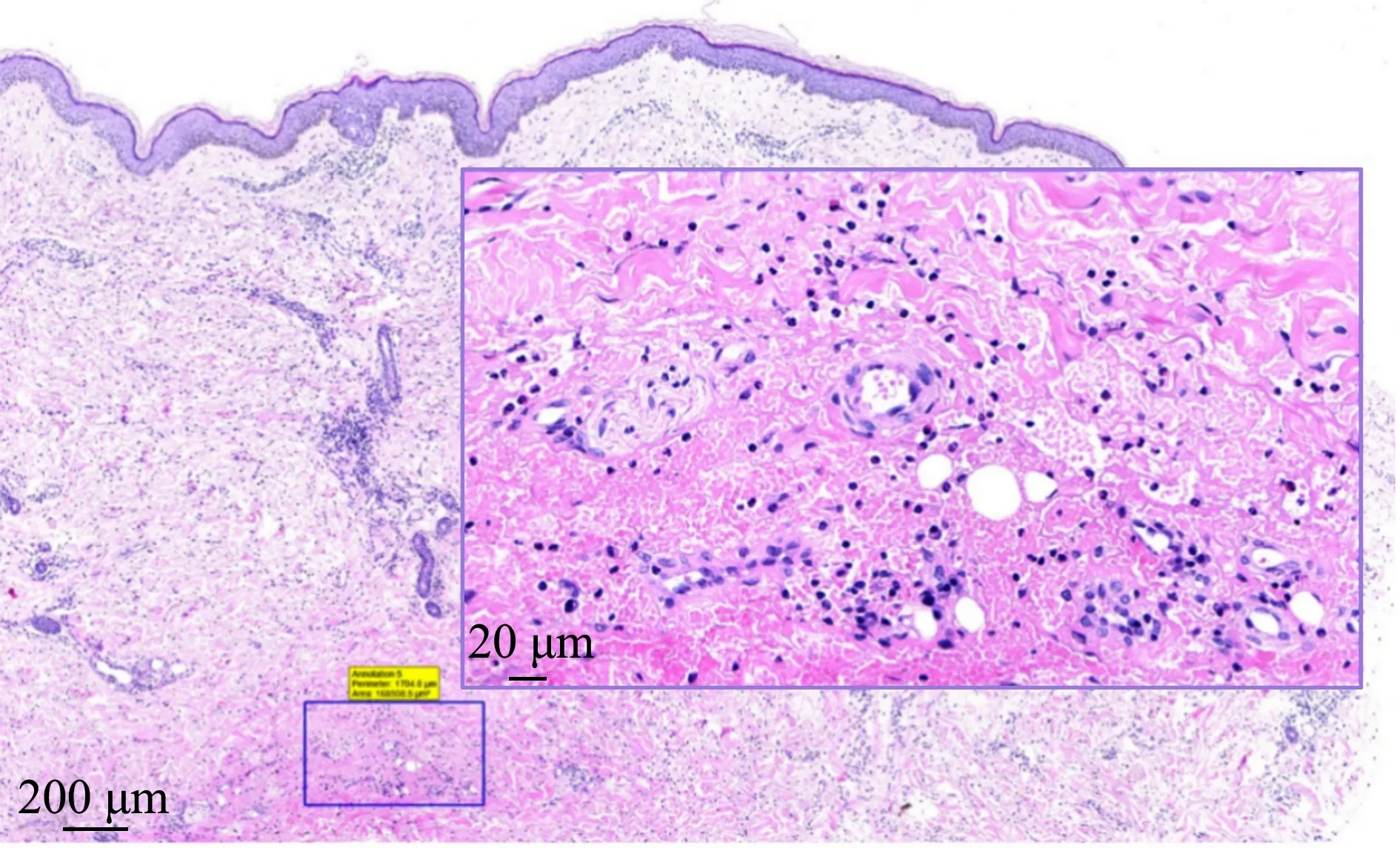
图2 真皮层中性粒细胞聚集
1.2 治疗方法
予抗感染及对症治疗后,患者炎症得到控制,但皮炎、周期性发热、关节痛和肌痛未见好转。注射复方倍他米松注射液后,患者体温迅速恢复正常,遂开始激素序贯治疗:甲强龙40 mg静脉滴注,每日1次,3 d后改用强的松片40 mg口服,每日1次,并逐渐减量。
2 结果
治疗5个月后患者皮损完全消失(图3),但因为拒绝抗癌治疗,患者肿瘤持续进展。

图3 背部红斑消失
3 讨论
我们检索了PubMed、Embase和Web of Science自建库到2021年6月肺癌相关Sweet综合征的病例,排除诊断不明的病例,共筛选出25例(表1)。第1例肺癌相关Sweet综合征病例来自1988年Dyall-Smith等[5]的报道,2000年后更多的病例才被报道。
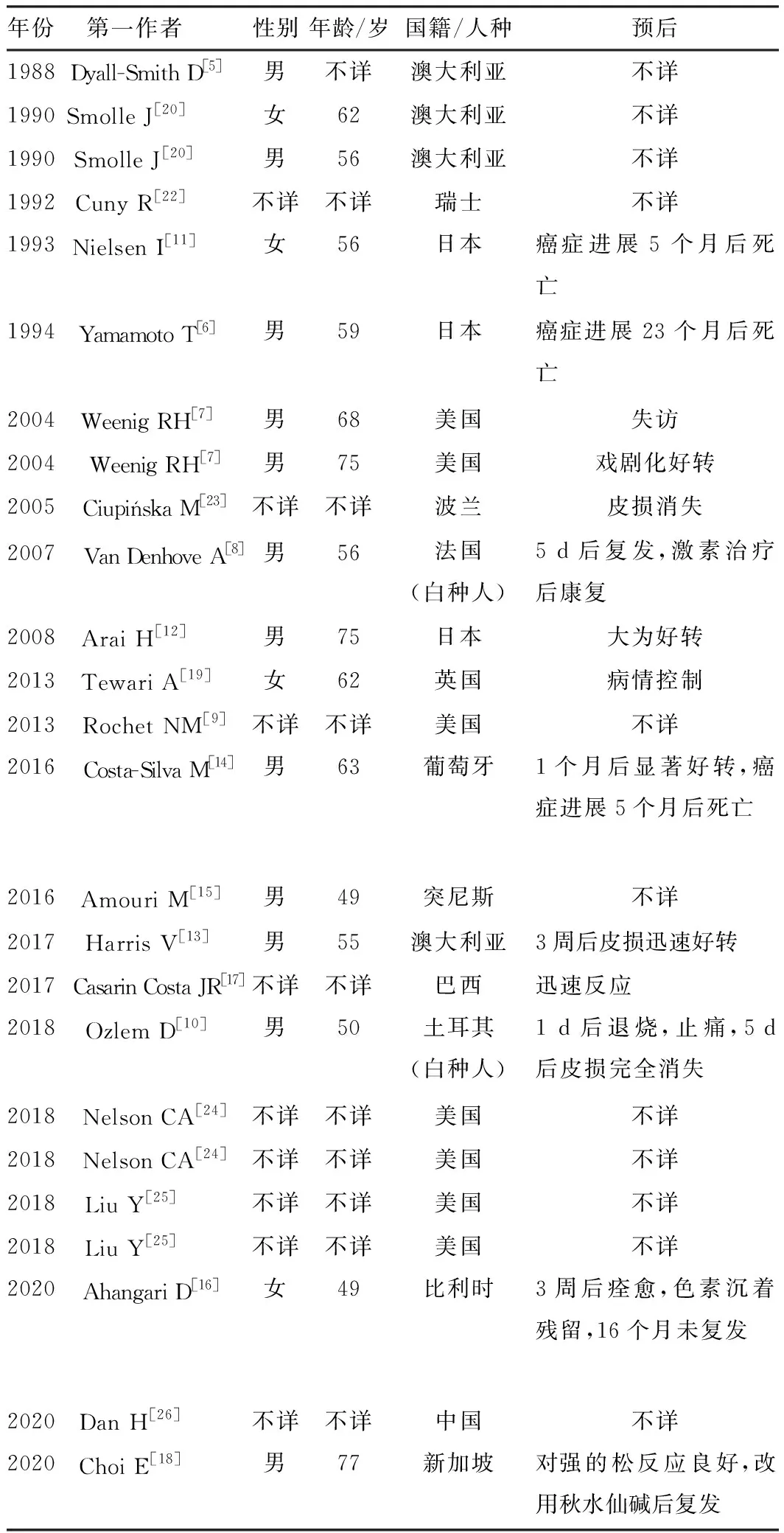
表1 肺癌相关Sweet综合征病例总结
3.1 病例特征
目前肺癌相关Sweet综合征的患者男女比例为12∶4,年龄为49~77岁;皮损最常累及的部位为上肢(8例)[6-13],其次是下肢(4例)[6,9,11-12]和手部(4例)[7,11,13-14];10例患者皮损表现为红斑[6-12,15-16],5例患者为水疱或脓疱[6-7,11,13-14],部分患者为结节或溃疡[9,11]。25例患者病理学检查均为真皮层中性粒细胞浸润,4例为致密程度浸润[7,8,13-14],2例为中性粒细胞血管炎[13-14],4例为血管周围中性粒细胞浸润[11-13,15],部分患者还发现了淋巴细胞[8,12-13,17]、嗜酸性粒细胞[12,18]、组织细胞浸润[12]。真皮水肿也相对常见,共7篇文献有相应描述[8,11-13,15,16,19]。最常见的原发性肺癌类型是腺癌(7/25)[5,7,11,12,15-16,20],其也是Sweet综合征中实体瘤的最常见类型[21],另有3例小细胞肺癌[6,10,13]、3例鳞癌[7,8,14]、2例类癌[17,19]。7例患者伴有发热[8-13,16],3例伴关节痛、肌痛[8,11,16],2例乏力[7,16]。贫血是副肿瘤性Sweet综合征的特点之一[17,21],但在文献回顾中未见相关联系。据分析,25例报道中有2例与肺恶性肿瘤的关联可能并不大,1例表现出与粒细胞集落刺激因子治疗史而非肿瘤史的密切相关[16],另1例则已完成肿瘤病灶的完全切除[7]。
3.2 治疗与预后
大多数文献中,肺癌相关Sweet综合征的一线治疗是全身类固醇激素治疗(8/11)[8,10-14,18,23],以强的松为主;一些研究者尝试了局部类固醇激素治疗[6-7]、秋水仙碱、磺胺甲氧哒嗪治疗,或抗癌治疗,如手术切除[26]、铂类化疗、放疗[8],均取得了较好的疗效,尤其是类固醇激素治疗通常表现出迅速、显著的好转。秋水仙碱只在2例患者中应用,1例快速康复[7],另1例则因复发而不得不再次采用类固醇激素治疗[18]。Tewari等[19]在1例类癌患者中应用磺胺甲氧哒嗪,皮损得到控制。在3周至23个月的随访中,3例患者死于肿瘤相关并发症,其中1例是小细胞肺癌患者[6],另2例在诊断为Sweet综合征时即诊断为Ⅲb~Ⅳ期肺癌[11,14]。
3.3 诊断标准的适用性
虽然广泛使用的1994年Von den Driesch版Sweet综合征诊断标准中将压痛性红斑作为主要诊断标准之一[3],但临床病例并不能完全满足诊断标准的要求。Marcoval等[4]的研究发现仅有26%的患者表现出皮损压痛;Casarin Costa等[17]、Masmoudi等[27]、Rochet等[9]的研究中出现皮损压痛的患者也仅31%~43%。另一诊断标准——排除白细胞破碎性血管炎,同样在临床中受到挑战。Malone等[28]于2002年提出Sweet综合征中存在由活化的中性粒细胞释放的有毒代谢物引起的继发性血管壁损伤,Cohen[29]也认同这个观点:即在病程较长的Sweet综合征患者中,可能出现无免疫球蛋白和补体沉积参与的白细胞破碎性血管炎[15,28,30-31]。因此,现有诊断标准可能无法完全适用于Sweet综合征各种亚型,积分制诊断标准或更能满足临床需求。
本例患者虽未表现出压痛红斑,但符合其他诊断要素,包括突发红斑,尤其是上身部分;真皮中性粒细胞聚集;先发的非特异呼吸道感染及相关的实体瘤表现;发作期间的不适,体温在38 ℃及以上;发作期间白细胞、C-反应蛋白、血沉升高;全身类固醇激素治疗后反应良好。因此,将该病例诊断为Sweet综合征合理。
3.4 瘙痒与Sweet综合征
我们认为瘙痒可能是Sweet综合征作为超敏反应的一种佐证。Sweet综合征被认为是一种超敏反应[3],但是引起该反应的启动因素和途径尚不明确。目前的研究结果指向一个多因素综合影响的进程:炎症因子的异常表达、中性粒细胞功能异常和遗传易感性[32]。Sweet综合征中,瘙痒并非特例[33],人体通过建立免疫系统和外周神经系统感知危险,当伤害发生时,感受器被激活,激发炎症反应、疼痛、瘙痒等,因此,疼痛和瘙痒具有重叠的、协同运作的反应通路[34]。Sweet综合征患者的炎症反应标志物和其他细胞因子通常过表达,如IL-2、IL-6和IFN-γ都参与瘙痒和疼痛感受的发生[35-36],瞬时受体电位锚蛋白1和瞬时受体电位香草酸亚型1作为瘙痒和疼痛的关键整合因子,参与不同原因引起的瘙痒或皮肤损伤后的慢性瘙痒[34,37]。
本例患者是位养鸽人,胸部CT提示双肺间质纤维化,由于支气管肺泡灌洗、肺活检等深入操作检查可能引起创伤,同时考虑到抗癌治疗的优先性,未能与过敏性肺炎、特发性间质性肺炎和感染相关纤维化相鉴别,但这并不妨碍我们识别该患者存在的免疫系统紊乱。
另外,在文献回顾中,我们发现Sweet综合征女性患者多于男性患者,副肿瘤性Sweet综合征中男女性患者比例相当[3,11,15,21,24,26]。在肺癌相关Sweet综合征中则恰恰相反(男∶女=12∶4),提示在Sweet综合征的老年男性患者中要注意排查肺部恶性肿瘤的可能。
我们报告了1例老年男性肺癌相关Sweet综合征,结合病例系列回顾,认为瘙痒、无痛红斑不应作为肺癌相关Sweet综合征的排除标准,而是Sweet综合征超敏反应的一种表现。基于现行诊断标准的积分制诊断标准可能更适应临床需求,但对Sweet综合征的研究仍需更多完善的临床资料、实验室检查、病理学研究、基因分析和完善随访的病例。
