肠道菌群紊乱对泻心汤药效成分大黄素药动学的影响
2022-08-16张晓喻胡慧玲郭欣悦王战国
刘 莹,贾 兰,张晓喻,胡慧玲,郭欣悦,王战国, , 5*
肠道菌群紊乱对泻心汤药效成分大黄素药动学的影响
刘 莹1,贾 兰2,张晓喻2,胡慧玲3,郭欣悦4,王战国1, 4, 5*
1. 成都大学药学院,四川 成都 610106 2. 四川师范大学生命科学学院,四川 成都 610101 3. 成都中医药大学药学院,四川 成都 610730 4. 成都大学食品与生物工程学院,四川 成都 610106 5. 成都大学基础医学院整合医药学产业协同创新研究中心,羌医药标准研究推广基地既协同创新研究中心,四川 成都610106
通过比较大黄素以及配伍泻心汤药效成分(盐酸小檗碱、黄芩苷)前后在正常和抗生素致菌群紊乱大鼠中的药动学差异,揭示肠道菌群对泻心汤药效成分大黄素药动学的影响。通过ig混合抗生素建立菌群紊乱大鼠模型,经高通量16S rDNA测序技术进行模型评价。采用β-葡萄糖醛酸酶水解法处理血液样品,通过血液中总大黄素质量浓度表征大黄素的体内药动学特征。通过比较正常和抗生素致菌群紊乱大鼠中大黄素及其配伍盐酸小檗碱和黄芩苷前后的药动学差异特征评价肠道菌群对泻心汤药效成分大黄素药动学的影响。与正常大鼠相比,单独ig大黄素,菌群紊乱大鼠中大黄素在0~12 h内基本无吸收,即在0~12 h内生物利用度极显著降低;大黄素配伍盐酸小檗碱和黄芩苷后,菌群紊乱大鼠中大黄素在0~12 h内生物利用度仍然显著降低。与单独ig大黄素相比,大黄素配伍盐酸小檗碱和黄芩苷后,菌群紊乱大鼠模型中大黄素在0~12 h内的体内生物利用度显著升高;然而,正常大鼠中大黄素在0~12 h内的体内生物利用度显著降低。大黄素单独给药或配伍泻心汤药效成分后在菌群紊乱大鼠模型中药动学均显著改变,表明肠道菌群能够显著影响泻心汤药效成分大黄素的药动学特征。
泻心汤;大黄素;盐酸小檗碱;黄芩苷;抗生素;肠道菌群;药动学
人体携带着大量的微生物,其中很大一部分位于胃肠道中[1]。胃肠道约有100万亿个微生物,其中专性厌氧菌占99.9%,是肠道优势菌群[2]。肠道微生物主要分为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)6大门,其中厚壁菌门和拟杆菌门为主要优势菌群[3]。抗生素过度使用会导致肠道菌群失调并发生代谢异常[4],中药或中药配伍常与抗生素联合用药[5-6],而抗生素的滥用是否会对中药及复方配伍后体内药动学产生影响是值得研究的问题。
泻心汤是具有代表性的清热解毒的中药方剂,具有抗炎、广谱抗菌、抗肿瘤、抗氧化等多种药理作用[7]。泻心汤由大黄、黄芩和黄连组成,《中国药典》2020年版中三黄片由泻心汤衍生而来,其组方如下:大黄以大黄药材(300 g)代表,黄连以盐酸小檗碱(5 g)代表,黄芩以富含黄芩苷(黄芩苷质量分数不低于85%)的黄芩浸膏(21 g)代表。依据泻心汤衍生的三黄片中总蒽醌类、生物碱类(盐酸小檗碱)、黄酮类(黄芩浸膏)含量关系,结合总大黄素在大黄中的含量,选择代表性的药效成分大黄素、盐酸小檗碱和黄芩苷(比例约为1∶3∶9)开展初步研究。研究者已从成分、药效学、药动学等方面对泻心汤配伍合理性进行了研究[8-9]。中药在口服后同时作用于机体与肠道菌群,二者不可避免地存在相互作用[10],本课题组前期研究表明泻心汤药效成分在正常大鼠中存在显著的药动学相互作用[11-13];另一方面,菌群失调或紊乱状态下,泻心汤药效成分及配伍前后体内药动学特征是值得研究的命题。本研究从泻心汤组方出发,拟通过比较大黄素以及配伍泻心汤药效成分前后在正常和抗生素致菌群紊乱大鼠中的药动学差异,揭示肠道菌群对泻心汤药效成分大黄素药动学的影响。
1 材料
1.1 动物
SPF级SD雄性大鼠24只,6周龄,体质量(150±10)g,购自成都达硕生物科技有限公司,实验动物生产许可证编号SCXK(川)2015-030。动物于室温(25±2)℃、湿度(60±5)%的环境下饲养,12 h明暗交替,自由进食饮水。动物实验经成都大学伦理委员会批准(批准号20180412)。
1.2 药品与试剂
大黄素(批号2017060202)、黄芩苷(批号2017041202)、盐酸小檗碱(批号2017052302)原料药购自长沙中仁生物科技有限公司,质量分数均大于98%);对照品大黄素(批号17110704)、1,8-二羟基蒽醌(批号17101504)购自成都曼斯特生物科技有限公司,质量分数均大于99.9%;β-葡萄糖醛酸酶(批号P1541397)、硫酸新霉素(批号2017071501)、杆菌肽(批号2017090301)、纳他霉素(批号2017082301)购自成都化夏化学试剂有限公司;超纯水由优普超纯水机制备;肝素钠(批号2016041801)购自成都孟德尔科技有限公司;甲酸(批号2017102601)、甲醇(批号2017082301)均为色谱纯;其他试剂均为分析纯。
1.3 仪器
2695型高效液相仪(美国Waters公司);Applied Biosystems GeneAmp 9700型系列PCR仪(美国Thermo Fisher Scientific公司);TGL-16C型高速离心机(上海安亭科学仪器厂);PHS-2F型PH测定仪(上海雷磁仪电科学仪器股份有限公司);JN300-1型氮吹仪(苏州吉米诺仪器有限公司);BP211D型电子天平(北京塞多利斯仪器有限公司)。
2 方法
2.1 肠道菌群紊乱大鼠模型的建立
精密称取硫酸新霉素5.0 g,杆菌肽5.0 g,纳他霉素1.25 mg,于100 mL量瓶中,加入生理盐水溶解,定容,得抗生素混合溶液。SD大鼠随机分为正常组和模型组,每组12只。模型组大鼠ig抗生素混合溶液,1次/d,连续7 d。
2.2 肠道菌群紊乱大鼠模型的验证
2.2.1 粪便收集 造模第7天,在ig抗生素混合溶液2 h后,采集各组大鼠的新鲜粪便样品,每只大鼠取样3份,粪便放入灭菌后的冷冻管中并保存于−80 ℃冰箱中,用于16S rDNA测序。
2.2.2 PCR扩增与产物纯化 PCR扩增引物序列:515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。样品设置3组生物学重复并将PCR(PCR采用KOD-401B:TOYOBOKOD-Plus-NeoDNAPolymerase)反应终止于线性扩增期,PCR结束后将同一样本的PCR产物混合,用2%琼脂糖凝胶电泳检测,检测条件5 V/cm、20 min,使用OMEGA胶回收试剂盒切胶回收PCR产物,TE缓冲液洗脱回收目标DNA片段。参照电泳初步检测结果,PCR回收产物用Qubit 2.0(美国Thermo Fisher Scientific公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。
2.2.3 16S rDNA基因测序 将扩增后的各组粪样DNA产物送至上海维基生物科技有限公司,进行16S rDNA基因V3~4区通量测序。
2.3 药动学实验
2.3.1 实验分组 正常组分为2组,每组6只,分别ig大黄素(C1组)、大黄素+盐酸小檗碱+黄芩苷(C2组);模型组分为2组,每组6只,分别ig大黄素(T1组)、大黄素+盐酸小檗碱+黄芩苷(T2组)。
2.3.2 给药剂量 为考察肠道菌群对泻心汤药效成分大黄素药动学的影响,依据前期预实验结果,结合泻心汤所制备的三黄片(《中国药典》2020年版)中大黄素、盐酸小檗碱、黄芩苷含量约为1∶3∶9的比例关系,确定大黄素、盐酸小檗碱和黄芩苷的大鼠ig给药剂量分别为33.40、100.20、300.60 mg/kg。
2.3.3 取血时间 正常组和模型组大鼠ig受试药物前后于0、0.16、0.25、0.5、0.75、1、2、3、4、6、8、12、16、24 h断尾取血0.3 mL,置于肝素化离心管中,12 000 r/min离心5 min,取上清100 µL,待测。
2.4 血浆样品的处理
本研究拟重点考察肠道菌群对泻心汤中大黄素药动学的影响,鉴于大黄素为多酚羟基化合物,体内经历广泛的II相代谢过程[14-17],其中尤以肠道和肝脏中的尿苷二磷酸葡糖苷酸转移酶(uridine diphosphate glucuronide transferase,UGT)介导发生的葡萄糖醛酸结合为主,故拟采用β-葡萄糖醛酸苷酶处理血浆样品以表征其体内总大黄素的暴露程度。采用液液萃取法对样品进行前处理,取待测血浆样品100 µL,加入20 μL 0.5 mol/L的醋酸溶液(含2 mg/mL维生素C)调节pH值至5.0,加入β-葡萄糖醛酸苷酶(1000 U/mL)100 μL,涡旋1 min,在37 ℃水浴中孵化30 min,加入内标液1,8-二羟基蒽醌20 μL(20 μg/mL)混匀,加入1 mL醋酸乙酯,涡旋萃取5 min,12 000 r/min离心5 min,取上清,37 ℃氮气吹干,残渣以100 μL甲醇复溶,12 000 r/min离心5 min,取上清液待测。
2.5 血浆样品测定方法学考察
2.5.1 色谱条件 C18色谱柱(250 mm×14.6 mm,5 μm),流动相为甲醇(A)-0.4%甲酸水溶液(B),梯度洗脱:0~4 min,60% A;4~27 min,60%~80% A;27~30 min,80%~60% A。波长254 nm;体积流量1 mL/min;柱温30 ℃;进样量10 μL。
2.5.2 专属性 取大鼠空白血浆、空白血浆加内标(1,8-二羟基蒽醌)、空白血浆加内标加大黄素对照品、大鼠ig大黄素2 h后的血浆样品,按“2.4血浆样品的处理”项下方法处理后,采用上述色谱条件进样分析。
2.5.3 大黄素标准曲线和定量下限 精密称取大黄素和1,8-二羟基蒽醌对照品适量,以甲醇为溶剂分别配制成质量浓度为300、200 μg/mL的储备液,于4 ℃储存。吸取适量的内标1,8-二羟基蒽醌储备液,以甲醇稀释成质量浓度为20 μg/mL的内标溶液。吸取大黄素储备液,按倍数稀释法用甲醇配制成系列不同质量浓度的标准工作液(标准工作液中待测成分大黄素的质量浓度为0.586、1.172、2.344、4.688、9.375、18.750、37.500、75.000、150.000 μg/mL)。取空白血浆样品100 µL,加入20 µL不同质量浓度的标准工作液,再加入20 µL内标溶液、100 µL水和20 µL醋酸溶液,涡旋混匀,按“2.4”项下方法处理,采用上述建立的HPLC分析方法检测。记录峰面积,计算对照品与内标峰面积比值,绘制标准曲线并计算线性范围(大黄素血药质量浓度为0.117~30.000 μg/mL)。另取定量下限质量浓度样品,平行5份,分别计算质量浓度,并得平行样品质量浓度之间RSD。
2.5.4 精密度和准确度 取高、中、低3个质量浓度(30.00、1.88、0.47 μg/mL)的质控血浆(对照品与内标溶液加入到空白血浆),按“2.4”项下方法处理,各平行制备5份,代入线性方程,计算测定值,与加入量比较,并计算日内精密度和准确度。不同质量浓度的5份血浆样品平行进样,连续测定3 d,每日绘制随行标准曲线,计算实测质量浓度,并计算日间精密度和准确度。
2.5.5 稳定性 按“2.4”项下方法制备高、中、低质量浓度的3组血浆样品,每组5个平行,考察室温放置4 h稳定性、24 h稳定性、反复冻融3次样品稳定性(−4 ℃冻存、室温解冻,反复3次)。
2.5.6 提取回收率 以高、中、低3个质量浓度的血浆质控样品进行回收率实验,按照“2.4”项下方法处理样品,利用HPLC进行分析检测,记录其峰面积,以血浆中测得大黄素的峰面积与相应质量浓度对照品溶液中大黄素峰面积进行比较,计算出3个质量浓度质控样品的回收率。
2.6 统计分析
采用DAS 2.0医学药动学统计软件和非房室模型计算得出药动学参数。采用PASW statistics 18软件进行统计分析,采用Origin Pro Protable软件作图。
3 结果
3.1 肠道菌群紊乱模型验证
3.1.1 大鼠肠道菌群组成差异性分析 与正常大鼠相比,在门水平上主要检测到12种菌门的变化,肠道菌群紊乱大鼠肠道菌落的变形菌门的相对丰度得到显著提高,而拟杆菌门和厚壁菌门的相对丰度显著降低(图1-A);在科水平上也出现了2组差异较大的12种菌科,模型组的BacteroidaLes S24-7 group、瘤胃菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)和氨基酸球菌科(Acidaminococcaceae)的相对丰度显著降低,肠杆菌科(Enterobacteriaceae)、毛螺菌科(Lachnospiraceae)、理研菌科(Rikenellaceae)和肠球菌科(Enterococcaceae)相对丰度显著增加,特别是肠杆菌科(Enterobacteriaceae)菌群丰度增加最为显著(图1-B);在属水平上,模型组肠道中分支杆菌属、志贺氏杆菌属、、泛菌属的相对丰度显著增加,毛螺菌属Lachnospiraceae NK4A136 group、普雷沃氏菌属Prevotella 9、乳杆菌属、杆菌属coprostanoligenes group、普雷沃氏菌属Prevotellaceae Ga6A1 group、瘤胃梭菌属5、9的相对丰度显著降低(图1-C)。可见,模型组肠道菌群在门、科、属水平上均出现一定程度的紊乱。
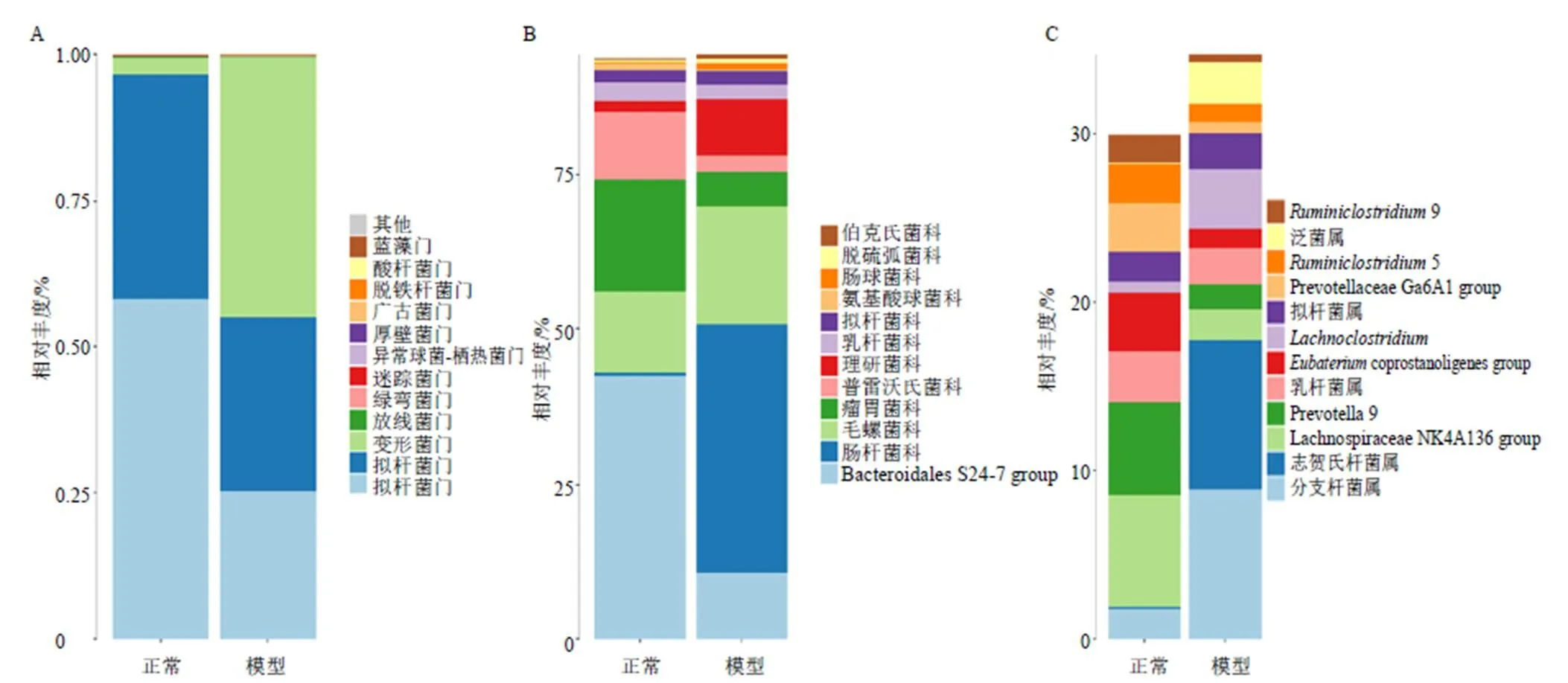
图1 各组大鼠肠道菌群门 (A)、科 (B)和属 (C)水平的相对丰度
3.1.2 大鼠肠道菌群多样性分析 Shannon指数和Simpson指数是用来代表微生物菌落多样性的指数,其数值越大,说明微生物菌落的多样性越高;Chao1指数常用来估计物种总数,其所呈现的值越大,代表该指定环境中群落的丰富程度越大;Faith’s PD指数是Alpha水平上最常用的系统发育多样性度量方法。如图2所示,正常组和模型组的肠道菌群多样性存在显著差异,4种Alpha多样性评价指数均显示正常组的值均高于模型组,即表明造模可降低肠道菌群多样性。
3.2 方法学验证
3.2.1 专属性 如图3所示,空白血浆内的内源性物质对所要检测的大黄素及内标1,8-二羟基蒽醌无干扰,同时无论是在血浆中加入大黄素、内标还是ig大黄素后血浆样品中3者峰形皆良好,分离度大于1.5,符合生物样品的测定要求。
3.2.2 标准曲线和定量下限 以大黄素质量浓度为横坐标(),大黄素与内标(1,8-二羟基蒽醌)峰面积比值为纵坐标(),绘制标准曲线,其线性回归方程为=0.141 3+0.079 4(2=0.999 1)。结果表明本方法在0.117~30.000 μg/mL呈良好的线性关系,大黄素的定量下限为0.117 μg/mL。

与正常组比较:*P<0.05 **P<0.01

A-空白大鼠血浆 B-空白大鼠血浆+内标 C-空白大鼠血浆+内标+大黄素 D-正常组大鼠ig大黄素后2 h的血浆 IS-内标(1,8-二羟基蒽醌)
3.2.3 精密度和准确度 如表1所示,血浆中大黄素的日内和日间准确度和精密度均小于15%,符合要求。
3.2.4 稳定性 如表2所示,大黄素血浆样品在高、中、低3个质量浓度下,在不同储藏条件(室温下放置于4 h、24 h以及−4 ℃下反复冻融3次)处理下,RSD均低于20%,大黄素在样品中的稳定性良好,符合要求,见表2。
3.2.5 提取回收率 如表3所示,大黄素在高、中、低3个质量浓度下的回收率均≥80%,表明本方法的提取回收率达到生物样品测定要求。
3.3 药动学
正常大鼠和抗生素诱导的肠道菌群紊乱大鼠ig大黄素(33.4 mg/kg),将得到的血浆样品不经过β-葡萄糖醛酸酶处理,在“2.5.1”项下色谱条件,各个时间点所采集的血浆样品中几乎检测不到大黄素原型的存在。将血浆样品经β-葡萄糖醛酸酶处理后测定血浆样品中总大黄素含量,各采样时间点总大黄素的药时曲线见图4。
表1 大黄素血浆样品中精密度和准确度
Table 1 Precision and accuracy of emodin in plasma samples
质量浓度/(μg·mL−1)日内精密度和准确度(n =5)日间精密度和准确度(n =5) 实测值/(μg·mL−1)RSD/%RE/%实测值/(μg·mL−1)RSD/%RE/% 30.0030.08±0.405.400.2629.63±0.822.77−1.23 1.881.97±0.075.704.821.93±0.010.783.01 0.470.47±0.0612.76−1.040.49±0.013.853.67
表2 大黄素血浆样品的稳定性(n = 5)
Table 2 Stabilities of emodin in plasma samples (n = 5)
储藏条件质量浓度/(μg·mL−1)实测值/(μg·mL−1)RE/%RSD/% 室温放置4 h30.0031.27±1.584.225.05 1.881.98±0.245.5612.12 0.470.51±0.068.9811.76 室温放置24 h30.0031.13±2.273.767.29 1.882.16±0.1814.968.33 0.470.54±0.0514.179.26 −4 ℃反复冻融3次30.0029.30±1.48−2.325.05 1.881.79±0.13−4.767.26 0.470.39±0.06−12.6415.38
表3 大黄素血浆样品的回收率(n = 5)
Table 3 Recovery of emodin in plasma samples (n = 5)
质量浓度/(μg·mL−1)实测值/(μg·mL−1)回收率/% 30.0024.16±0.5880.53±1.93 1.881.70±0.0290.54±1.16 0.473.31±0.1690.08±7.65
正常大鼠给予大黄素配伍盐酸小檗碱和黄芩苷前后,体内总大黄素的药动学参数见表4,与单独给予大黄素(C1组)相比,大黄素配伍盐酸小檗碱和黄芩苷(C2组)总大黄素的AUC0~t减少了38.96%,而max减少了41.04%。菌群紊乱大鼠模型单独ig大黄素(T1组)后,通过酶处理血浆样品中总大黄素仅在16、24 h时检测到,分别为0.412、3.010 μg/mL,在0~12 h内未检测到大黄素,与正常大鼠(C1组)相比,在0~12 h内生物利用度显著降低。菌群紊乱大鼠模型ig大黄素配伍盐酸小檗碱和黄芩苷(T2组)后,在0~12 h内体内大黄素质量浓度低于正常组(C2组),但在12 h后体内大黄素含量有明显升高的趋势。
从图4可以看出,大黄素无论是单独给药还是联合给药,在检测的24 h内,前12 h肠道菌群紊乱组均导致大黄素体内吸收减弱,生物利用度降低,但在12 h后大黄素的吸收有逐步增强的趋势,鉴于模型组均发现16、24 h高暴露量的大黄素,且菌群紊乱大鼠单独ig大黄素(T1组)在16 h后仍处于增加趋势,后期可考虑延长采血时间以得到其24 h后的药动学参数。与单独ig大黄素相比,大黄素配伍盐酸小檗碱和黄芩苷后,菌群紊乱大鼠模型中大黄素在0~12 h内的体内生物利用度显著升高;然而,正常大鼠模型中大黄素在0~12 h内的体内生物利用度显著降低。

图4 正常大鼠和肠道菌群紊乱大鼠ig大黄素及大黄素联合盐酸小檗碱和黄芩苷后血液中总大黄素的药时曲线
表4 大黄素在C1组和C2组的药动学参数(, n = 6)
Table 4 Pharmacokinetic parameters of emodin in C1 group and C2 group (, n = 6)
参数单位C1组C2组 AUC0~tmg∙L−1∙h61.875±14.64337.769±8.401* AUC0~∞mg∙L−1∙h69.314±16.02970.225±15.692 MRT0~th8.630±1.05110.419±1.589 VRT0~th32.886±4.97541.499±7.746 t1/2zh7.162±2.52213.221±8.866 Tmaxh3.167±0.7532.667±1.033 Cmaxmg∙L−16.048±1.6163.566±0.877* CLzL∙h−1∙kg−10.505±0.1230.497±0.116 VzL∙kg−15.137±1.8109.151±5.924
与C1组比较:P<0.05
*< 0.05 vs C1 group
4 讨论
4.1 肠道菌群紊乱影响大黄素的体内药动学
混合抗生素溶液给药后,肠道菌群中有益菌减少,类似大肠杆菌的有害菌(致病菌)数量增加,造成肠道菌群紊乱,同时伴随着肠道内环境发生变化,肠道菌群失调患者的粪便pH值由正常粪便的5.0~6.5增至6.0~8.0[18],而消化道中不同的pH环境可影响药物的解离状态,故消化道pH会对药物的稳定性产生影响,从而影响对药物的吸收。本研究结果显示,抗生素诱导的肠道菌群紊乱同样导致大肠杆菌在内的致病菌大量增加,引起消化道pH改变可能是大黄素在前12 h吸收差的原因之一。
肠道菌群紊乱会导致有益菌减少、致病菌大量增加,伴随2种结果肠道中短链脂肪酸分泌量减少、内毒素炎症因子大量产生,短链脂肪酸尤其是丁酸的减少导致肠道屏障功能减弱,内毒素炎症因子入血会引起炎症反应,破坏肠道功能造成肠道损伤[19]。而大黄素的吸收主要发生在肠道中,那么肠道菌群紊乱造成的肠生理功能改变是影响大黄素吸收的另一个可能的因素。
4.2 联合用药影响大黄素在肠道菌群紊乱大鼠体内药动学
研究表明,大黄酸联合用药导致体内生物利用度降低,这种联合用药所产生的变化可能是由于药物相互作用所导致。由于肠道中与吸收相关的转运蛋白分为摄取转运体和外排转运体,药物相互竞争、抑制或诱导影响转运蛋白,从而影响药物的吸收[6]。联合用药可能会影响药物的体内吸收,不过在菌群的介导作用下这种影响会相对减弱。
大黄素属于酚酸类物质,在体内经历广泛的II相代谢,尤其是葡糖糖醛酸代谢,以形成葡糖糖醛酸结合物等,而在肠道中这些结合物又会被肠道菌群所产生的葡萄糖醛酸苷酶等水解酶水解,释放出原型药物,进而被小肠重新吸收入体循环。由于抗生素的干扰,导致肠道菌群的种类和数量被抑制,进一步抑制了菌群活性,抑制水解酶活性[20],导致药物的重吸收相对减弱,结果提示在使用抗生素的情况下,若同时服用酚酸类药物,往往需要考虑菌群介导的单独用药或联合用药产生药物相互作用对药物在体内吸收的影响。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang X Y, Chen J, Yi K,. Phlorizin ameliorates obesity-associated endotoxemia and insulin resistance in high-fat diet-fed mice by targeting the gut microbiota and intestinal barrier integrity [J]., 2020, 12(1): 1-18.
[2] Ma Q T, Li Y Q, Li P F,. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora [J]., 2019, 117: 109138.
[3] Hu R X, Yuan Y T, Liu C L,. New insights into the links between anti-diabetes drugs and gut microbiota [J]., 2021, 10(1): R36-R42.
[4] Kang A, Zhang S J, Zhu D,. Gut microbiota in the pharmacokinetics and colonic deglycosylation metabolism of ginsenoside Rb1in rats: Contrary effects of antimicrobials treatment and restraint stress [J]., 2016, 258: 187-196.
[5] 耿聪, 李岩, 姚鑫洁. 三黄泻心汤三味药联合抗生素对幽门螺杆菌的体外抑菌实验研究 [J]. 实用药物与临床, 2021, 24(4): 307-311.
[6] 田志浩, 艾则孜江·艾尔肯, 韦鲜花. 体内药物相互作用机制及其评价方法的研究进展 [J]. 现代药物与临床, 2021, 36(10): 2192-2199.
[7] Peng W, Du H, Liu G L,. Antistress effects of San-Huang-Xie-xin Decoction on restraint-stressed mice revealed by1H NMR-based metabolomics and biochemistry analysis [J]., 2019, 2019: 5897675.
[8] Wei X Y, Tao J H, Shen Y M,. Sanhuang Xiexin Tang ameliorates type 2 diabetic rats via modulation of the metabolic profiles and NF-κB/PI3K/Akt signaling pathways [J]., 2018, 9: 955.
[9] Fang P H, Sun Y B, Gu X R,. San-Huang-Tang protects obesity/diabetes induced NAFLD by upregulating PGC-1α/PEPCK signaling in obese and galr1 knockout mice models [J]., 2020, 250: 112483.
[10] Li X, Wu D, Niu J J,. Intestinal flora: A pivotal role in investigation of traditional Chinese medicine [J]., 2021, 49(2): 237-268.
[11] 刘巧, 胡慧玲, 岳青, 等. 三黄泻心汤对II型糖尿病大鼠的降血糖作用研究 [J]. 中药与临床, 2018, 9(2): 43-47.
[12] Wang Z G, Hu H L, Chen F,. Reduced system exposures of total rhein and baicalin after combinatory oral administration of rhein, baicalin and berberine to beagle dogs and rats [J]., 2013, 145(2): 442-449.
[13] 刘巧, 李奇娟, 谢余, 等. 三黄泻心汤及其有效组分对大鼠的总胆汁酸代谢影响 [J]. 中药与临床, 2018, 9(3): 22-25.
[14] 吴建华, 吴志瑰, 裴建国, 等. 多酚类化合物的研究进展 [J]. 中国现代中药, 2015, 17(6): 630-636.
[15] Martínez-Huélamo M, Vallverdú-Queralt A, Lecce G D,. Bioavailability of tomato polyphenols is enhanced by processing and fat addition: Evidence from a randomized feeding trial [J]., 2016, 60(7): 1578-1589.
[16] Serreli G, Naitza M R, Zodio S,. Ferulic acid metabolites attenuate LPS-induced inflammatory response in enterocyte-like cells [J]., 2021, 13(9): 3152.
[17] Wang D P, Wang X H, Yu X J,. Pharmacokinetics of anthraquinones from medicinal plants [J]., 2021, 12: 638993.
[18] 邢志广, 周伟强, 沈琪琳, 等. 菌群失调患儿腹泻标本细菌学及pH值和球杆比变化的临床意义 [J]. 中国妇幼保健, 2007, 22(32): 4572-4574.
[19] Mariappan V, Vellasamy K M, Mohamad N A,. OneHealth approaches contribute towards antimicrobial resistance: Malaysian perspective [J]., 2021, 12: 718774.
[20] Liu M, Yuan J, Hu W J,. Pretreatment with broad-spectrum antibiotics alters the pharmacokinetics of major constituents of Shaoyao-Gancao Decoction in rats after oral administration [J]., 2018, 40(2): 288-296.
Effect of intestinal flora disorder on pharmacokinetics of emodin in Xiexin Decoction
LIU Ying1, JIA Lan2, ZHANG Xiao-yu2, HU Hui-ling3, GUO Xin-yue4, WANG Zhan-guo1, 4, 5
1. School of Pharmacy, Chengdu University, Chengdu 610106, China 2. College of Life Sciences, Sichuan Normal University, Chengdu 610101, China 3. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 610730, China 4. School of Food and Biological Engineering, Chengdu University, Chengdu 610106, China 5. Holistic Integrative Medicine Industry Collaborative Innovation Research Center, Qiang Medicine Standard Research Promotion Base and Collaborative Innovation Research Center, School of Preclinical Medicine, Chengdu University, Chengdu 610106, China
To reveal the effect of intestinal flora on pharmacokinetics of emodin, active ingredient (berberine hydrochloride, baicalin) in Xiexin Decoction (泻心汤) by comparing the pharmacokinetic differences between emodin and active ingredients of Xiexin Decoction in normal and antibiotic-induced flora disorder rats.Rats model of bacterial flora disorder was established by ig mixed antibiotic, and model was evaluated by high-throughput 16S rDNA sequencing technology. Blood samples were treated by β-glucuronidase hydrolysis method, andpharmacokinetic characteristics of emodin were characterized by concentration of total emodin in blood. Effect of intestinal flora on pharmacokinetics of emodin of Xiexin Decoction was evaluated through comparing the pharmacokinetic characteristics of emodin and its compatibility with berberine hydrochloride and baicalin in normal rats and flora disorder rats that modeled by antibiotics.Compared with normal rats, rats with disordered flora basically which ig emodin alone had no absorb emodin within 0—12 h, that was the bioavailability decreased significantly within 0—12 h; After berberine and baicalin were added, bioavailability of emodin was still significantly reduced in 0—12 h in rats with dysbacteriosis. Compared with ig emodin alone, emodin combined with berberine hydrochloride and baicalin significantly increasedbioavailability of emodin within 0—12 h in rats model of dysbiosis; However, bioavailability of emodinin normal rats was significantly decreased within 0—12 h.Pharmacokinetics of emodin in rats model of dysbacteriosis are significantly changed after administration of emodin alone or in combination with active ingredients of Xiexin Decoction, indicating that intestinal flora significantly affects the pharmacokinetic characteristics of emodin, active ingredient in Xiexin Decoction.
Xiexin Decoction; emodin; berberine hydrochloride; baicalin; antibiotic; intestinal flora; pharmacokinetics
R285.61
A
0253 - 2670(2022)16 - 5066 - 08
10.7501/j.issn.0253-2670.2022.16.016
2022-04-28
国家自然科学基金资助项目(81403178);四川省科技厅项目(2019ZYD052);阿坝州科技局项目(R22YYJSYJ0022)
刘 莹(1997—),女,硕士研究生,研究方向为药物新制剂及其生物药剂学基础研究。E-mail: 1963095440@qq.com
王战国(1981—),男,硕士生导师,副教授,主要从事酚酸类中药生物药剂学基础及药动学研究、重大慢性疾病诊断及药物筛选研究以及中、羌医脾胃病药物开发及质量研究。E-mail: wangzhanguo@cdu.edu.cn
[责任编辑 李亚楠]
