基于UPLC-Q-TOF-MS/MS分析黄精九蒸九晒炮制过程中化学成分的变化
2022-08-16梁泽华潘颖洁邱丽媛吴鑫雨徐晓强舒月文
梁泽华,潘颖洁,邱丽媛,吴鑫雨,徐晓强,舒月文,袁 强*
基于UPLC-Q-TOF-MS/MS分析黄精九蒸九晒炮制过程中化学成分的变化
梁泽华1,潘颖洁1,邱丽媛1,吴鑫雨1,徐晓强2,舒月文2,袁 强1*
1. 浙江中医药大学药学院,浙江 杭州 311400 2. 浙江枣椿堂农业发展有限公司,浙江 龙游 324400
应用固相萃取结合超高效液相色谱-电喷雾四级杆飞行时间质谱联用技术(UPLC-Q-TOF-MS),对黄精九蒸九晒炮制过程中的化学成分进行分析鉴定。采用ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈-0.1%甲酸水作为流动相梯度洗脱,体积流量0.3 mL/min,在电喷雾负离子模式下进行检测,四级杆飞行时间串联质谱对各主要色谱峰进行归属。根据所获得的精确相对分子质量,同时结合色谱保留行为、质谱裂解规律、特征碎片离子、对照品比对以及相关文献报道,共鉴定炮制前后黄精中的61个化学成分,包括16个甾体皂苷类成分、12个黄酮类成分、5个木脂素类成分、1个香豆素类成分、3个生物碱类成分、4个脂肪酸类成分、3个氨基酸类成分、2个糖类成分、4个酯类成分、1个醛类成分、1个有机酸类成分及9个未知成分。炮制对黄精中的化学成分影响很大,随着炮制时间的增加如成分异构化、原生苷种类以及含量减少、苷元含量的增加等。九蒸九晒黄精增效作用炮制或许与其化学成分变化有关,为黄精九蒸九晒炮制机制的研究提供理论依据,为黄精的进一步开发利用提供科学依据。
黄精;UPLC-Q-TOF-MS;九蒸九晒;炮制;成分变化;薯蓣皂苷元;黄精皂苷A
黄精为百合科植物滇黄精Coll. et Hemsl.、黄精Red.或多花黄精Hua的干燥根茎,味甘、性平,入脾、肾、肺经,具有补气养阴、健脾、润肺、益肾的功效[1]。作为药食两用的补益圣品,自古以来,黄精就被我国古代的佛家、道家、儒家、养生学家和医药学家所重视[2],认为其为“服食要药”。传统中医临床常用于治疗治疗燥咳、肾精亏虚、腰膝酸软[3]以及脾胃虚弱之症,显滋补强身之能。而现代药理学研究证明,黄精具有降血糖[4]、调血脂[5-6]、降血压[7]、抗肿瘤[8]、抗疲劳[3]等药理作用。作为传统补益药,黄精用药历史悠久,常常以单味药口服使用以达到补益之效。然而,生黄精口服具有咽喉刺激性及麻舌感,不利于服用,因此黄精常以炮制品入药,炮制之后普遍被认为是刺激性成分的黄精粘液质明显降低[9],有利于患者的服用。古法炮制黄精包括清蒸、酒蒸、九蒸九晒、酒炖合蒸、黑豆制、熟地汁制等,其中以九蒸九晒最为知名。经过九蒸九晒后,黄精化学成分发生变化[10-11],补益作用增强,咽喉刺激性消失,《本草纲目》中就有“单服九蒸九曝食之,驻颜断谷,补诸虚,止寒热,填精髓,下三尸虫”的记载。可见九制黄精之盛名。黄精九制标准为色黑、味甜、滋润[12]。随着蒸晒次数的增加,黄精性状发生变化的同时,化学成分也发生了变化。但是目前全面反映黄精蒸晒过程中化学成分变化方面的研究鲜有报道。
本实验以黄精作为研究对象,采用固相萃取结合超高效液相色谱-电喷雾四级杆飞行时间质谱联用技术,对黄精九蒸九晒炮制过程中的化学成分进行分析鉴定以期对黄精九蒸九晒过程中化学成分变化进行探究,为黄精九蒸九晒炮制机制的深入研究提供参考。
1 材料与仪器
1.1 药材
黄精药材产地为浙江龙游,经浙江中医药大学黄真教授鉴定为百合科植物多花黄精Hua的干燥根茎。
1.2 试剂
色谱级甲醇(国药集团化学试剂有限公司)、色谱级乙腈(华东医药股份有限公司器材化剂分公司)、色谱级甲酸(天津市科密欧化学试剂有限公司)、超纯水。5-羟甲基糠醛(北京华威锐科化工有限公司)、薯蓣皂苷元(南京草本源生物科技有限公司),以上对照品质量分数大于98%。
1.3 仪器
SYNAPT G2-Si高分辨四级飞行时间串联液质联用仪(美国沃特世公司),RE52-99型旋转蒸发器(上海亚荣生化仪器厂)、150T多功能粉碎机(永康市铂欧五金制品有限公司)、KQ-300DB型数控超声波清洗器(昆山市超声仪器有限公司)、DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
2 方法
2.1 黄精炮制品的制备
2.1.1 生黄精 除去杂质,洗净,略润,切厚片,干燥。
2.1.2 黄精不同蒸晒时间炮制品 取原药材,除去杂质,洗净,将适量黄酒与净选好的生品黄精搅拌均匀,并闷润至黄酒被药材吸尽(每100 kg黄精,用黄酒20 kg)。要求第1次蒸制10 h至黄精中央发虚(蒸制操作时,要把蒸制过程中流出的汁液进行收集),放在太阳下晒8 h至药材外皮微干,之后将上一步的成品拌入收集的汁液和一定量的黄酒,并“闷润至辅料被药材吸尽”,再进行反复蒸晒,按第1回蒸制、干燥方法,再蒸10 h,再放到太阳下晒8 h至药材表面微干,再拌入上一步收集的汁液,一定量的黄酒,依照此方法连续操作,根据实验需求分别蒸晒1、3、5、7和9次,分别得到一蒸一晒黄精、三蒸三晒黄精、五蒸五晒黄精、七蒸七晒黄精和九蒸九晒黄精。
蒸晒过程中除去首末2次蒸制,其余蒸制所需酒的量为总体的70%。最后1次蒸制、晒干,将其余(20%)酒及收集的汁液拌入药材中,蒸至表面黑漆色,表面发亮。
2.1.3 酒黄精 取净黄精,加黄酒拌匀,置蒸制容器内,蒸30 h至蒸透,色泽黑润,口尝无麻舌感时,取出,稍晾,切厚片。
2.2 溶液的制备
2.2.1 混合对照品溶液制备 分别精密称取对照品薯蓣皂苷元1.7 mg、5-羟甲基糠醛2.0 mg,置于500 mL量瓶中,加甲醇溶解并至刻度,摇匀,过0.22 μm微孔滤膜,即得到薯蓣皂苷元3.476 4 mg/L、5-羟甲基糠醛3.974 0 mg/L混合对照品溶液。
2.2.2 供试品溶液制备 按照“2.1”项方法炮制得到黄精生品、酒黄精、一蒸一晒、三蒸三晒、五蒸五晒、七蒸七晒、九蒸九晒黄精炮制品,精密称定黄精粉末(过四号筛)4 g,加入70%乙醇100 mL,超声提取30 min,提取2次,合并滤液,减压浓缩至干,用70%甲醇复溶,通用型亲水亲脂平衡(PSL)固相萃取小柱,用20 mL甲醇活化,20 mL超纯水洗涤,将5 mL样品溶液倒入固相萃取小柱中,用20 mL超纯水淋洗,用40 mL甲醇洗脱,收集洗脱液,减压浓缩,用70%甲醇复溶并定容至25 mL,12 000 r/min离心取上清液。0.22 μm滤膜滤过后得到供试品溶液,4 ℃冰箱保存。
2.3 UPLC液相色谱条件
ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相,采用二元梯度洗脱:0~8 min,5%~21% A;8~17 min,21%~22% A;17~20 min,22%~40% A;20~30 min,40%~45% A;30~40 min,45%~73% A;40~45 min,73%~100% A;45~50 min,100%~5% A;50~55 min,5% A。体积流量0.3 mL/min,柱温30 ℃,进样量0.5 μL。
2.4 质谱条件
ESI源负离子模式检测。质谱参数:毛细管电压3.00 kV,样品锥孔电压40 V,源偏移电压80 V,源温120 ℃,脱溶剂温度450 ℃,锥孔气50 L/h,脱溶剂气体积流量800 L/h,雾化气压力600 kPa;扫描范围/50~1500。
2.5 黄精化学成分数据库建立
从ScienceDirect、Web of Science、CNKI、TCMSP等国内外数据库收集黄精属植物各种化学成分及名称。通过Masslynx V4.1软件Molecular Weight Calculator工具根据各成分分子式计算相对分子质量。建立包括化合物名称、分子式、相对分子质量、[M-H]−、[2M-H]−、和[M-H+HCOOH]−等信息的化学成分数据库。
2.6 质谱数据处理
使用Masslynx V4.1软件比较黄精九蒸九晒过程炮制过程成分变化,对比黄精化学成分数据库共鉴定炮制前后黄精中的61个化学成分,包括16个甾体皂苷类成分、12个黄酮类成分、5个木脂素类成分、1个香豆素类成分、3个生物碱类成分、4个脂肪酸类成分、3个氨基酸类成分、2个糖类成分、4个酯类成分、1个醛类成分、1个有机酸类成分及9个未知成分,具体见表1。
表1 UPLC-Q-TOP-MS对黄精九制过程中成分变化的鉴定分析
Table 1 UPLC-Q-TOP-MS identification and analysis of component changes in Polygonati Rhizoma during preparation
序号tR/min离子模式质量数(m/z)分子式裂解碎片鉴定成分归属 10.781[M-H]−142.049 7C6H9NO3127 [M-H-CH3]−L-焦谷氨酸甲酯[13]或异构体1~3 20.810[M-H]−341.109 3C12H22O11161 [M-H-H2O-Glc]−, 179 [M-H-Glc]−, 310 [M-H-CH2OH]−麦芽糖[14]或异构体1~7 30.820[M-H]−179.060 1C6H12O6161 [M-H-H2O]−葡萄糖[14]或异构体1~7 41.080[M-H]−128.037 2C5H7NO3110 [M-H-H2O]−L-焦谷氨酸[15]或异构体1~7 5*1.891[M-H]−125.024 8C6H6O3108 [M-H-OH]−5-羟甲基糠醛[15] 或异构体2~6 62.062[M-H]−164.071 2C9H12NO2134 [M-H-CH2OH]−, 146 [M-H-H2O]−polygonatine A[15] 或异构体1~4 73.370[M-H]−203.082 8C11H12N2O2158 [M-H-COOH]−, 186 [M-H-NH2]−L-色氨酸[16]或异构体1~4 83.470[M-H]−193.049 5C10H10O4149 [M-H-CO2]−, 178 [M-H-CH3]−silvaticol[15]或异构体1~5 93.500[M-H]−417.154 6C22H26O8399 [M-H-H2O]−, 402 [M-H-CH3]−(−)-丁香树脂酚[17]或异构体1~3 104.586[M-H]−125.024 8C6H6O3108 [M-H-OH]−未知16,7 115.333[M-H]−164.075 2C9H12NO2134 [M-H-CH2OH]−, 146 [M-H-H2O]−未知25~7 126.138[M-H]−563.141 6C26H28O14299 [M-H-2Xyl]−, 431 [M-H-Xyl]−, 545 [M-H-H2O]−牡荆素2"-O-葡萄糖苷[18]或异构体1~5 136.536[M-H]−233.047 0C12H10O5158 [M-H-C2H4O2-CH3]−, 173 [M-H-C2H4O2]−7-(羧基甲氧基)-4-甲基香豆素[19]或异构体2~7 146.578[M-H]−593.150 3C27H30O15269 [M-H-2Glc]−, 431 [M-H-Glc]−, 575 [M-H-H2O]−异肥皂草苷[20]或异构体1~3 156.940 [M-H]−193.053 1C10H10O4149 [M-H-CO2]−, 178 [M-H-CH3]−阿魏酸[15]或异构体5~7 167.168 [M-H]−233.047 0 C12H10O5158 [M-H-C2H4O2-CH3]−, 173 [M-H-C2H4O2]−未知35~7 177.420[M-H]−681.243 2C32H42O16519 [M-H-Glc]−, 663 [M-H-H2O]−(+)-松脂素-Ο-β-D-吡喃葡萄糖基 (1→6)-β-D-吡喃葡萄糖苷[20]或异构体1~5
续表1

序号tR/min离子模式质量数(m/z)分子式裂解碎片鉴定成分归属 187.560[M-H]−193.053 1C10H10O4149 [M-H-CO2]−, 178 [M-H-CH3]−邻苯二甲酸二甲酯[15]或异构体6,7 197.703[M-H]−741.268 0 C34H46O18417 [M-H-2Glc]−, 727 [M-H-CH2]−丁香树脂醇双苷[20]或异构体1~4 208.630[M-H+HCOOH]−1 255.556 3 C56H90O28751 [M+HCOOH-H-H2O-2Glc-Gal]−, 769 [M+HCOOH-H-2Glc-Gal]−, 931 [M+HCOOH-H-Glc-Gal]−, 1093 [M+HCOOH-H-Glc]−26-三醇-3-O-β-石蒜四糖苷[21]或异构体1~6 218.750[M-H]−417.154 6C22H26O8399 [M-H-H2O]−, 402 [M-H-CH3]−(+)-丁香脂素[17]或异构体4 228.755[M-H]−579.209 8 C28H36O13417 [M-H-Glc]−, 561 [M-H-H2O]−(−)-丁香树脂酚-O-β-D-葡萄糖苷[20]或异构体1~4 238.918[M-H]−1 225.583 4C56H94O28589 [M-H-Xyl-2Glc-Gal-H2O]−, 607 [M-H-Xyl-2Glc-Gal]−, 751 [M-H-Xyl-2Glc-H2O]−, 769 [M-H-Xyl-2Glc]−, 931 [M-H-Xyl-Glc]−, 1093 [M-H-Xyl]−西伯利亚蓼苷A[21]或异构体1~4 249.040[M-H]−1 063.500 0 C50H80O24901 [M-H-Gal]−, 1045 [M-H-H2O]−西伯利亚蓼苷B[21]或异构体1~4 259.440[M-H+HCOOH]−1 255.556 3 C56H90O28751 [M+HCOOH-H-H2O-2Glc-Gal]−, 769 [M+HCOOH-H-2Glc-Gal]−, 931 [M+HCOOH-H-Glc-Gal]−, 1093 [M+HCOOH-H-Glc]−未知45 2610.640[M-H]−282.117 8 C17H17NO3264 [M-H-H2O]−, 268 [M-H-CH2]−N-反式香豆酰酪胺[17]或异构体1~7 2710.960[M-H+ HCOOH]−1 255.561 3 C56H90O28751 [M+HCOOH-H-H2O-2Glc-Gal]−, 769 [M+HCOOH-H-2Glc-Gal]−, 931 [M+HCOOH-H-Glc-Gal]−, 1093 [M+HCOOH-H-Glc]−未知55 2811.408[M-H]−312.124 6C18H19NO4191 [M-H-C8H9O]−, 297 [M-H-CH3]−N-反式阿魏酸酪酰胺[20]或异构体1~7 2911.877[M-H]−299.097 4C17H16O5263 [M-H-2H2O]−, 281 [M-H-H2O]−6-甲基-4',5,7-三羟基-高异黄烷酮[22]或异构体4~6 3012.148[M-H]−445.117 3C22H22O10323 [M-H-Glc]−, 427 [M-H-H2O]−4′-去甲基亮氨酸7-O-β-D-吡喃葡萄糖苷[22]或异构体1~3 3112.680[M-H+ HCOOH]−1 255.561 5 C56H90O28751 [M+HCOOH-H-H2O-2Glc-Gal]−, 769 [M+HCOOH-H-2Glc-Gal]−, 931 [M+HCOOH-H-Glc-Gal]−, 1093 [M+HCOOH-H-Glc]−未知6 5 3212.855[M-H]−233.047 0 C12H10O5158 [M-H-C2H4O2-CH3]−, 173 [M-H-C2H4O2]−未知7 5~7 3315.405[M-H]−1 241.582 0 C57H94O29755 [M-H-3Glc]−, 917 [M-H-2Glc]−, 1061 [M-H-Glc-H2O]−, 1079 [M-H-Glc]−黄精呋甾醇苷[20]或异构体1~3 3415.747[M-H]−301.071 4C16H14O6256 [M-H-CO-H2O]−, 283 [M-H-H2O]−disporopsin[20]或异构体1 3519.667[M-H]−1 241.581 9 C57H94O29755 [M-H-3Glc]−, 917 [M-H-2Glc]−, 1061 [M-H-Glc-H2O]−, 1079 [M-H-Glc]−未知8 4,5 3620.444[M-H]−1 061.552 5C52H86O22575 [M-H-2Glc-Man]−, 737 [M-H-2Glc]−, 899 [M-H-Glc]−, 1 043 [M-H-H2O]−甲基原薯蓣皂苷[23]或异构体1~5 3720.833[M-H]−329.232 5C18H34O5311 [M-H-H2O]−, 315 [M-H-CH2]−, 284 [M-H-COOH]−天师酸[16]或异构体1~7 3821.402[M-H]−299.091 9C17H16O5193 [M-H-CH2-B]−, 281 [M-H-H2O]−5,7-二羟基-8-甲基-3-(4-羟基苄基)-铬酸盐-4-酮[22]或异构体1~7 3921.594[M-H]−315.087 6C17H16O6279 [M-H-2H2O]−, 297 [M-H-H2O]−玉竹皂苷B[22]或异构体1
续表1
1-黄精生品 2-黄精酒炙品 3-黄精一蒸一晒品 4-黄精三蒸三晒品 5-黄精五蒸五晒品 6-黄精七蒸七晒品 7-黄精九蒸九晒品 “*”与对照品对比鉴定 Glc-葡萄糖 Gal-半乳糖 Xyl-木糖 Man-甘露糖 Ara-阿拉伯糖 B-黄酮B环 E、F-甾体皂苷的E、F
1-crude2-roastedwine 3-one steaming and one drying4-three steaming and three drying5-five steaming and five drying6-seven steaming and seven drying7-nine steaming and nine drying“*” compared with the standard Glc-glucose Gal-galactose Xyl-xylose Man-mannose Ara-arabinose B-flavone B ring E, F-steroidal saponins E,F
3 结果与讨论
根据图1可见,无论是酒制还是蒸晒炮制,对黄精化学成分均具有较大的影响。
而本实验以负离子模式进行成分检测,从实验结果看,除了峰20、25、27、31以[M-H-HCOOH]−峰存在外,其余各峰主要以[M-H]−峰的形式存在。
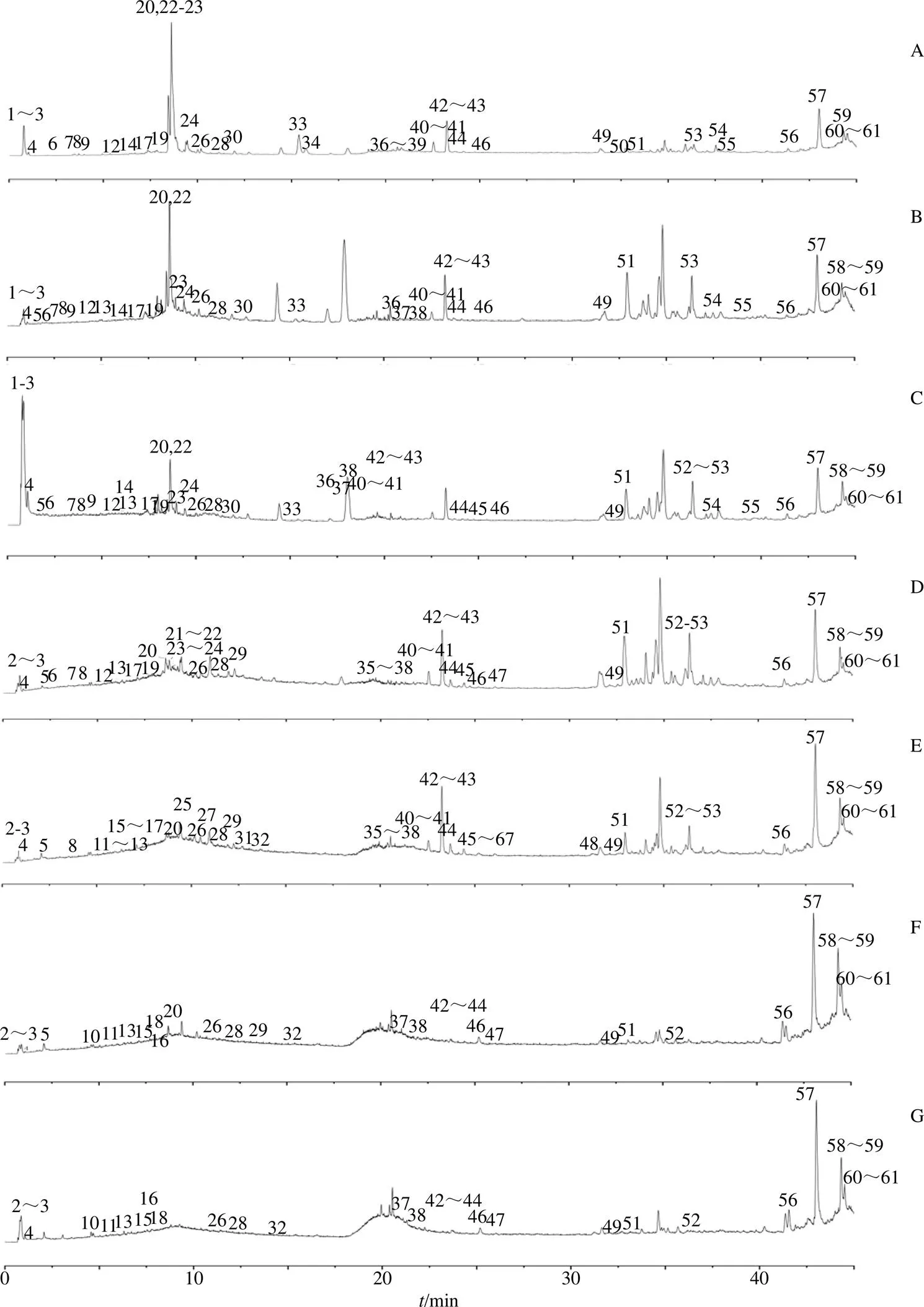
A-生品黄精 B-酒黄精 C-一蒸一晒黄精 D-三蒸三晒黄精 E-五蒸五晒黄精 F-七蒸七晒黄精 G-九蒸九晒黄精
3.1 甾体皂苷类成分鉴定
甾体皂苷是黄精属植物的主要次生代谢产物和活性成分,甾体皂苷类成分作为黄精主要有效成分,具有抗抑郁、抗HIV、抗菌、调节血糖、抗痴呆、改善学习记忆障碍、抗肿瘤等药理作用[26]。黄精C-27甾体皂苷分为呋喃甾烷型皂苷(如黄精皂苷A)和螺旋甾烷型皂苷(如黄精皂苷B)2类[26],而具有环戊烷骈多氢菲的基本母核甾体皂苷元共有A、B、C、D、E、F 6个环,E环和F环以螺缩酮形式联接,称为螺甾烷型。见图2。
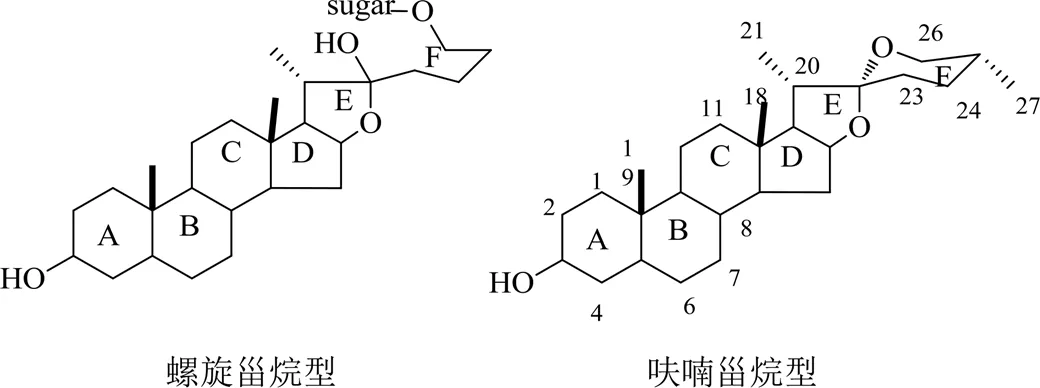
图2 黄精C-27甾体皂苷母核
本实验共鉴定得到16个甾体皂苷类成分。黄精甾体皂苷类成分多样[27],质谱鉴定一般依据连接糖基的数量和种类。而天然甾体皂苷类C-3的羟基易脱去形成失去1个水分子的碎片离子,以峰23为例解释黄精甾体皂苷类成分的裂解规律,如图3所示。峰23的准分子离子峰[M-H]−为/1 225.583 4,推测最有可能的分子式为C56H94O28,在其ESI-MS/MS谱中,[M-H]−离子产生碎片离子/1093 [M-H-Xyl]−和1063 [M-H-Glc]−,后续分别失去1个葡萄糖和1个木糖得到碎片离子/931 [M-H-Xyl-Glc]−,在丢失1个葡萄糖得到碎片离子/769 [M-H-Xyl-2Glc]−,进一步失去1个半乳糖得到碎片离子/607 [M-H-Xyl-2Glc-Gla]−,失去糖基后C-3位的羟基脱水产生碎片/589 [M-H-Xyl-2Glc-Gal-H2O]−,而呋喃甾烷型皂苷C-26位糖基脱去后,F环羟基脱水形成碎片离子751 [M-H-Xyl-2Glc-H2O]−,表明其在质谱中失去1个木糖和2个葡萄糖,由此将峰23鉴定为西伯利亚蓼苷A[28]。
同时,本实验在保留时间36.300 min时检测出薯蓣皂苷元,主要存在于三蒸三晒、五蒸去晒、七蒸七晒、九蒸九晒黄精炮制品中,随着炮制时间的增加含量逐渐升高。质谱中峰52的准分子离子峰[M-H]−为/413.297 6,推断最可能的分子式为C27H42O3,在ESI-MS/MS谱中,得到碎片离子峰/395 [M-H-H2O]−、/269 [M-H-EF]−和/251 [M-H-EF-H2O]−,结合对照品对比和参考文献,将峰52准确鉴定为薯蓣皂苷元。
3.2 黄酮类成分鉴定
黄酮类成分是黄精的有效成分之一,具有抗肿瘤、抗氧化等多种功效[29],而高异黄酮类是该属植物中的1个特征性成分,天然高异黄酮裂解过程失去B环和1个甲基,形成A环和C环碎片离子。以峰42解释黄精高异黄酮裂解规律(图4),峰42的准分子离子峰[M-H]−为/313.107 7,推测其最有可能的分子式为C18H18O5,在其ESI-MS/MS谱中,[M-H]−离子一方面脱水产生碎片离子/295 [M-H-H2O]−,另一方面脱去1个甲基和B环形成碎片离子/207 [M-H-CH2-B]−。基于此,推断峰42为高异黄酮类成分6,8-二甲基-4′,5,7-三羟基高异黄烷酮[22]。
而黄酮苷类成分的推测主要依据连接糖基的数量与种类,峰12的准分子离子峰[M-H]−为/563.141 6,推测其最有可能的分子式为C26H28O14,在其ESI-MS/MS谱中,分子离子峰[M-H]−产生碎片离子/545 [M-H-H2O]−、/431 [M-H-Xyl]−及/299 [M-H-2Xyl]−,推测其发生脱水、脱糖基。因此将峰12鉴定为黄酮苷类成分牡荆素- 2″--木糖苷[18]。
3.3 木脂素类成分鉴定
本实验木脂素类成分主要通过连接糖基的种类进行鉴别,如峰17的准分子离子峰[M-H]−为/681.243 2,推测其最有可能的分子式为C32H42O16,在其ESI-MS/MS谱中,准分子离子峰生成碎片离子/519 [M-H-Glc]−和/663 [M-H-H2O]−,猜测分别丢失1个葡萄糖和1个水分子。由此鉴定峰34为 (−)-松脂素--β--吡喃葡萄糖基 (1→6)-β--吡喃葡萄糖苷[30]。峰22的准分子离子峰[M-H]−为/579.209 8,推测其最可能的分子式为C28H36O13,在其ESI-MS/MS谱中,峰22准分子离子峰丢失1个水分子产生碎片离子/561 [M-H-H2O]−,脱去1个糖基生成/417 [M-H-Glc]−。由此鉴定该化合物为(−)-丁香树脂酚--β--葡萄糖苷[30]。
3.4 其他成分的鉴定
其他各类成分以特征性结构进行成分鉴别,如酯类成分中的酯基、有机酸中的羧基。
峰8的准分子离子峰[M-H]−为/193.053 1,推测其最有可能的分子式为C10H10O4,在其ESI-MS/MS谱中,[M-H]−离子产生碎片离子/178 [M-H-CH3]−、149 [M-H-CO2]−,提示该化合物中可能存在酯基。推断为酯类化合物silvaticol[31]。

图3 西伯利亚蓼苷A的二级质谱图及可能裂解规律

图4 6,8-二甲基-4′,5,7-三羟基高异黄烷酮二级质谱图及可能的裂解途径图
峰37的准分子离子峰[M-H]−为/329.232 5,推测其最有可能的分子式为C18H34O5,在其ESI-MS/MS谱中,[M-H]−离子产生碎片离子/311 [M-H-H2O]−、315 [M-H-CH2]−及284 [M-H-COOH]−,提示该化合物存在羟基、羧基等。推断为有机酸类化合物天师酸[16]。
3.5 成分变化情况分析
由表1可知,黄精九蒸九晒炮制过程中的化学成分种类存在明显的变化,其中图1可见,以甾体皂苷类成分为代表的大分子成分随着蒸晒次数的增加不断减少,甚至消失,而易于人体吸收的小分子成分及异构化成分却不断增加。
原甲基薯蓣皂苷和薯蓣皂苷随着蒸晒不断减少,在第5次蒸晒后消失,而薯蓣皂苷元从第1次蒸晒开始出现,并随着蒸晒次数不断增加,推测因其同母核皂苷在蒸晒过程中产生糖基脱落而形成。同时,以 (−)-丁香树脂酚--β--葡萄糖苷为代表的木质素类成分和以牡荆素-2″--木糖苷为代表的黄酮苷类成分在高温炮制的过程中脱去糖基,使得黄精炮制品种产生较多的单糖类成分,或许与九制黄精“味甘如饴”有关。而随着糖基脱落以薯蓣皂苷元、牡荆素为代表的单体成分亦是逐渐增加,增强了黄精抗感染、抗过敏、抗病毒和抗休克的药理作用。同时炮制过程中α-亚麻酸、亚油酸、棕榈酸等脂肪酸类成分的变化,或许与九制黄精“质地油润”相关。
炮制程度的差异造成了成分的巨大变化,-焦谷氨酸甲酯、(−)-丁香树脂酚、异肥皂草苷、黄精呋甾醇苷、铃兰皂苷A、延龄草苷等化学成分热稳定性差,均在蒸晒后消失。silvaticol、6-甲基-4,5,7-三羟基-高异黄烷酮、薯蓣皂苷元等成分在三蒸三晒或者五蒸五晒后出现,或许与炮制过程中苷元的增加和异构体的产生有关。
4 结论
本实验采用UPLC-Q-TOF-MS技术对黄精九蒸九晒炮制过程中的多种成分进行分析检测,根据所获得的精确相对分子质量,同时结合色谱保留行为、质谱裂解规律、特征碎片离子、对照品比对以及相关文献报道,共鉴定炮制前后黄精中的61个化学成分,包括16个甾体皂苷类成分、12个黄酮类成分、5个木脂素类成分、1个香豆素类成分、3个生物碱类成分、4个脂肪酸类成分、3个氨基酸类成分、2个糖类成分、4个酯类成分、1个醛类成分、1个有机酸类成分及9个未知成分。
黄精九蒸九晒炮制过程中化学成分的种类和含量都发生一定的变化,可能与黄精炮制过程中高温加热造成的苷元增加和异构体增加有关。如黄酮苷类成分牡荆素-2″--木糖苷,随着蒸晒时间的增加含量逐渐减少,至7次蒸晒成分消失,而其糖基脱落所产生的牡荆素在加热炮制后出现增量,随着炮制时间的增加,含量不断升高。同时,黄精甾体皂苷类成分在不断的蒸晒过程中大量减少甚至消失,如甲基原薯蓣皂苷、西伯利亚蓼苷C、spiroakyroside等;甾体皂苷元的含量逐渐升高,如薯蓣皂苷元。而受温度影响较小的热稳定性成分随着蒸晒次数的增加变化不大,如脂肪酸类成分α-亚麻酸。
黄精生品会刺激咽喉,九蒸九晒可降低咽喉刺激性,增强补益功效,然而对其炮制机制的探索尚不明确,本实验系统阐述黄精九蒸九晒炮制过程中的成分变化,并认为黄精蒸晒后的“增效”作用或许与黄精九蒸九晒炮制过程中化学成分变化有关,蒸晒过程中大分子成分大量分解形成易于人体吸收的小分子成分,如蒸晒后大量产生的小分子糖类具有一定的免疫调节作用,薯蓣皂苷元具有良好的调血脂作用,牡荆素对缺血性心肌损伤有良好的保护作用。然而,黄精九蒸九晒炮制机制的研究还需要做进一步探索。
中药有效成分的“质”“量”往往伴随着药物药效的变化,本实验从化学成分的层面阐述了黄精九蒸九晒炮制过程中化学成分的变化,为黄精九蒸九晒炮制机制的研究及蒸晒工艺的探索提供科学依据,利于黄精进一步的研究与开发。
利益冲突 所有作者均声明不存在利益冲突
[1] 张洪坤, 吴桂芳, 黄玉瑶, 等. 黄精不同九制炮制的过程研究 [J]. 时珍国医国药, 2019, 30(3): 602-605.
[2] 姜武, 叶传盛, 吴志刚, 等. 黄精的本草考证 [J]. 中药材, 2017, 40(11): 2713-2716.
[3] 杨华杰, 龚千锋, 于欢, 等. 黄精不同炮制品抗疲劳及抗氧化作用比较研究 [J]. 江西中医药, 2018, 49(2): 64-67.
[4] 陈晔, 孙晓生. 黄精的药理研究进展 [J]. 中药新药与临床药理, 2010, 21(3): 328-330.
[5] 何慧明, 刘宇. 黄精降脂方降血脂及抗动脉粥样硬化的实验研究 [J]. 辽宁中医杂志, 2005, 32(2): 168-169.
[6] 霍丽, 孙元隆, 许笑雯, 等. 黄精、三七配伍治疗冠心病心绞痛临床疗效的Meta分析[J]. 世界中医药, 2021, 16(20): 3033-3039.
[7] 涂明锋, 叶文峰. 黄精的药理作用及临床应用研究进展 [J]. 宜春学院学报, 2018, 40(9): 27-31.
[8] 王雷, 王盟. 黄精提取物抗肿瘤作用的实验研究 [J]. 饮食保健, 2017(5): 41-42.
[9] 刘京晶, 斯金平. 黄精本草考证与启迪 [J]. 中国中药杂志, 2018, 43(3): 631-636.
[10] 杨圣贤, 杨正明, 陈奕军, 等. 黄精“九蒸九制”炮制过程中多糖及皂苷的含量变化 [J]. 湖南师范大学学报: 医学版, 2015, 12(5): 141-144.
[11] 刘跃钧, 叶玉珠, 蒋燕锋, 等. 多花黄精炮制方法考证与研究进展 [J]. 世界中医药, 2021, 16(3): 516-521.
[12] 姜宇宣, 谢国勇, 秦民坚. 中药材“九蒸九晒”炮制方法的研究进展 [J]. 中国野生植物资源, 2019, 38(2): 48-51.
[13] 王巧莲. 黄精根茎化学成分及其抗炎活性研究 [D]. 北京: 北京化工大学, 2016.
[14] 方园. 黄精多糖和低聚糖的分离与结构解析 [D]. 无锡: 江南大学, 2011.
[15] 陈辉, 顾念念, 郝志友, 等. 黄精乙酸乙酯部位的化学成分研究 [J]. 中药材, 2017, 40(6): 1345-1347.
[16] 高颖, 戚楚露, 张磊, 等. 黄精新鲜药材的化学成分 [J]. 药学与临床研究, 2015, 23(4): 365-367.
[17] 李海明, 白虹, 李巍, 等. 玉竹化学成分研究 [J]. 食品与药品, 2010, 12(3): 102-104.
[18] 韦海红, 潘小姣, 邓家刚, 等. 木菠萝叶降血脂活性成分分析 [J]. 中国实验方剂学杂志, 2016, 22(15): 51-54.
[19] 吴毅, 李娟娟, 郭磊, 等. 基于GC-MS和UPLC-Q-TOF-MS的炆黄精的化学成分识别 [A] //中国化学会第十一届全国天然有机化学学术会议论文集 [C]. 上海: 中国化学会, 2016: 9.
[20] Nagai M, Akita K, Yamada K,. The effect of isosaponarin isolated from wasabi leaf on collagen synthesis in human fibroblasts and its underlying mechanism [J]., 2010, 64(3): 305-312.
[21] Son K H, Do J C, Kang S S. Steroidal saponins from the rhizomes of[J]., 1990, 53(2): 333-339.
[22] 陶爱恩, 张晓灿, 杜泽飞, 等. 黄精属植物中黄酮类化合物及其药理活性研究进展 [J]. 中草药, 2018, 49(9): 2163-2171.
[23] 张英朔. 黄精皂苷的制备、抗癌活性及其机理 [D]. 合肥: 合肥工业大学, 2019.
[24] 杨崇仁, 张影, 王东, 等. 黄精属植物甾体皂苷的分子进化及其化学分类学意义 [J]. 云南植物研究, 2007, 29(5): 591-600.
[25] 魏征, 曾林燕, 宋志前, 等. 顶空-气相色谱-质谱联用分析黄精炮制过程化学成分的变化 [J]. 中国实验方剂学杂志, 2012, 18(20): 115-118.
[26] 李洁, 王喻淇, 梅晓丹, 等. 固相萃取结合UHPLC-LTQ-orbitrap MS分析黄精发酵前后的化学成分 [J]. 中草药, 2019, 50(13): 3029-3036.
[27] 张洁, 马百平, 杨云, 等. 黄精属植物甾体皂苷类成分及药理活性研究进展 [J]. 中国药学杂志, 2006, 41(5): 330-332.
[28] 孙隆儒. 黄精化学成分及生物活性的研究 [D]. 沈阳: 沈阳药科大学, 1999.
[29] 姜程曦, 张铁军, 陈常青, 等. 黄精的研究进展及其质量标志物的预测分析 [J]. 中草药, 2017, 48(1): 1-16.
[30] 张英朔. 黄精皂苷的制备、抗癌活性及其机理 [D]. 合肥: 合肥工业大学, 2019.
[31] 杨崇仁, 张影, 王东, 等. 黄精属植物甾体皂苷的分子进化及其化学分类学意义 [J]. 云南植物研究, 2007, 29(5): 591-600.
Analysis on chemical components changes ofin processing of nine times steaming and nine times sunning by UPLC-Q-TOF-MS/MS
LIANG Ze-hua1, PAN Ying-jie1, QIU Li-yuan1, WU Xin-yu1, XU Xiao-qiang2, SHU Yue-wen2, YUAN Qiang1
1. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 311400, China 2. Zhejiang Zaochun Tang Agricultural Development Co., Ltd, Longyou 324400, China
To analyze and identify the chemical constituents in the processing of Huangjing () after “nine times steaming and nine times sunning” by solid-phase extraction combined with ultra performance liquid chromatography electrospray ionization time of flight mass spectrometry (UPLC-Q-TOF-MS).ACQUITY UPLC BEH C18column (100 mm × 2.1 mm, 1.7 μm ) was used as gradient elution with acetonitrile-0.1% formic acid as mobile phase. Volume flow 0.3 mL/min was detected under electrospray ionization mode. The main chromatographic peaks were assigned by four stage time of flight mass spectrometry.According to the obtained accurate molecular weight, combined with the chromatographic retention behavior, mass spectrometry cleavage, characteristic fragment ions, reference comparison, and relevant literature reports, a total of 61 chemical components were identified in aqueous extracts and fermentation both from, including 16 steroidal saponins, 12 flavonoid components, five lignin components, one coumarin components, three alkaloid components, four fatty acid components, three amino acid components, two carbohydrate components, four ester components, one aldehyde components, one organic acid component and nine unknown ingredients.Processing has a great influence on the chemical components of, with the increase of processing time, such as component isomerization, the type and content of primary glycosides decrease, and the content of aglycones increase.The enhancing effect of nine times processing ofmay be related to the change of chemical composition. This study can provide theoretical basis for the study of the processing mechanism of, and provide scientific basis for the further development and utilization of.
; UPLC-Q-TOF-MS; nine times steaming and nine times sunning; processing; ingredients changes; diosgenin; sibiricoside A
R284.1
A
0253 - 2670(2022)16 - 4948 - 10
10.7501/j.issn.0253-2670.2022.16.004
2022-02-05
梁泽华(1976—),女,汉族,浙江绍兴人,副教授,博士,主要从事中药炮制工艺及质量标准方面研究。Tel: 13858042221
袁 强(1965—),男,汉族,浙江绍兴人,教授,博士,主要从事中药分析方面研究。Tel: 13588405258
[责任编辑 王文倩]
