沉默MBNL1-AS1对H2O2诱导心肌细胞损伤的影响
2022-08-15郭亮余新建
郭亮 余新建
心肌细胞的凋亡参与了许多心血管疾病的发生,发展过程,而氧化应激增加能激活心肌细胞凋亡[1,2]。因此,抑制心肌细胞损伤有利于心血管疾病的治疗。研究表明非编码RNA在心血管疾病相关的细胞死亡中发挥至关重要的作用[3]。盲肌样蛋白1反义RNA1(MBNL1-AS1)是一种lncRNA,研究报道MBNL1-AS1的下调通过靶向KCNMA1,保护了七氟醚预处理的小鼠免于缺血再灌注损伤[4]。研究报道敲低PVT1可通过上调miR-135a-5p来减轻缺氧引起的H9c2细胞损伤[5]。在大鼠原代心肌细胞中,沉默circArhgap12通过海绵miR-135a-5p促进细胞凋亡和氧化应激[6]。Krüppel样因子4(KLF4)是一种锌指结构转录因子,研究报道miR-506和miR-214的过表达通过抑制KLF4和KLF5的表达对H2O2引起的心肌损伤具有保护作用[7]。SNHG14通过在体外调节miR-25-3p/KLF4轴来保护H9c2细胞免受缺氧诱导的损伤[8]。而MBNL1-AS1是否通过调控miR-135a-5p及KLF4影响心肌损伤尚不清楚。因此,本实验用H2O2用处理心肌细胞H9C2,研究MBNL1-AS1对心肌细胞损伤的影响及机制是否与miR-135a-5p和KLF4有关。
1 材料与方法
1.1 试剂材料 H9C2细胞(美国ATCC;DMEM培养基美国Hyclone公司;过氧化氢(H2O2)溶液购自上海经科化学科技有限公司;荧光定量试剂盒购自日本Takara;蛋白提取试剂盒购自美国Invent公司;凋亡检测试剂盒购自日本同仁研究所;MDA含量及SOD活性检测试剂盒购自上海信裕生物科技有限公司;双荧光素酶报告基因检测试剂盒购自美国AAT Bioquest 公司。
1.2 细胞处理与分组 H9C2细胞用DMEM培养基培养,用200 μmol/L的H2O2溶液培养H9C2细胞12 h作为H2O2组,正常培养的细胞作为Con组;将si-NC、si-MBNL1-AS1、miR-NC、miR-135a-5p转染至H9C2细胞后用200 μmol/L的H2O2溶液处理,作为H2O2+si-NC组、H2O2+si-MBNL1-AS1组、H2O2+miR-NC组、H2O2+miR-135a-5p组;将si-MBNL1-AS1分别与anti-miR-NC、anti-miR-135a-5p转染至H9C2细胞后用200 μmol/L的H2O2溶液处理,作为H2O2+si-MBNL1-AS1+anti-miR-NC组、H2O2+si-MBNL1-AS1+anti-miR-135a-5p组。
1.3 实时荧光定量PCR(RT-qPCR)检测MBNL1-AS1和miR-135a-5p的表达水平 提取各组心肌细胞总RNA,合成cDNA,然后进行PCR,相对表达量用2-△△Ct法计算。MBNL1-AS1上游引物序列:5’-CTCCCGCTT
CTACCGAC-3’,下游引物序列:5’-TTGGTGCATTTAA
GGCGGC-3’;GAPDH上游引物序列:5’-TTCACCACC
ATGGAGAAGGC-3’,下游引物序列:5’-GGCATGGAC
TGTGGTCATGA-3’;miR-135a-5p上游引物序列:5’-GCCGCTATGGCTTTTTATTCCTATGTGA-3’,下游引物序列:5’-CAGTGCGTGTCGTGGAGT-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’;引物由上海生工生物工程公司合成。
1.4 蛋白质印迹(Western blot)法检测KLF4蛋白表达 提取心肌细胞的总蛋白,然后通过SDS-PAGE分离蛋白,再转移至PVDF上,用5%脱脂牛奶封闭2 h,加入KLF4多克隆一抗后37℃孵育2 h,然后加入二抗室温孵育2 h,显影,定影,分析蛋白条带灰度值,以KLF4和GAPDH灰度值的比值作为蛋白相对表达水平。
1.5 流式细胞术检测细胞凋亡 孵育48 h后收集各组细胞,并用冷磷酸盐缓冲盐水(PBS)中洗涤,弃去上清液并将细胞重悬于结合缓冲液中,向每100 微升细胞悬液中加入10 μl Annexin V-FITC和5 μl PI,室温下孵育细胞15 min;再添加400 μl的结合缓冲液,轻轻混合,上流式细胞仪分析。
1.6 试剂盒检测SOD活性和MDA含量 细胞培养48 h后收集4组细胞,按试剂盒说明书进行操作。
1.7 双荧光素酶报告实验 构建MBNL1-AS1以及KLF4的荧光素酶野生型和突变型载体,然后将其分别与miR-NC和miR-135a-5p共转染至心肌细胞,按照说明书检测荧光素酶强度,用萤火虫荧光素酶和海肾荧光素酶强度的比值计算相对荧光素酶的活性。

2 结果
2.1 MBNL1-AS1、miR-135a-5p和KLF4的表达 与Con组相比,H2O2组心肌细胞中MBNL1-AS1表达水平升高,miR-135a-5p表达水平降低,KLF4蛋白表达水平升高(P<0.05);与H2O2组和H2O2+si-NC组相比,H2O2+si-MBNL1-AS1组心肌细胞中MBNL1-AS1表达水平降低,miR-135a-5p表达水平升高,KLF4蛋白表达水平降低(P<0.05)。见图1,表1。

图1 KLF4蛋白的表达

表1 MBNL1-AS1、miR-135a-5p和KLF4表达的检测
2.2 沉默MBNL1-AS1对H2O2诱导H9C2氧化应激的影响 与Con组比较,H2O2组心肌细胞中MDA含量升高(P<0.05),SOD活性降低(P<0.05);与H2O2组和H2O2+si-NC组比较,H2O2+si-MBNL1-AS1组心肌细胞中MDA含量降低(P<0.05),SOD活性升高(P<0.05)。见表2。

表2 沉默MBNL1-AS1减弱H2O2诱导的H9C2氧化应激
2.3 沉默MBNL1-AS1对H2O2诱导的H9C2损伤的影响 与Con组比较,H2O2组心肌细胞的凋亡率升高明显,差异有统计学意义(P<0.05);与H2O2组和
H2O2+si-NC组相比,H2O2+si-MBNL1-AS1组心肌细胞的凋亡率降低,差异有统计学意义(P<0.05)。见表3,图2。

表3 沉默MBNL1-AS1减轻H2O2诱导的H9C2损伤

图2 沉默MBNL1-AS1对凋亡率的检测
2.4 MBNL1-AS1、miR-135a-5p和KLF4靶向关系的验证 Starbase预测显示MBNL1-AS1与miR-135a-5p有互补的核苷酸序列;targetscan预测显示miR-135a-5p与KLF4有互补的核苷酸序列。wt-MBNL1-AS1或wt-KLF4与miR-135a-5p共转染的细胞荧光素酶活性降低;而mut-MBNL1-AS1或mut-KLF4与miR-135a-5p共转染的细胞荧光素酶活性无显著差异(P>0.05)。见图3,表4。

图3 MBNL1-AS1、miR-135a-5p和KLF4互补序列及荧光素酶活性

表4 双荧光素酶报告实验
2.5 miR-135a-5p对H2O2诱导的H9C2损伤氧化应激的影响 与H2O2+miR-NC组比较,H2O2+miR-135a-5p组miR-135a-5p表达水平升高,KLF4蛋白表达水平降低,MDA含量降低,SOD活性升高,细胞凋亡率降低,组间比较,差异均有统计学意义(P<0.05)。见图4,表5。

图4 miR-135a-5p对KLF4蛋白表达和凋亡率的检测

表5 miR-135a-5p减弱H2O2诱导的H9C2损伤氧化应激
2.6 抑制miR-135a-5p可逆转沉默MBNL1-AS1对H2O2诱导的H9C2损伤氧化应激的影响 与H2O2+si-MBNL1-AS1组和H2O2+si-MBNL1-AS1+anti-miR-NC组相比,miR-135a-5p表达水平降低,KLF4蛋白表达水平升高,MDA含量升高,SOD活性降低,细胞凋亡率升高(P<0.05)。见图5,表6。
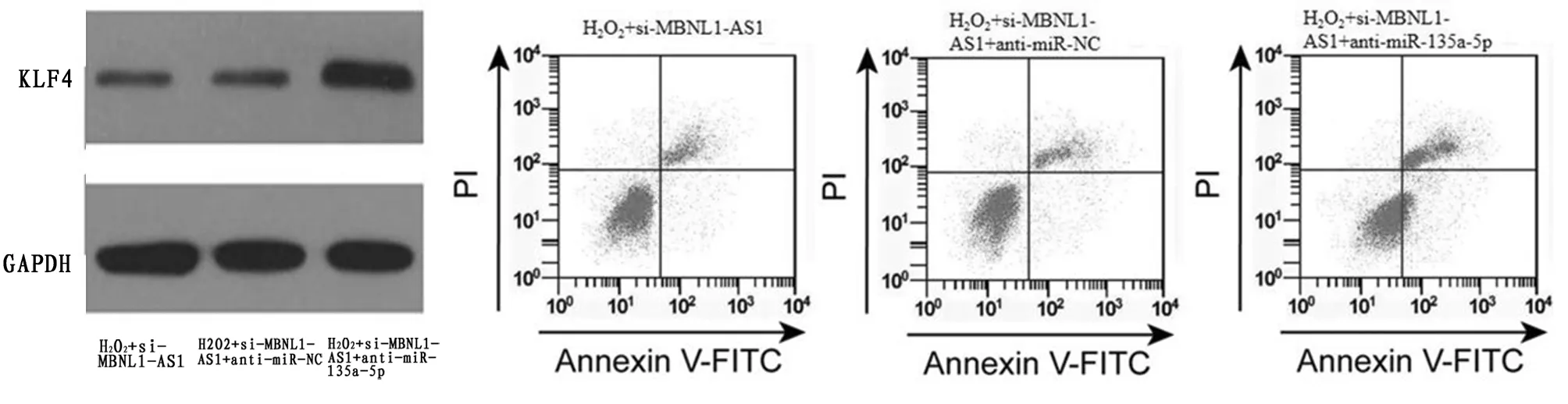
图5 抑制miR-135a-5p可逆转沉默MBNL1-AS1对KLF4蛋白表达和凋亡率的检测

表6 抑制miR-135a-5p可逆转沉默MBNL1-AS1对H2O2诱导的H9C2的影响
3 讨论
心肌梗死和心力衰竭等多种心血管疾病的发生发展过程中都有心肌细胞损伤[9,10]。研究报道lncRNA-HOTAIR通过miR-125抑制MMP2加剧了氧化应激诱导的H9c2细胞损伤[11]。LncRNA Gpr19抑制通过miR-324-5p/Mtfr1轴抑制细胞细胞凋亡和氧化应激,从而减轻了急性心肌梗塞后的缺血再灌注损伤[12]。本实验结果显示,过氧化氢诱导的心肌细胞中MBNL1-AS1表达水平升高;本实验沉默MBNL1-AS1表达后,心肌细胞的凋亡率降低,MDA含量降低,SOD活性升高;表明沉默MBNL1-AS1表达可抑制过氧化氢诱导的心肌细胞凋亡和氧化应激。
本实验显示,MBNL1-AS1与miR-135a-5p有结合位点,且证实MBNL1-AS1靶向调控miR-135a-5p。研究报道氧化低密度脂蛋白诱导的内皮细胞中miR-135a-5p表达降低,抑制SNHG6可通过上调miR-135a-5p减轻ox-LDL诱导的HUVEC损伤[13]。miR-135a-5p可通过下调SP1基因来抑制PC12细胞凋亡[14]。miR-135a-5p的过表达可以通过抑制ROCK1/2来改善脑缺氧/复氧损伤[15]。说明miR-135a-5p参与细胞损伤应激氧化应激反应。本实验结果显示,过氧化氢诱导的心肌细胞中miR-135a-5p表达水平降低;过表达miR-135a-5p后心肌细胞的凋亡率降低,MDA含量降低,SOD活性升高;表明过表达miR-135a-5p可抑制过氧化氢诱导的心肌细胞凋亡和氧化应激;且抑制miR-135a-5p可逆转沉默MBNL1-AS1对过氧化氢诱导的H9C2损伤的作用。表明MBNL1-AS1可能通过调控miR-135a-5p影响心肌细胞损伤。
研究报道KLF4通过调节心肌素的表达和活性来调节异丙肾上腺素诱导的心脏肥大[16]。抑制miR-92a可通过调控KLF4保护大鼠急性心肌梗死后的内皮细胞损伤[17]。miR-145通过靶向KLF4保护滤泡性颗粒细胞免受氧化应激诱导的细胞凋亡[18]。表明KLF4参与细胞损伤过程。本实验结果表明miR-135a-5p可靶向调控KLF4及抑制过氧化氢诱导的心肌细胞损伤,提示miR-135a-5p可能通过靶向调控KLF4影响心肌细胞损伤。沉默MBNL1-AS1后,miR-135a-5p表达水平升高,KLF4蛋白表达水平降低,提示MBNL1-AS1可能通过miR-135a-5p进而调控KLF4。
综上所述,沉默MBNL1-AS1可能通过调控miR-135a-5p/KLF4抑制过氧化氢诱导的心肌细胞损伤。
