基于p53通路探索芳基喹啉的抗结肠癌活性
2022-08-15鲁玉凡韩晨晨武兴康秦雪梅
鲁玉凡,韩晨晨,武兴康,秦雪梅
(山西大学 中医药现代研究中心,山西 太原 030006)
0 引言
P53是一种序列特异性的DNA结合蛋白,属于转录因子,通过调控多种基因的转录,参与基因组稳定性、细胞增殖、细胞凋亡、细胞分化、衰老、细胞自噬、炎症和代谢等过程[1]。目前发现超过10种压力信号诱导p53激活,包括代谢异常、蛋白质合成障碍、DNA损伤、表观遗传改变、端粒侵蚀、衰老、线粒体自噬、癌基因成瘾、缺氧和氧化还原失衡等。一些外源或内源的压力信号能够降低p53的水平[2],如人乳头瘤病毒编码的E6蛋白[3],腺病毒编码的SV40大T抗原[4],幽门螺杆菌编码的CagA蛋白[5],肾上腺糖皮质激素[6]和细胞因子[7]介导的细胞信号通路,均能降低p53的水平。
肿瘤是严重威胁人类生命健康的重大疾病,其发病率呈逐年上升态势。药物治疗是肿瘤治疗的三大支柱疗法之一,在过去70年来已经为抗击肿瘤做出突出贡献。但抗肿瘤药物通常毒性较大,个体之间疗效差异大,特别是几乎不可避免地会产生耐药性[8],使得抗肿瘤治疗失败。P53是肿瘤发生和治疗过程中的关键基因,p53的突变促进肿瘤的发生和赋予肿瘤耐药性的产生,肿瘤组织p53水平的升高是一些药物抗肿瘤所必需的,而正常组织p53水平的升高引起放疗及部分肿瘤治疗药物的毒副作用[9-10]。因此,探索p53对药物刺激的响应,为抗肿瘤药物研究提供了一种思路。
本研究首先构建p53荧光素酶报告基因系统,为评价细胞中p53介导的压力刺激和压力应激提供一种途径。为了探索该系统的应用模式,以结肠癌细胞为模式细胞,建立p53荧光素酶报告基因稳转结肠癌细胞,利用该细胞发现抗结肠癌活性化合物。采用19个芳基喹啉衍生物3a-3s(图1)为刺激药物,该类化合物为6-取代芳基-2-甲氧基喹啉衍生物,具有一定的体外抗乳腺癌活性,然而其对其他肿瘤的抗癌活性研究尚未展开[11]。本研究通过采用p53荧光素酶报告基因系统,评价结肠癌细胞中p53对3a-3s刺激的响应,发现抗结肠癌的最优化合物及其作用机制,旨在建立基于p53信号通路的药物筛选模型。
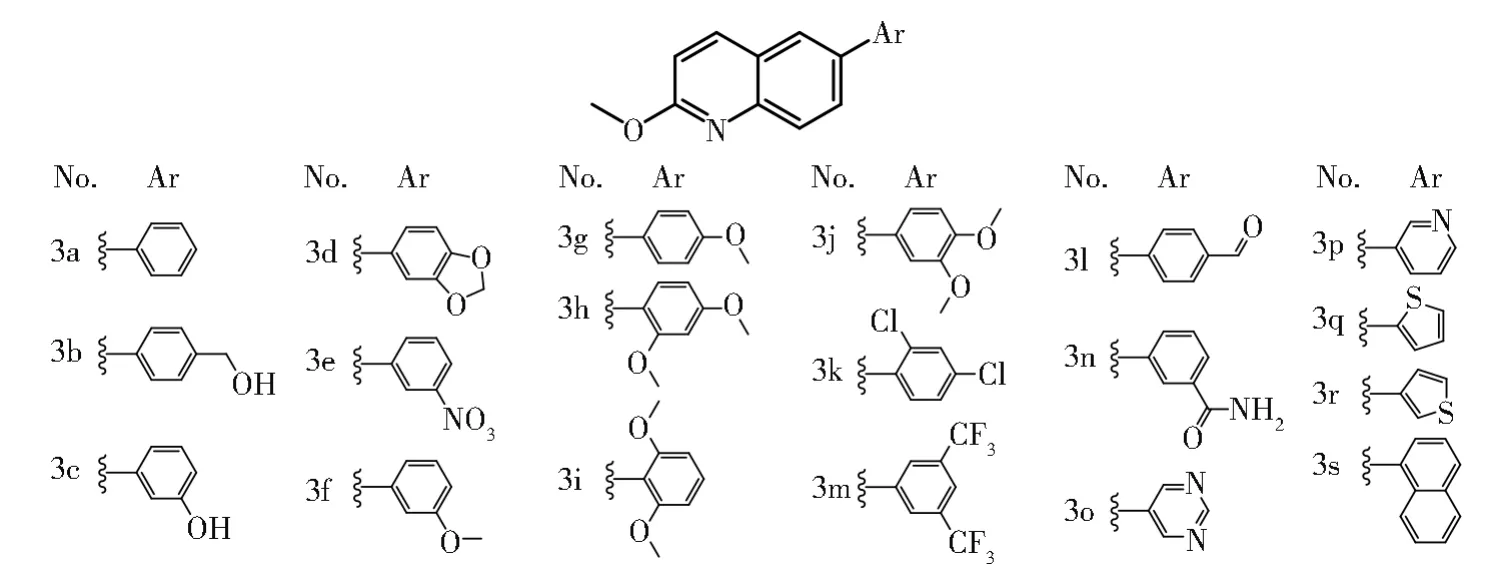
图1 6-取代芳基-2-甲氧基喹啉衍生物的化学结构Fig.1 Chemical structures of 6-substituted-aryl-2-methoxyquinoline derivatives
1 材料与方法
1.1 实验材料
质粒:慢病毒表达载体pCDH-CMV-MCSEF1-CopGFP-T2A-Puro购于美国Systembiop公司,慢病毒包装载体psPAX2和PMD2.G获赠于山东大学药学院,pp53-TA-luc载体购于碧云天。
抗体货号及厂商:PARP抗体(66520-1-Ig,Proteintech),p53抗体(10442-1-AP,Proteintech),γH2AX(9718T,CST),GAPDH(EPR16891,Abcam)。
DMEM(1640)完全培养基:DMEM(1640)培养基购于Biological Industries,使用时加入硫酸链霉素和氨苄西林至50 μg/mL,加入FBS(Biological Industries)至10%,配制为完全培养基。
化合物:6-取代芳基-2-甲氧基喹啉衍生物3a−3s由山东大学药学院沈月毛教授提供。
1.2 实验仪器
PCR扩增仪(TC-XP-D PCR仪,杭州博日科技有限公司)、琼脂糖水平电泳仪(DYY-10C,北京六一仪器厂)、低温冷冻离心机(Neofuge 13R,上海力申科技仪器有限公司)、多功能酶标仪(Infinite 200Pro,TECAN)、垂直电泳仪(Mini-PROTEANTetra,Bio-rad)、凝胶成像仪(ChemiDoc XRS+,Bio-rad)、超微量分光光度计(Spectra⁃Max® QuickDrop™,Molecular Devices)。
1.3 细胞培养
液氮中取出冻存细胞,37℃快速解冻,1 000 g离心10 s,轻轻去除上清冻存液,用温育培养基洗涤细胞一遍。培养基重悬细胞,接种于含有新鲜培养基的细胞培养盘,置于37℃,5% CO2,饱和湿度的培养箱中培养。293T/17、HCT116、SW480和HT29细胞购于中国科学院上海细胞库,HCT116(p53−/−)m 由厦门大学生命科学学院惠赠。293T/17、HCT116和HCT116(p53−/−)细胞使用DMEM完全培养基,SW480细胞使用1640完全培养基培养,HT29细胞用 DMEM/1640(1∶1)完全培养基培养。
1.4 载体构建
使用限制性内切酶SnaB I和Not I(Thermo⁃fisher)处理慢病毒载体pCDH-CMV-MCS-EF1-CopGFP-T2A-Puro,双酶切去除该载体的CMV启动子,获得线性载体。以pp53-TA-luc载体为模板,PCR扩增获得插入片段,该片段由p53特异性结合序列的启动子(p53 DBD和minP)和荧光素酶报告基因组成。采用exonuclease III(Thermofisher)介导的基因克隆技术,连接插入片段和线性慢病毒载体,转化Trans5α感受态细胞(北京全式金生物),挑取单克隆,PCR验证获得阳性克隆。选取阳性克隆,提取质粒,酶切验证,获得p53荧光素酶报告基因慢病毒载体pCDH-p53-Luc-EF1-CopGFP-T2A-Puro。
1.5 慢病毒包装、感染及稳转细胞株的构建
采用质粒提取试剂盒(CW2104M,康为世纪)制备pCDH-p53-Luc-EF1-CopGFP-T2APuro、psPAX2和PMD2.G质粒,测定浓度和纯度,−20℃储存。按照LipoFiter(汉恒生物)产品说明书进行转染操作,包装慢病毒。转染前一天,293T/17细胞接种于6孔板,使其在转染时细胞汇合度达到70%~90%。转染前,将LipoFiter和无血清DMEM培养基混合,质粒DNA(pCDH-p53-luc-EF1-CopGFP-T2A-Puro:psPAX2:PMD2.G=2∶2∶1)和无血清 DMEM 培养基混合,室温平衡5 min,二者轻轻混匀,室温孵育20 min,形成转染复合物。吸弃293T/17细胞的旧培养基,加入2 mL新鲜培养基,将转染复合物加入培养基中,轻轻晃匀。转染72 h后,收集培养基,0.44 μm滤膜过滤除去细胞碎片,获得慢病毒。
感染前一天,对数生长期的目的细胞接种于六孔板,使感染时细胞汇合率约为30%。含有慢病毒的培养基和新鲜培养基按1∶1的体积混合,加入待转染细胞,加入protamine sulfate(Sigma)至 10 μg/mL,轻晃培养基混匀。培养24 h,更换培养基继续培养。48 h后,荧光显微镜观察GFP的表达情况,观察到绿色荧光后,用含嘌呤霉素的新鲜培养基培进行筛选,其浓度为 1 μg/mL~5 μg/mL,具体浓度根据细胞类型确定。经过1~2周的持续筛选,感染细胞无死亡时,获得稳转细胞株。
1.6 荧光素酶的检测
采用荧光素酶报告基因检测试剂盒(RG005,碧云天)检测荧光素酶的表达水平。待检测细胞,PBS洗涤一遍,用报告基因细胞裂解液充分裂解后,12 000g离心5 min,取50 μL上清细胞裂解液转移至96孔白板中,加入50 μL平衡至室温的荧光素酶检测试剂,快速混匀后,用多功能酶标仪的化学发光模式检测光强度Aluc。测定蛋白裂解液中蛋白浓度A280,用蛋白浓度对光强度进行归一化处理。

1.7 体外抗肿瘤活性分析
采用磺酰罗丹明B(SRB)分析法测定体外抗肿瘤活性。对数生长期的细胞,胰酶消化,根据细胞类型用新鲜培养基将细胞密度调整为3~7×104个/mL,接种于 96孔板中,每孔 100 μL,培养过夜贴壁。将药物加入细胞中至待测浓度,继续培养72 h。去除培养基,轻轻加入100 μL预冷的10%(M/V)三氯乙酸,4℃固−μL的0.4%SRB染色液(SRB溶于1%冰醋酸),染色15 min。去除染色液,1%的冰醋酸洗涤五遍去除未结合染料。室温干燥,加入100 μL~200 μL 的 10 mmol/L Tris(pH 10.0)溶液,待染料完全溶解后,酶标仪检测OD570nm。细胞生长抑制率(%)=(OD对照─OD样品)/(OD对照─OD空白)×100%,其中OD对照是未用药物处理组吸光度,OD样品是药物处理组吸光度,OD空白是未有细胞组吸光度。
1.8 细胞死亡率分析
使用乳酸脱氢酶细胞毒性试剂盒(碧云天,C0016)检测培养基中的LDH释放量测定细胞死亡率。药物处理细胞的方法与上述体外抗肿瘤活性分析的方法一致,但设置了两个对照组。其中1个对照组加入培养基体积的10%的LDH释放液,吹打混匀,培养箱继续培养1 h,记为最大酶活组。到达预定时间后,400 g离心,取120 μL培养基上清,转移至新的96孔板,加入60 μL的LDH检测液,轻晃混匀,室温避光孵育30 min,酶标仪检测OD490nm。同时,应用SRB分析法测定细胞的OD570nm,检测各孔的相对细胞量,用作对每孔LDH释放量进行归一化处理(相对于细胞量的LDH释放量:RLDH=OD490nm/OD570nm),消除孔间由于细胞数量不同引起的差异。细胞死亡率(%)=(RLDH样品─RLDH对照)/(RLDH最大酶活─RLDH空白),其中RLDH样品是药物处理组的相对LDH释放量,RLDH对照是未用药物处理组的相对LDH释放量,RLDH最大酶活是加入LDH释放剂组的相对LDH释放量。
1.9 Western Blot
细胞刮收集细胞,用1×上样缓冲液(50 mM Tris-HCl,pH 6.8,2%SDS,12.5%(V/V)甘油,50 mmol/L DTT,0.01%溴酚蓝)溶解后,超声处理打碎DNA,95℃煮沸5 min,制备成蛋白样品,测定A280分析蛋白浓度。SDS-PAGE分离蛋白样品,将蛋白转移至PVDF膜上。转印有蛋白的PVDF膜,用5%的BSA(BSA溶解于TBST中)室温封闭60 min。配制一抗溶液,将膜浸入其中,4℃孵育过夜。一抗完毕后,用TBST 缓冲 液(20 mmol/L Tris-HCl,pH 7.6,130 mmol/L NaCl,0.1%Tween-20)洗 涤 膜 3次,每次5 min,二抗室温孵育60 min。二抗完毕后,用TBST洗涤膜3次,每次5 min,准备显影。配制ECL显影液,将膜浸泡于显影液中,1 min后,用凝胶成像仪观察拍照,使用Image lab软件对蛋白条带进行灰度分析。
1.10 数据分析
数据分析和图表制作采用GraphPad Prism 8.0进行,显著性差异采用Two-way ANOVA进行分析,*P<0.5,**P<0.1,ns表示没有显著性差异。
2 结果
2.1 P53荧光素酶报告基因系统的构建
P53荧光素酶报告基因系统通过构建p53荧光素酶报告基因稳转细胞株建立(图2(a))。为了高效获得稳转细胞株,首先构建基于慢病毒转染的p53荧光素酶报告基因载体,其次通过慢病毒转染的手段实现对p53荧光素酶报告基因的高效转染,最后通过抗性筛选获得p53荧光素酶报告基因稳转细胞株。以pCDHCMV-MCS-EF1-CopGFP-T2A-Puro慢病毒表达载体为骨架载体,将该载体启动外源基因表达的CMV启动子(CMV promoter),替换为含有p53特异性结合序列的启动子(p53 DBD和minP),然后在该启动子序列后插入报告基因荧光素酶,构建成p53报告基因慢病毒载体pCDH-p53-Luc-EF1-CopGFP-T2A-Puro。重组慢病毒和包装载体共同转染293T/17细胞,包装病毒。包装好的病毒转染目的细胞,用嘌呤霉素筛选,获得稳转细胞株。
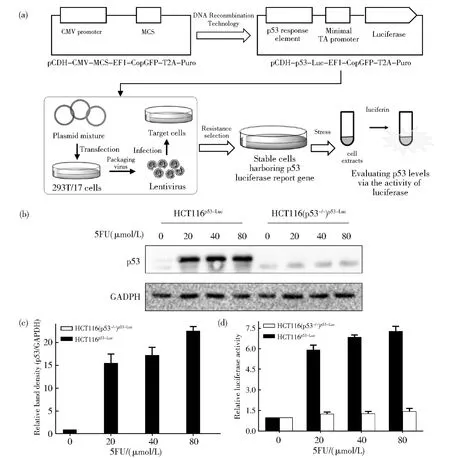
图2 基于p53信号通路的抗结肠癌药物筛选模型的建立。(a)P53荧光素酶报告基因系统的构建流程。(b)5FU诱导HCT116中p53的表达。HCT116p53-Luc和HCT116(p53-/-)p53-Luc细胞用5FU处理细胞24 h,收集细胞,western blot检测p53的表达水平。然后,用Image lab软件对(b)中条带进行灰度分析。以GAPDH为参照,计算p53条带的相对密度,数据在(c)中展示,数据重复次数n=3,表示为mean± SD。(d)5FU对HCT116p53-Luc和HCT116(p53-/-)p53-Luc细胞中荧光素酶的影响。用5FU处理HCT116p53-Luc和HCT116(p53-/-)p53-Luc细胞24 h后,收集细胞,分析荧光素酶的活性。数据重复次数n=3,表示为平均数±SDFig.2 Establishment of p53 signaling pathway-based anti-CRC drug screening models.(a)Schematic diagram of constructing p53 luciferase report gene system.(b)5FU induced the expression of p53 in HCT116 cells.HCT116p53-Lucand HCT116(p53-/-)p53-Luc cells were treated with 5FU for 24 h and collected for the detection of p53 levels through western bloting.Then,the band density was analyzed by Image lab software.The relative band density of p53 was calculated through defining GAPDH as control.The data were displayed in(c)and presented as mean±SD(n=3).(d)The effect of 5FU on luciferase activity in HCT116p53-Lucand HCT116(p53-/-)p53-Luccells.HCT116p53-Lucand HCT116(p53-/-)p53-Luc cells were treated with 5FU for 24 h and collected for the analysis of luciferase activity.The data were presented as mean±SD(n=3)
为了评价p53荧光素酶报告基因系统的功能,以结肠癌细胞为模式细胞,构建pCDH-p53-Luc-EF1-CopGFP-T2A-Puro载体的HCT116和HCT116(p53−/−)稳转细胞株,分别命名为HCT116p53−Luc和 HCT116(p53−/−)p53−Luc,检测该系统是否能够评价结肠癌细胞中p53对5氟尿嘧啶(5-fluorouracil,5FU)的响应。5FU是抗结肠癌常用化疗药物,能够激活细胞中p53的表达[12]。首先,采用 western blot检测 5FU 处理后,两株细胞内p53表达水平的变化。5FU能够诱导HCT116p53−Luc细胞内p53表达水平的升高,而对 p53 敲除细胞株 HCT116(p53−/−)p53−Luc中的 p53水平没有影响(图2(b)和 2(c))。进一步,采用荧光素酶报告基因检测试剂盒,评价 5FU处理后,HCT116p53−Luc和 HCT116(p53−/−)p53−Luc细胞中,荧光素酶的活性变化。结果表明,5FU能够诱导HCT116p53−Luc细胞中,荧光素酶活性的显著增加(图2(d)),与p53表达水平的变化一致(图2(c))。而在HCT116(p53−/−)p53−Luc细胞中,荧光素酶活性水平不受5FU的影响(图2(d)),与 western blot检测所得结果一致(图2(c))。综上结果,构建的p53荧光素酶报告基因系统,能特异性检测结肠癌细胞中p53对抗肿瘤药物的响应。
2.2 6-取代芳基-2-甲氧基喹啉类p53表达激活剂的发现
为了利用p53荧光素酶报告基因系统筛选抗结肠癌药物,探索19个6-取代芳基-2-甲氧基喹啉衍生物对HCT116p53−Luc细胞中荧光素酶活性的影响,发现结肠癌细胞p53表达激活剂。结果表明,19个化合物中,化合物3i和3s一定程度上提高HCT116p53−Luc细胞中荧光素酶的活性,且3i对荧光素酶活性的诱导能力大于3s(图3(a)),表明化合物3i和3s具有激活p53表达的潜力。为了进一步确证该结果,利用west⁃ern blot检测3i和3s对HCT116细胞内p53表达的影响。结果显示,在HCT116细胞中,3i和3s能够诱导p53的表达,且3i对p53表达的诱导能力要强于 3s(图3(b)和 3(c)),与 HCT116p53−Luc中报告基因检测所得结果一致;而在HCT116(p53−/−)中,由于该细胞株缺失 p53,没有检测到3i和3s对其中的p53表达的诱导(图3(b))。这说明6-取代芳基-2-甲氧基喹啉衍生物3i和3s激活结肠癌细胞HCT116中p53的表达。
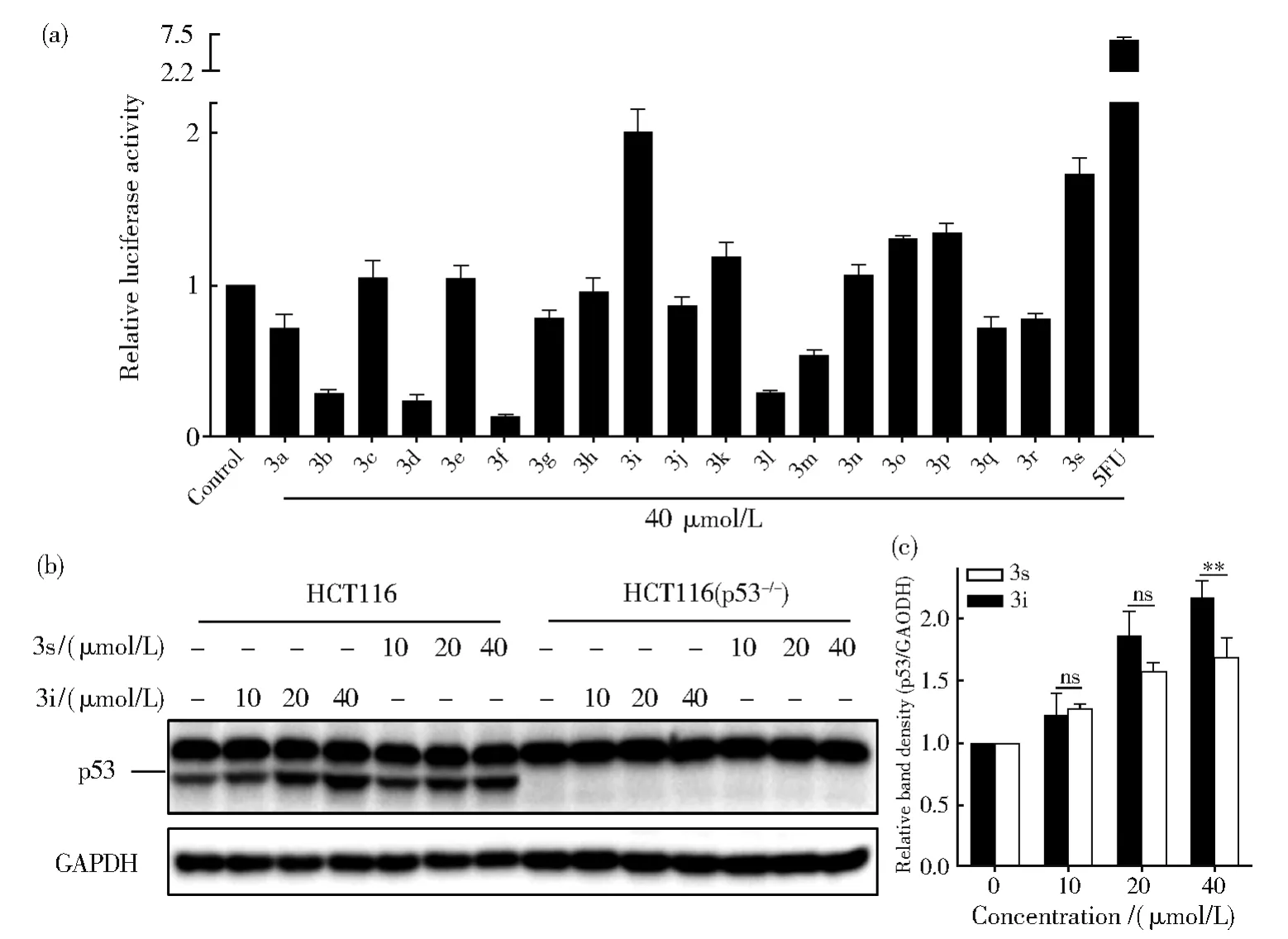
图3 利用p53荧光素酶报告基因系统从6-取代芳基-2-甲氧基喹啉衍生物中鉴定p53表达激活剂。(a)化合物3a-3s对HCT116p53-Luc细胞中荧光素酶活性的影响。用图中所示化合物(40 μmol/L)处理HCT116p53-Luc细胞24 h,5FU为阳性化合物,测定细胞中荧光素酶活性。数据重复次数n=3,表示为mean±SD。(b)化合物3i和3s诱导HCT116中p53的表达。所示浓度的3i和3s处理HCT116和HCT116(p53-/-)细胞24 h,收集细胞,western blot检测p53的表达水平。用Image lab软件对图中条带进行灰度分析,以GAPDH为参照,计算p53条带的相对密度,其结果在(c)图显示。数据重复次数n=3,表示为平均数±SD。ns表示没有显著性差异,**P<0.0021Fig.3 Identifying p53 expression activators from 6-substituted-aryl-2-methoxyquinoline derivatives through using p53 luciferase report gene system.(a)The effect of compound 3a-3s on the luciferase activity of HCT116p53-Luc.HCT116p53-Luccells were treated with indicated compounds at a dose of 40 μmol/L for 24 h,and subjected to luciferase activity analysis.5FU was used as a positive control.The data were presented as mean±SD(n=3).(b)Compound 3i and 3s induced the expression of p53 in HCT116 cells.HCT116 and HCT116(p53-/-)cells were treated with 3i and 3s at indicated concentrations for 24 h and collected for the detection of p53 levels through western blot.Then,the band density was analyzed by Image lab software.The relative band density of p53 was calculated through defining GAPDH as control.The data were displayed in(c)and presented as mean±SD(n=3),ns was indicated as not significant,**P<0.0021
2.3 6-取代芳基-2-甲氧基喹啉衍生物的抗结肠癌作用
药物诱导的p53水平的提高,起着促进修复药物诱导的细胞压力损伤的作用,当细胞损伤修复失败,p53诱导细胞凋亡,因而p53表达激活剂通常具有抗肿瘤活性。为了评价6-取代芳基-2-甲氧基喹啉衍生物的抗结肠癌活性,测定了40 μmol/L的3a-3s对HCT116细胞的体外抗肿瘤活性。结果显示,3i对HCT116细胞的体外抗肿瘤活性最强,3l和3s的活性次之(图4(a))。测定了不同浓度的3i和3s对四株结肠癌细胞 HCT116、HCT116(p53−/−)、HT29和SW480细胞的体外抗肿瘤活性。HCT116是p53 野生型细胞,而 HCT116(p53−/−)、HT29 和SW480是p53功能缺陷型细胞。结果显示,随着作用浓度的增加,3i和3s对四株细胞的生长抑制作用增强,表明3i和3s呈现浓度依赖性的抗肿瘤活性(图4(b))。随着作用时间延长而增强,3i和3s对HCT116细胞的生长抑制作用增强,表明3i和3s呈现时间依赖性的抗肿瘤活性(图4(b))。在 HCT116(p53−/−)、HT29 和SW480细胞中,3i和3s作用24 h的抗肿瘤活性强于作用48 h和72 h的,表明这三株细胞随着药物处理时间的延长而产生耐药性(图4(b))。这说明6-取代芳基-2-甲氧基喹啉衍生物3i和3s具有潜在的抗结肠癌活性,其药物敏感性与p53的活性水平相关。
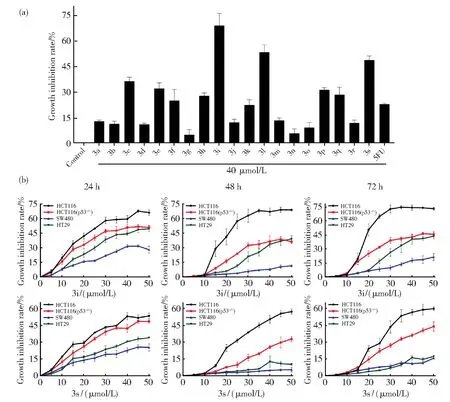
图4 6-取代芳基-2-甲氧基喹啉衍生物的体外抗结肠癌活性评价。(a)化合物3a-3s对HCT116的细胞生长抑制作用。用图中所示浓度的化合物处理HCT116细胞24 h,5FU为阳性化合物,然后进行体外抗肿瘤活性分析。数据:n=3,mean±SD。(b)3i和3s的体外抗结肠癌细胞活性。四株结肠癌细胞HCT116、HCT116(p53-/-)、HT29和SW480用图中所示浓度的3i和3s处理24、48、72 h,然后进行体外抗肿瘤活性分析。数据:n=3,平均数±SDFig.4 Evaluating the in vitro antitumor activities of 6-substituted-aryl-2-methoxyquinoline derivatives against CRC.(a)The effect of compound 3a-3s on the cell growth inhibition against HCT116 cells.HCT116 cells were treated with indicated compounds at a dose of 40 μmol/L−1for 24 h,and subjected to in vitro antitumor analysis.5FU was used as a positive control.The data were presented as mean±SD(n=3).(b)The antitumor activities of compound 3i and 3s against colorectal cancer.Four CRC cell lines HCT116,HCT116(p53-/-),HT29 and SW480 cells were respectively treated with 3i and 3s at indicated concentrations for 24 h,48 h and 72 h,and subjected to in vitro antitumor analysis.The data were presented as mean±SD(n=3)
2.4 化合物3i和3s的抗结肠癌作用机制
为了进一步发掘6-取代芳基-2-甲氧基喹啉衍生物3i和3s的抗结肠癌机制,采用western blot评价了代表化合物3i和3s对DNA损伤标志蛋白γH2AX和凋亡标志蛋白PARP裂解的影响。结果显示,3i和 3s在 HCT116 和 HCT116(p53−/−)细胞中能够诱导γH2AX水平的升高,且呈现浓度依赖性(图5(a)),表明3i和3s引起 DNA损伤。3i和3s在HCT116细胞中浓度依赖性地诱导PARP的裂解,而在 HCT116(p53−/−)中,只有高浓度的3i和3s才能诱导PARP的裂解(图5(a)),表明p53介导3i和3s诱导的细胞凋亡,p53缺失引起凋亡抵抗。此外,p53缺失不影响3i和3s诱导DNA损伤的能力,但减弱3i和3s诱导细胞凋亡的能力(图5(b)),表明3i和3s通过激活p53诱导细胞凋亡。3s对DNA损伤和p53表达激活的诱导能力均弱于3i,3i和3s对DNA损伤和p53表达激活的诱导能力呈正相关,而p53缺失不影响3i和3s诱导的DNA损伤(图3(b)和5(b)),表明3i和3s通过诱导DNA损伤激活p53。
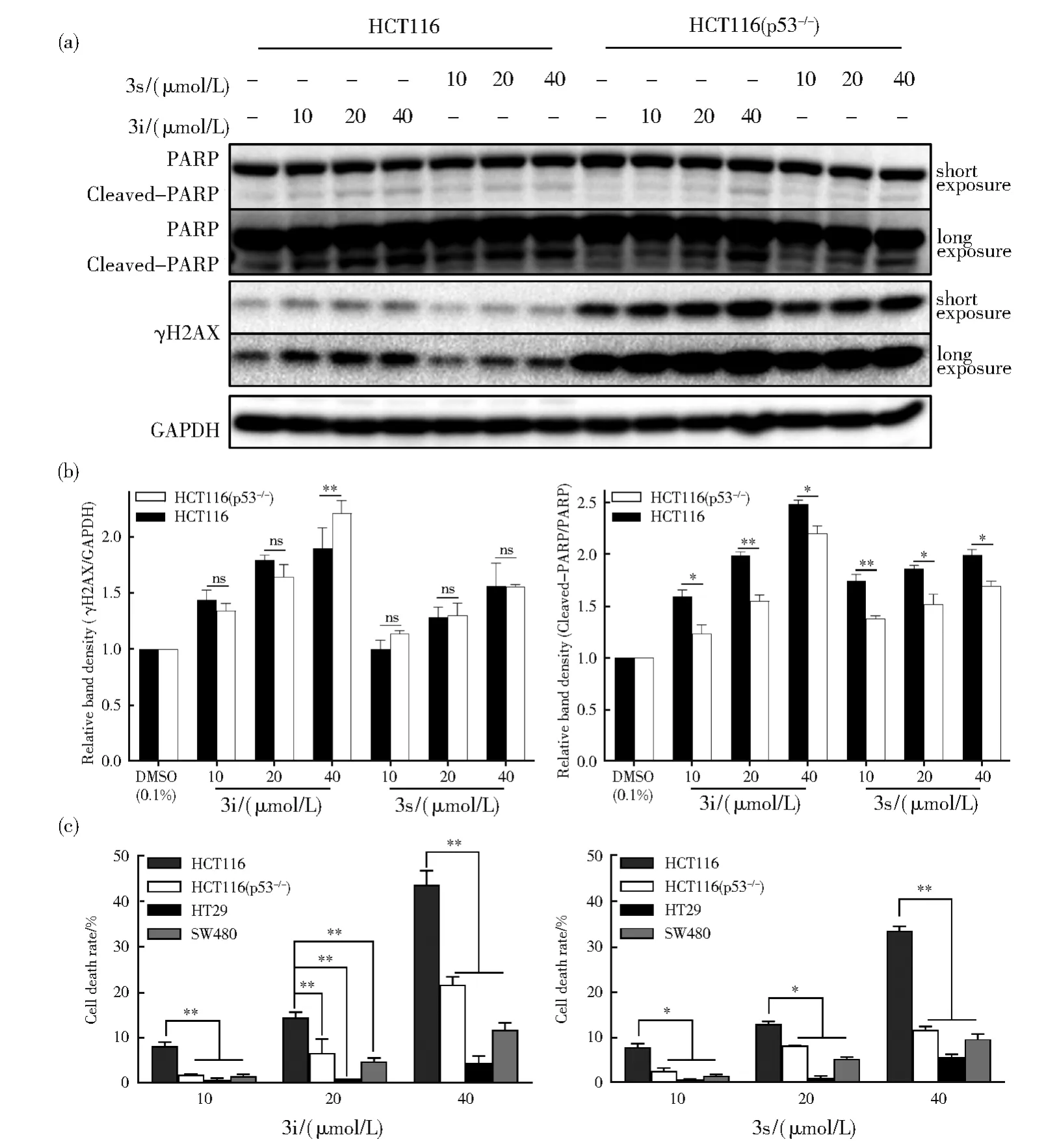
图5 3i和3s的抗结肠癌作用机制研究。(a)P53介导3i和3s诱导的细胞凋亡。图中所示浓度的3i和3s处理HCT116和HCT116(p53-/-)细胞24 h,收集细胞,western blot检测图中蛋白的表达水平。用Image lab软件对图中条带进行灰度分析,以GAPDH(PARP)为参照,计算γH2AX(Cleaved-PARP)条带的相对密度,其结果在(b)图显示。数据重复次数n=3,表示为平均数± SD。ns表示没有显著性差异,*P<0.05,**P<0.01。(c)P53缺陷减弱3i和3s诱导的细胞死亡。图中所示浓度的3i和3s处理HCT116、HCT116(p53-/-)、HT29和SW480细胞24 h,收集细胞,分析细胞死亡率。数据重复次数n=3,表示为平均数±SD。ns表示没有显著性差异Fig.5 Mining the anti-CRC mechanism of 3i and 3s.(a)P53 was involved in the apoptosis induced by 3i and 3s.HCT116 and HCT116(p53-/-)cells were treated with 3i and 3s at indicated concentrations for 24 h and collected for the detection of indicated proteins through western blot.Then,the band density was analyzed by Image lab software.The relative band density of γH2AX(Cleaved-PARP)was calculated through defining GAPDH(PARP)as control.The data were displayed in(b)and presented as mean±SD(n=3),ns was indicated as not significant,*P<0.05,**P<0.01.(c)P53 deficiency abated cell death induced by 3i and 3s.HCT116,HCT116(p53-/-),HT29 and SW480 cells were treated with 3i and 3s at indicated concentrations for 24 h and subjected to cell death assay.The data were presented as mean±SD(n=3),ns was indicated as not significant
3i和3s处理四株结肠癌细胞后,HCT116细胞的细胞死亡率显著大于 HCT116(p53−/−)、HT29和SW480细胞的细胞死亡率(图5(c))。HCT116(p53−/−)、HT29和 SW480细胞是 3株 p53功能缺陷的细胞株,HCT116(p53−/−)中p53被敲除,HT29和SW480细胞中存在p53 R273H的突变,该突变引起p53功能缺陷。因此,p53缺陷减弱3i和3s诱导的细胞死亡,表明3i和3s通过p53引起细胞死亡。
3 讨论
靶点药物筛选和表型药物筛选是药物发现的主要策略。“靶点药物筛选”以鉴定“药物─靶点”互作为策略,是过去30 a药物发现的主要手段,但其体内脱靶引起较高临床磨损率[13]。“表型药物筛选”以“药物→疾病表型”为指导,综合考虑疾病的复杂性,具有较高的药效成功率,但其不易解析药物作用机制和靶点[13]。药物以“药物→靶点→信号通路→药效”途径发挥作用,通常药物与靶点呈现“一对多”的互作模式调控信号通路,发挥药效,信号通路在药物作用中起承上启下的作用。基于“信号通路”的药物筛选策略既能提高药物筛选的药效成功率,又有利于药物作用机制解析,是创新药物研究策略、研究方法和技术发展的必然趋势[14]。本研究以多种疾病相关基因p53为研究对象,建立p53荧光素酶报告基因系统,旨在建立p53通路的药物筛选模式。利用该系统进行抗结肠癌药物筛选,化合物3a−3s中激活结肠癌细胞中p53水平的最优化合物为3i,抗结肠癌最优化合物为3i。前期研究表明,化合物3a-3s中,抗乳腺癌最优化合物为 3b[11],而应用本研究建立的筛选系统获得的抗结肠癌最优化合物为3i。这表明本研究构建的p53荧光素酶报告基因系统是抗肿瘤药物筛选的一种有效模型,而针对其他疾病药物的筛选还需进一步研究。
药物作用机制的研究是创新药物研究的重点和难点,基于信号通路药物筛选策略有利于药物的作用机制解析。本研究基于p53表达激活的筛选发现,3a−3s中抗结肠癌最优的化合物为3i。DNA损伤通常是抗肿瘤药物诱导p53表达激活的重要因素,而p53诱导细胞凋亡是抗肿瘤药物诱导肿瘤细胞死亡的重要机制。本研究优先聚焦于p53表达激活的关键因素之一DNA损伤,以及p53表达激活的关键功能之一细胞凋亡,解析3i抗结肠癌的作用机制。通过在HCT116和HCT116(p53−/−)中检测3i对DNA损伤和凋亡标志蛋白γH2AX和PARP的影响,表明3i通过DNA损伤激活的p53依赖的细胞凋亡抗结肠癌,对p53表达激活较弱的3s,抗结肠癌、诱导DNA损伤和细胞凋亡的活性均较弱。这表明通过p53荧光素酶报告基因系统筛选药物提高药物作用机制的研究效率。
肿瘤异质性引起抗肿瘤药物的治疗失败,不同的肿瘤细胞对药物的敏感性千差万别,抗肿瘤药物只能杀死一部分敏感细胞,而不敏感细胞对药物无效,引起耐药性的产生[15]。基因突变是引起肿瘤异质性的主要原因之一,超过50%的肿瘤携带有p53的突变,p53的突变能够使肿瘤细胞对放疗和引起DNA损伤的化疗药物产生抗性,影响肿瘤的治疗[15-16]。本研究发现,3i对 HCT116细胞的抗肿瘤活性随着作用时间延长而增强,而对HT29和SW480细胞的抗肿瘤活性随着作用时间延长而增减弱,这表明HT29和SW480细胞产生耐药性。HT29和SW480细胞中存在p53 R273H的突变[17],该突变引起p53功能缺失,使得p53依赖的细胞死亡减弱[18],赋予细胞对3i产生耐药性。因此,通过p53荧光素酶报告基因系统筛选抗肿瘤药物,能够指导药物敏感细胞和非敏感细胞的高效发现,有利于药物的精准应用。
4 结论
本研究采用“信号通路药物筛选”策略,聚焦于多种疾病相关基因p53,构建p53荧光素酶报告基因系统,用以评价p53介导的压力应激机制研究。通过构建结肠癌细胞的p53荧光素酶报告基因的稳转细胞,从19个6-取代芳基-2-甲氧基喹啉类衍生物3a−3s中筛选出最优抗结肠癌化合物3i。初步分子机制研究显示,3i在结肠癌细胞中引起DNA损伤,诱导p53表达水平升高,诱导细胞凋亡,引起细胞死亡,发挥抗结肠癌作用;而p53功能缺陷的结肠癌细胞对3i具有耐药性(图6)。
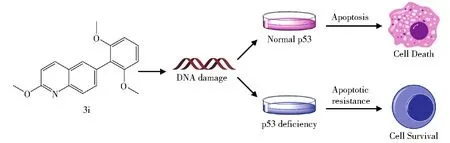
图6 3i的抗结肠癌作用机制示意图Fig.6 Diagram showing the anti-CRC mechanism of 3i
