基于杂质扣除⁃滴定法的碘化钾纯度定值及不确定度评定
2022-08-15公茂龙孙倩芸许爱华李锋丽
公茂龙 郭 波 孙倩芸 许爱华 李锋丽 周 兴
(1.山东省计量科学研究院,济南 250014;2.山东省计量检测中心,济南 250014)
碘离子溶液标准物质主要用于确定物质特性比量值、检验和分析测定结果、监测质量和定性控制,在碘离子监测质量保证中具有至关重要的作用[1⁃6]。碘化钾是碘离子溶液标准物质制备的重要原料,其纯度测定是保证碘离子溶液标准物质量值准确的必要步骤和重要意义。目前标准物质的定值方法主要有滴定法、质量平衡法等。其中,滴定法作为标准物质定值的基准方法,具备操作简便,数据准确的特点[7⁃9]。银量法是一种沉淀滴定法,采用吸附指示剂法测定碘离子含量。碘离子与银离子反应生成碘化银沉淀,通过硝酸银标准物质的浓度和滴定消耗的体积,可计算出碘化钾的纯度。由于其他离子的存在,会对该反应造成干扰,因此,需要扣除干扰离子的影响。本文对沉淀滴定法应用于碘化钾纯度的测定,以及干扰离子的扣除进行了研究和讨论,以期得到更为准确的碘化钾纯度结果。
1 实验部分
1.1 主要仪器和试剂
ICS⁃5000 离子色谱仪;碘化钾(分析纯);乙酸(分析纯);曙红钠;硝酸银容量分析用标准物质((0.1006±0.0002)mol/L)。
1.2 实验方法
滴定过程:准确称取0.4~0.5 克左右碘化钾试剂于200 mL 三角瓶中,再加入100 mL 水、10 mL 5%乙酸溶液和三滴曙红钠指示剂,然后用硝酸银标准溶液缓慢滴定,当溶液突变为红色时,停止滴定,并记下硝酸银标准溶液质量。
阴离子杂质的测定:将碘化钾稀释到浓度为40 μg/mL,用离子色谱分析其阴离子杂质,离子色谱仪的仪器条件为:抑制器:ASRS;检测器:电导;色谱柱:AS11⁃HC(4×250mm);进样量:25 μL;流速:0.8 mL/min;柱温:30 ℃;淋洗液浓度:30mM(KOH)。
2 结果与讨论
2.1 条件优化
2.1.1 吸附指示剂选择
根据银量法的原理,AgI 沉淀胶体微粒对指示剂离子的吸附能力应略小于对待测离子的吸附能力,否则指示剂将在化学计量点前变色,但是也不能太小,否则会使滴定终点出现过迟。根据相关文献,碘化银对卤化物和一些吸附指示剂的吸附能力强弱次序是:
I−>二甲基二碘荧光黄>Br−>曙红>Cl−>荧光黄
可见,二甲基二碘荧光黄和曙红均可作为指示剂,考虑到变色的明显等其他因素,选择曙红作为指示剂。
2.1.2 指示剂加入量
分别尝试 加入50μL、100μL、150μL、300μL 、500μL 曙红钠指示剂进行滴定,当100μL 和150μL时滴定终点显示,当超过300μL 时指示剂所带的红色较深不便对滴定终点进行观察,因此确定指示剂的加入量为100μL。
2.1.3 滴定剂的选择
为保证测定结果的可溯源,选择GBW(E)080462 硝酸银容量分析用标准物质作为滴定剂,其浓度标准值为:(0.1006±0.0002)mol/L。
2.2 杂质干扰及扣除
2.2.1 卤素离子的干扰
根据碘化银对卤化物和吸附指示剂的吸附能力可知,如果选择曙红作为指示剂,Br−也会在滴定中消耗硝酸银,从而造成干扰,因此需要扣除Br−的影响[10,11]。将碘化钾溶解稀释到40 μg/mL,通过离子色谱法测定其中的Br−。
从图1 中可以看到,在溴离子保留时间6.567 min 处,没有检测到明显的峰,说明碘化钾中Br−含量低于检出限(2.58 ng/mL),其含量低于0.01%,对滴定结果影响可忽略。

图1 碘化钾中的阴离子杂质离子色谱图
2.2.2 其他物质的干扰
除了卤素离子外,可能与银离子生成沉淀的还有硫酸根离子、亚硫酸根离子、碳酸根离子、磷酸根离子。由于滴定在酸性条件下进行,在酸性条件下溶液中碳酸根(Ka2=5.6×10−11)、氢氧根(K=1×10−14)、磷酸根(Ka3=4.4×10−13)含量极低,可以忽略其的影响。因此,需要考虑硫酸根、亚硫酸根的影响,采用离子色谱法测定二者的含量。根据图1可知,亚硫酸根的含量低于检出限,硫酸根含量较高,干扰明显,需要定量测定并扣除其对滴定的影响。
将国家二级标准物质GBW(E)硝酸根标准物质和硫酸根标准物质,稀释至质量浓度分别为50 ng/mL、100 ng/mL、150 ng/mL、200 ng/mL、250 ng/mL,测得硝酸根离子的浓度和硫酸根离子的浓度结果如表1。

表1 碘化钾中硫酸根含量测定结果ng/mL
2.3 碘化钾纯度滴定结果
重复滴定6次,滴定结果如表2 所示。
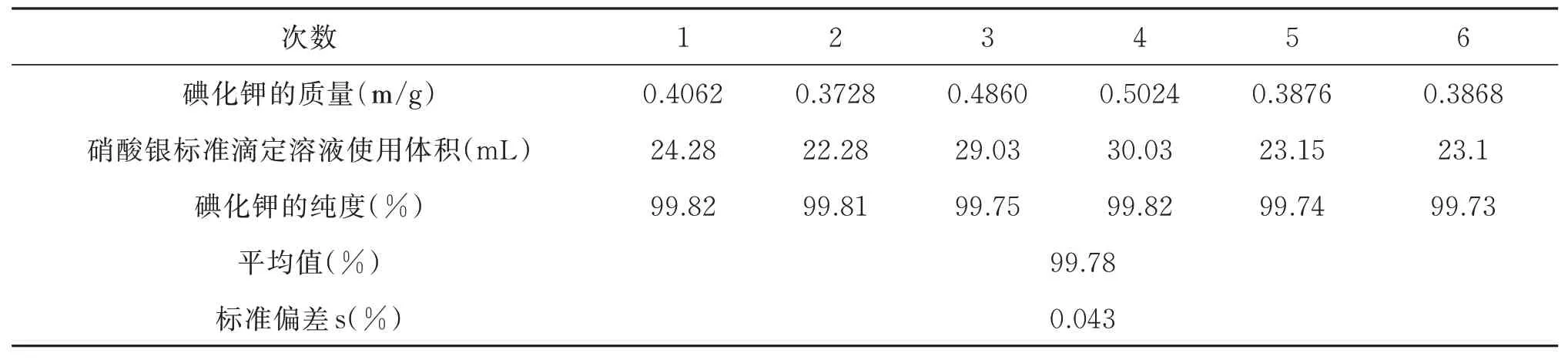
表2 银量法滴定测定碘化钾纯度结果
根据前述分析,需要扣除硫酸根离子的影响,根据2.2.2 的测定结果可知,40μg/mL 的碘化钾中硫酸根的含量为11.67 ng/mL,硫酸根与硝酸银发生反应的化学式为:
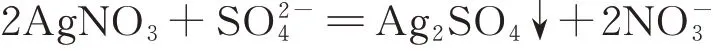
硫酸根换算成碘化钾的量为:

2.4 不确定度评定
2.4.1 数学模型
碘化钾沉淀滴定测纯度的数学模型为:

式中:ρ——碘化钾纯度,%;
C——硝酸银容量标准物质的浓度,mol/mL;
Vl——硝酸银容量标准物质滴定量,mL;
V0——空白实验硝酸银标准溶液滴定量,mL;
m——称取碘化钾的质量,g;
MKI——碘化钾的摩尔质量,166.0028 g/mol。
2.4.2 不确定分量的评定
1)硝酸银容量分析用标准物质的摩尔浓度引入的不确定度urel(c):
硝酸银容量分析用标准物质的摩尔浓度引入的不确定度根据标准物质证书为(0.1006±0.0002)mol/L,则urel(c) =0.099%
2)硝酸银滴定的体积引入的不确定度urel( )V :
硝酸银滴定体积引入的不确定度主要有3个分量,一个是滴定管溶剂允差引入的不确定度urel(V1);二是估读误差引入的不确定度urel(V2)。三是温度变化引入的不确定度urel(V3)。
根据滴定管检定证书,滴定管引入的相对标准不确定度为0.058%,50mL 滴定管读数引入的不确定度算0.014%,温度变化±5 ℃引入的相对标准不确定度为0.059%。
综上所述,
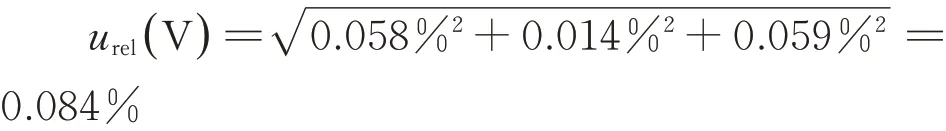
3)碘化钾的相对分子质量引入的不确定度urel(M) :
根据IUPAC 发布的相对原子质量表计算,urel(M)=0.0003%,该数值远远小于其他不确定度分量,可忽略。
4)碘化钾的称量质量引入的不确定度urel(m) :
碘化钾称量质量引入的不确定度主要有以下3个方面:一是称量变动性,根据历史记录,在10 g以内,变动性标准偏差为0.01 mg;二是天平示值允差引入的不确定度。三是天平分辨力引入的不确定度。将上述3 项合成得到天平称量质量的不确定度为0.031 mg。
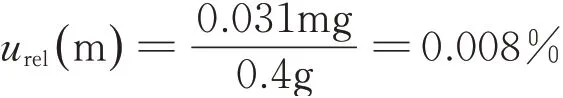
5)滴定重复性引入的不确定度urel(x) :
根据附表1 的数据可知,单次测量的重复性为RSD=0.08%,重复测定6次,则6次测量的重复性为
6)滴定终点判断引入的不确定度urel(y) :
在滴定分析中,虽然滴定终点与理论终点在大多数情况下是不一致的,但是,在滴定终点前后,被滴定溶液会发生突变,其误差为1~2 滴滴定剂的体积,取滴定剂(99.9~100.1)%作为终点误差的极限值,属正态分布,则
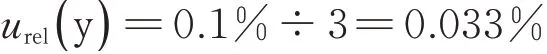
此外考虑到硝酸银与碘化钾反应的完全性、碘化钾中其他物质的干扰等因素,取未预见不确定度为0.01%。

2.4.4 不确定度的合成及扩展
将上述不确定度合成,得到合成不确定度为:
取k=2,则U=0.14%×2≈0.3%
3 结论
本文采用滴定法测定了碘化钾的纯度,同时对干扰离子进行了研究,采用离子色谱法对影响较大的硝酸根离子进行准确测定和扣除,在此基础上,对碘化钾纯度的不确定度进行了评定。该方法可用于化合物的纯度定值,同时保证了结果的溯源性,对无机离子标准物质研制具有重要的指导意义。
