O3/UV 多相催化氧化法处理UDMH 废水的研究
2022-08-13季增宝杨宝军孙剑宇吕功煊
季增宝, 杨宝军, 孙剑宇, 钱 铃, 吕功煊*
(1. 西安航天动力试验技术研究所, 陕西 西安710100; 2. 中国科学院兰州化学物理研究所, 甘肃 兰州 730000)
偏二甲肼(UDMH)是目前用量最多的常规液体推进剂, 近年来随着航天、 国防等领域的快速发展, UDMH 的使用量急剧增加, 由此产生的废水量也随之增加. UDMH 及其次级氧化产物具有很强的化学、 生物毒性, 会对其生产及使用环境造成巨大污染, 因此对UDMH 废水进行深度无害化处理十分必要.
目前, UDMH 废水的主流处理方法是吸附法、还原法和氧化法. 吸附法是采用活性碳[1-3]、 分子筛、 离子交换树脂等吸附材料将水中UDMH 及其次级氧化产物吸附去除. 该方法工艺简单、 初始污染物去除效率高, 但受限于吸附材料的吸附容量, 需要对吸附材料进行多次再生. 此外, 该法还需考虑污染物二次处理的问题. 还原法[4]是利用金属铁、铁镍、 镍铝等过渡金属或合金作为催化剂将UDMH还原为毒性相对较低的氨和胺类化合物. 该方法处理成本低、 操作简单, 能迅速高效地去除废水中的UDMH(99%以上), 不产生毒性更高的次级产物亚硝基二甲胺(NDMA). 但是该方法不能彻底去除废水中的总包有机碳(TOC)及氨氮. 氧化法[5-7]是利用臭氧、 双氧水、 次氯酸钠等强氧化剂对水中的UDMH 进行氧化分解. 该方法可将水中UDMH 迅速氧化分解, 但是会生成比UDMH 毒性更强且更难降解的NDMA、 甲醛、 偏腙、 四甲基四氮烯等次级产物[8].
在氧化法中, O3氧化法是使用较为广泛的技术, 它是利用O3的强氧化性氧化分解废水中的有机物. O3法具有接触时间短、 处理效率高、 使用范围宽、 操作简便等特点, 并兼具杀菌、 除臭、 脱色等能力. O3可在废水处理现场由空气制得, 避免了氧化剂的储运问题. 未反应的O3可自然分解或催化分解为氧气, 不会造成二次污染. 在O3氧化过程中引入紫外光, 还可进一步提高O3对污染物的氧化效率. 但是该方法存在O3利用效率低、 气液传质差、 对有机物的深度矿化作用有限等问题. 早期的研究发现, 具有N,N-二甲胺结构的化合物经O3处理后会产生毒性更强的次级氧化产物NDMA(摩尔产率高达50%~60%)[9-12], 特别是肼、 碳酰肼相连的N, N-二甲氨基化合物与O3作用后NDMA 摩尔产率可达94%. UDMH 与O3反应生成次级氧化产物NDMA 的速率非常快, 即使采用紫外光与O3技术(O3/UV)联用也不能使NDMA 完全降解[13-14]. 因此, 如何抑制和消除O3处理过程中UDMH 衍生的NDMA 成为目前限制O3/UV 技术的瓶颈.
文献曾报道[15-16], 多相催化氧化与O3/UV 联用可在一定程度上提高污水中有机污染物的去除效率. 采用Fe2O3/γ-Al2O3与O3/UV 联用技术对含有UDMH 的废水进行了氧化处理研究, 结果表明, 催化剂与O3/UV 联用能够显著提高对废水中UDMH的氧化分解效率且能有效地抑制NDMA 的生成和促进NDMA 的氧化消除. 在优化的反应条件下, 反应60 min, 可将初始浓度为50 mg/L 的UDMH 废水的TOC 降低到0.5 mg/L 以下, NDMA 的浓度降低到0.5 mg/L 以下. 我们还对UDMH 氧化降解反应动力学进行了研究, 测得了表观速率常数为0.542 min-1,反应符合一级反应. 催化剂经8 次循环仍保持较高的催化活性和稳定性. 我们的研究结果表明多相催化-O3/UV 联用技术对含UDMH 废水处理有优良的适用性, 综合效能优于现用的O3/UV 处理技术.
1 实验部分
1.1 试剂与仪器
我们使用的化学试剂均为分析纯, 使用前未进行进一步处理. 偏二甲肼由青海黎明化工有限责任公司提供, 纯度为99.5%.
TU-1810 紫外可见分光光度计(北京普析通用仪器有限公司); Shimadzu Essentia 高效液相色谱系统(日本岛津), 色谱柱为ZORABAX SB-C18(4.6×150 mm, 5 μm, Agilent); 7890A-5975C 气 相色谱质谱联用仪(Agilent); multi N/C2100 型TOC分析仪(德国耶拿), FR224CN 型电子天平(奥豪斯仪器有限公司), PHS-3C 台式pH 计(上海雷磁), O3发生器(北京同林3S-T), RG-185T 型台式高速离心机(上海卢湘仪离心机仪器有限公司), smartlab-SE X 射线衍射仪分析(XRD,日本株式会社理学),ESCALAB 250Xi 型X 射线光电子能谱仪( XPS,ThermoFisher Scientific), Magix PW 2403 型X 射 线荧光光谱仪(PANalytical 公司).
1.2 催化剂的制备
催化剂采用分步浸渍法制备, 具体制备步骤如下: 称取一定质量的硝酸铁, 溶于适量的去离子水中配置成质量百分比浓度为1%的硝酸铁浸渍溶液,再将一定量的载体浸渍在浸渍溶液中过夜, 然后过滤并于105 ℃ 烘干, 在400 ℃焙烧8 h, 重复浸渍-烘干-焙烧步骤5 次即得本实验所用催化剂. 通过X 射线荧光光谱法测定, 催化剂的活性组分Fe2O3的含量约为1%.
1.3 实验装置及方法
实验采用间歇反应方式进行, 使用500 mL 玻璃烧杯作为反应器, 每批次试验处理UDMH 模拟废液300 mL. O3发生器为北京同林3S-T, 产量3~110 mg/min, 可调. 紫外灯为8 W 无臭氧型, 灯管距反应液面约12 cm.
废水配制: 采用偏二甲肼与超纯水配制.
实验过程: 将配制好300 mL UDMH 废水加入到反应烧杯中, 通入臭氧, 臭氧气源为普通工业用氧气, 流量设定为200 mL/min, 臭氧浓度通过电流大小调节. 接通紫外光源, 实验采用3 支8 W 无臭氧型紫外灯. 采用10% NaOH 溶液或10% HCl 溶液调节pH 值. 反应开始, 定时取样, 高速离心后取清液进行分析. 依据实验要求, 在多相催化O3/UV 联用实验中加入一定量的催化剂.
1.4 分析方法
废水中UDMH 的浓度参照文献采用分光光度法测定[17], 使用氨基亚铁氰化钠为显色试剂. 溶液中的UDMH 和NDMA 使用气相色-质联用仪进行定性分析, 分析EI 离子源电子能量70 eV, 质量扫描范围为29 ~180m/z, 离子源温度230 ℃, 载气为高纯氦气, 流速为1 mL/min, 分流进样, 进样量为1 μL, 分流比为1 ∶5. 测试条件如下: 进样口温度250 ℃; 程序升温: 初始柱温40 ℃, 保持2.5 min,而后以30 ℃/min 的速率升温至220 ℃, 在220 ℃恒温 4 min.
NDMA 的浓度采用高效液相色谱标准工作曲线法测定, 测试条件: 柱温: 30 ℃, 进样量20 μL,用甲醇∶水=15 ∶85(V/V)作为流动相 (流动相流量为1.0 mL/min), 紫外检测器 (检测波长为230 nm). 废水的矿化程度用水中总包有机碳(TOC)计算去除率, TOC 测试采用TOC 分析仪进行.
2 结果与讨论
2.1 O3/UV联合方法对UDMH氧化降解研究
前人的研究已经发现, O3、 UV 或者O3/UV 联合方法可以有效地将水溶液中的UDMH 氧化去除, 在反应过程中可以明显地观察到UDMH 浓度的下降.但是对溶液的TOC 分析和反应体系里中间产物的跟踪研究发现, O3、 UV 或者O3/UV 联合方法都可以快速地降低水溶液中的UDMH 浓度, 但UDMH在反应过程中转变成了某些次级的氧化产物, 占比最多的是NDMA[10,12]. 伴随着溶液中UDMH 浓度的下降, NDMA 浓度却快速增加, 当UDMH 浓度已经比较低时, NDMA 的浓度依然比较高. 这表明NDMA 的氧化要比UDMH 的氧化困难得多, 仅在O3、 UV 或者O3/UV 联合作用下NDMA 完全氧化速度很慢, 是UDMH 完全氧化的多个步骤中的控速步骤[10,12]. 已有的文献结果也表明, NDMA 是很多水中有机物的次级氧化产物, 虽然那些初始有机物反应物的浓度已经大幅度降低, 但是NDMA 的浓度却显著地增大[11]. 文献研究还表明, NDMA 的完全氧化是这些有机物完全氧化的诸多步骤的决速步[18-19]. 因此, 要将含有UDMH 的废水深度处理,必须考虑要将在反应过程中生成的NDMA 尽快地氧化为终极氧化产物, 才能实现废水中UDMH 的完全氧化消除.
为此, 我们首先利用O3/UV 联合方法对UDMH的模拟废水进行了氧化反应研究, 实验结果表明,在O3/UV 的联合作用下, 溶液中的UDMH 浓度快速下降, 仅仅30 min, 溶液中UDMH 浓度已经接近于零(见图1). 但是对反应体系的TOC 跟踪结果表明, TOC 值的变化趋势与UDMH 浓度的变化趋势并不一致. TOC的下降速率要比UDMH浓度下降慢得多, 经过60 min反应, 仍有5.14 mg/L的TOC未被氧化, 这表明UDMH分解过程中生成了其它物种.我们对反应溶液进行了GC-MS分析, 结果表明溶液中存在明显的质量数为73的中间产物信号, 对比质谱数据库可以确定此中间产物为NDMA(图2). 为此,我们进一步对不同反应时间段的溶液进行了HPLC分析, 通过对比标准物质的保留时间, 进一步确定此中间产物为NDMA. 而后利用HPLC跟踪了NDMA浓度随反应时间的变化, 发现随着反应的进程,NDMA浓度不断增加, 先达到一个最大值后缓慢下降, 经过较长时间的反应其浓度才下降到一个较低的水平(图3). 我们观察到的NDMA浓度变化规律与文献报道的其它初始反应物在高级氧化过程中NDMA生成与演化规律类似[12], 这表明废水中UDMH氧化的瓶颈是NDMA氧化转化.

图1 O3/UV体系中UDMH、 NDMA和TOC的浓度随反应时间的变化趋势Fig.1 Concentration of UDMH, NDMA and TOC versus reaction time in the O3/UV system

图2 O3/UV氧化UDMH生成NDMA的GC-MS分析结果Fig.2 GC-MS results of NDMA formation during the UDMH oxidation by O3/UV
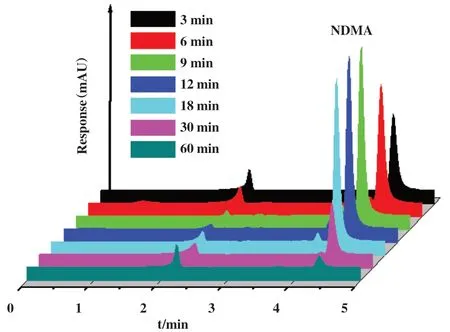
图3 O3/UV氧化UDMH的中间产物的HLCP分析结果Fig.3 HLCP results of intermediate products during UDMH oxidation by O3/UV
进一步, 我们对添加了催化剂的UDMH 氧化反应进行了研究, 催化剂为负载Fe 的Fe2O3/Al2O3,结果如图4 所示. 实验结果表明, 在有催化剂存在的情况下, 虽然条件与O3/UV时相同, UDMH的浓度下降更快, 仅用时5 min就下降为零, 同时TOC值的下降速率也明显加快, 仅反应30 min, TOC去除率就已达到98.5%, 经过60 min反应, TOC完全被消除. 这说明添加催化剂显著提升了UDMH的分解速率, 中间产物的进一步降解氧化分解也显著加快.对NDMA浓度的变化跟踪结果表明, 添加催化剂后,NDMA的生成总量较未添加催化剂的实验大幅度下降(图5), 其最高浓度下降了33.5%, 且生成的NDMA分解速率也明显加快. 反应18 min, NDMA浓度即下降至0.55 mg/L, 与之对应, 未添加催化剂时同一时间点体系中NDMA浓度为31.1 mg/L. 实验还发现经过60 min反应, 剩余的NDMA可完全分解.

图4 O3/UV+Fe2O3/Al2O3体系中UDMH、 NDMA和TOC的浓度随反应时间的变化情况Fig.4 Concentration of UDMH, NDMA and TOC versus reaction time in the O3/UV+Fe2O3/Al2O3 system

图5 O3/UV 和O3/UV+Fe2O3/Al2O3氧化UDMH过程中NDMA浓度随反应时间的变化Fig.5 Comparison of the concentration of NDMA versus reaction time in the O3/UV system and the O3/UV+Fe2O3/Al2O3 system
2.2 O3/UV协同多相催化氧化UDMH反应优化
2.2.1 溶液初始pH值 通常溶液初始pH值能够影响O3在催化剂表面上的分解与转化, 进而影响催化反应效率. 为了研究其对O3/UV协同多相催化氧化UDMH反应体系的影响, 笔者通过调控反应条件,即在UDMH初始浓度50 mg/L、 O3投加量为20 mg/min、 Fe2O3/Al2O3添加量10 g/L、 24 W UV灯照射、 机械搅拌500 r/min的条件下, 调节溶液的初始pH值分别为3、 7 和9, 以溶液中TOC去除率为指标, 考察了pH值对协同催化氧化体系中UDMH去除率的影响(图6). 实验结果表明, 在溶液初始pH=3的条件下, 废水中TOC去除效率较低. 反应开始6 min后, 水中TOC去除率仅有2.36%, 当反应进行到12 min时, 水中TOC去除率为32.67%, 之后随着反应进行, TOC去除率增加缓慢, 反应60 min后TOC去除率仅达到50.97%. 当pH值增加到7时, 水中TOC去除效率大幅度提升, 反应6 min TOC去除率就达到19.87%. 随着反应进行, 水中TOC被快速去除, 当反应进行到30 min时, UDMH去除可达98.53%, 反应持续进行60 min后UDMH完全被氧化分解. 而调节溶液初始pH=9时, UDMH的去除效率低于pH=7条件下的结果, 经过60 min反应, 水中TOC去除率才达到79.28%. 显然, 在酸性或碱性废水溶液中, O3/UV协同多相催化氧化UDMH的能力均低于中性溶液. 一般认为, 酸性条件下O3分子是主要的反应活性物种, 所以TOC去除效率较低. 而在碱性条件下,OH-会诱发O3链式分解为·OH[20], 随着溶液pH增加,·OH产量增大, 臭氧分解量也随之增加. 在快速的间接反应过程中, 污染物降解会产生、等阴离子, 这些阴离子会抑制·OH的氧化作用, 进而减弱体系的氧化降解能力[21]. 基于实验结果, 我们认为在协同催化氧化体系中, 溶液初始pH值为7是废水中UDMH降解效果最佳的pH条件.

图6 溶液初始pH值对UDMH催化氧化性能的影响Fig.6 Influence of initial pH value on degradation efficiency of UDMH
2.2.2 催化剂添加量的影响 我们考察了不同催化剂添加量对O3/UV协同多相催化氧化体系对UDMH降解性能的影响(图7). 从实验结果可以看出,经过60 min的反应, 废水中TOC去除率随着催化剂添加量的增加(从1到10 g/L)而增加, 在催化剂添加量为10 g/L条件下, TOC的去除率高达100%. 进一步提升添加量至15 g/L时, UDMH降解效果出现衰减. 尽管开始反应6 min后, TOC去除率为31.86%,高于同时间点催化剂添加量为10 g/L条件下TOC去除率, 但随后的各取样点水中TOC去除率均低于10 g/L条件下的去除率, 反应60 min后TOC去除率为94.08%. 这是由于在一定浓度范围内随着催化剂投加量的增加, 催化剂的表面积增加, 反应活性位增多, 使得反应体系中生成·OH的机会增大, 从而提高反应效率. 当催化剂投加量超过一定浓度后, 反应体系中生成更多的·OH, 导致其自身发生复合反应, 降低反应体系中·OH的有效浓度, 从而降低体系的反应效率[22]. 因此, 在该协同催化反应体系中,催化剂的最佳添加量为10 g/L.

图7 催化剂添加量对UDMH催化氧化性能的影响Fig.7 Influence of catalyst content on degradation efficiency of UDMH
2.2.3 O3投加量的影响 此外, 我们也讨论了O3投加量对O3/UV协同催化氧化体系中UDMH去除效率的影响. 如图8所示, 在其他反应参数最优条件下, 随着O3投加量的增加, 水中TOC去除率随之升高. 当O3投加量为10 mg/min时, 反应60 min后水中TOC去除率为88.65%, O3投加量增加至20 mg/min时, 反应60 min后TOC去除率达到100%; 而继续加大O3投加量至30 mg/min, 虽然反应开始阶段水中TOC去除率有明显提高, 但要达到TOC 100%的去除仍需反应60 min. 显然增加O3投加量对于UDMH去除效果是有限的, O3投加量的增加能在一定范围内提升TOC去除率, 但O3的实际利用率会随着O3投加量的增加而降低, 所以我们认为在该反应系统中O3的最佳投加量是20 mg/min.
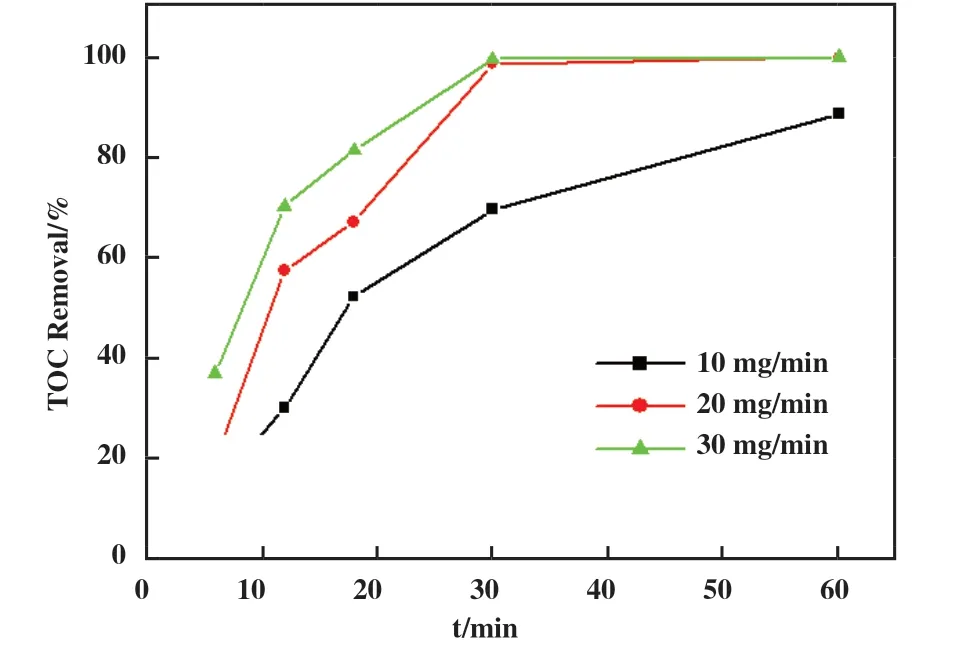
图8 O3投加量对UDMH催化氧化效率的影响Fig.8 Influence of O3 dosage on degradation efficiency of UDMH
2.3 O3/UV多相催化氧化UDMH反应动力学研究
为了进一步对比催化剂的引入对UDMH 和NDMA 降解性能的差别, 我们详细研究了有无催化剂存在条件下UDMH 和NDMA 在O3/UV 联合作用下的初始氧化速率. 研究结果表明(图9 和表1),UDMH 和NDMA 的初始反应速率常数都遵循一级动力学反应模型. 在没有添加催化剂的情况下,NDMA 反应速率常数(0.031 min-1)约是UDMH 反应速率常数(0.464 min-1)的6.7%, 所以由UDMH臭氧化生成的大量NDMA 不能被及时氧化分解, 这就造成溶液中NDMA 浓度保持在较高水平, 反应60 min 后仍不能完全将其消除. 当添加了催化剂后,由于Fe2O3/Al2O3催化剂的协同作用, NDMA 反应速率常数(0.055 min-1)占UDMH 反应速率常数(0.542 min-1)的比例被提升至10.1%, 结果表明由UDMH臭氧化生成的次级氧化产物NDMA 可以被催化剂快速氧化分解, 最终使得溶液中NDMA 浓度处在较低水平, 当反应进行60 min 后, 反应系统中形成的次级氧化产物NDMA 被全部氧化分解. 与O3/UV 氧化降解体系相比, 在O3/UV+Fe2O3/Al2O3的协同体系内UDMH 和NDMA 的降解速率均有不同程度的提升, 其中UDMH 的反应速率提升了16.8%, NDMA的反应速率提升了77.4%, 这正是O3/UV 协同多相催化氧化技术能够有效抑制并消除UDMH 臭氧化过程中次级氧化产物NDMA 生成的原因.

图9 UDMH和NDMA降解动力学测定结果Fig.9 Kinetics of UDMH and NDMA oxidation reaction

表1 UDMH和NDMA降解动力学测定数据Table 1 Kinetics data of UDMH and NDMA oxidation reaction
2.4 催化剂的重复使用性能
为了研究Fe2O3/Al2O3催化剂的稳定性, 在相同实验条件下反应60 min, 测定UMDH 废水中TOC的去除率. 每次反应后, 倾出溶液, 用超纯水清洗催化剂数次后进行下一轮UDMH 废水处理实验. 如图10 所示, 前5 次实验中UDMH 废水中TOC 去除率均为100%, 从第6 次循环实验开始, TOC 去除率出现了略微下降, 在循环使用第8 次时, TOC 去除率仍高达98.0%. 这些结果进一步表明Fe2O3/Al2O3催化剂在协同O3/UV 氧化UDMH 过程中具有较优异的稳定性.
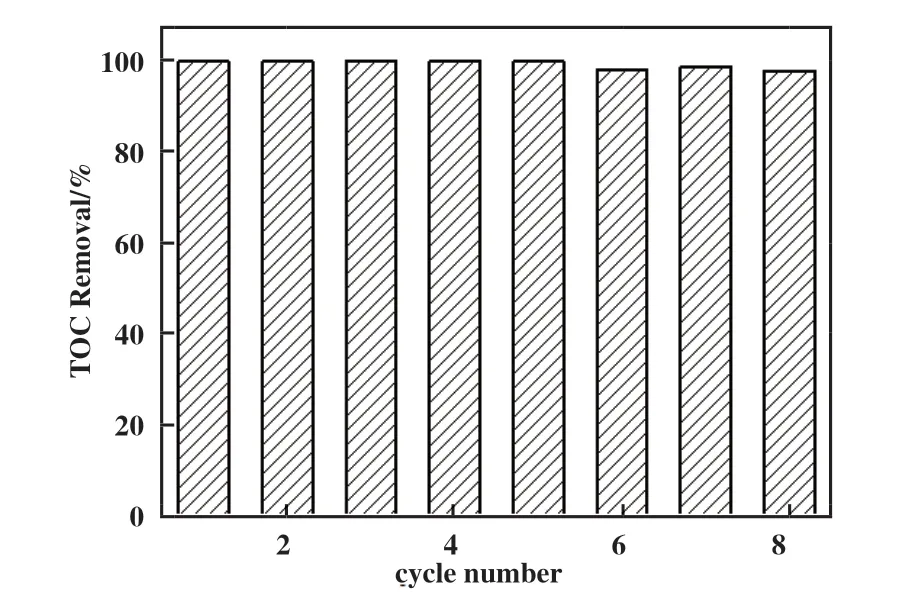
图10 催化剂重复使用实验结果Fig.10 Stability of the catalyst in multicycle degradation of UDMH by O3/UV
2.5 催化剂表征
2.5.1 催化剂的X-射线衍射(XRD)分析结果 图11给出了Fe2O3/γ-Al2O3催化剂在反应前后的XRD图谱. 在37.603°、 45.862°和67.032°处观察到衍射峰属于载体γ-Al2O3的特征衍射峰(PDF#10-0425), 分 别 对 应 于γ-Al2O3的(110)、(113)和(214)晶面. 在XRD图谱中未观察的Fe物种的相关衍射峰, 可能是Fe2O3在载体的表面呈无定型或高分散状态. 此外, 反应前后Fe2O3/γ-Al2O3催化剂的XRD衍射峰没有观察到明显差异, 这意味着该催化剂在反应过程中具有良好的稳定性.
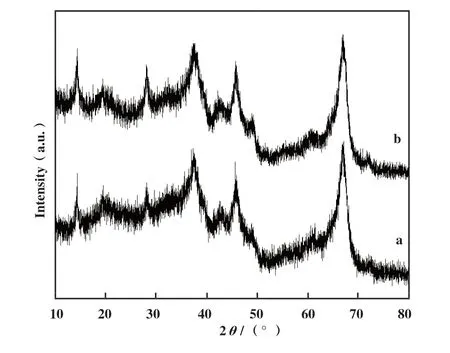
图11 反应前后催化剂的XRD图谱Fig.11 XRD patterns of the catalysts
2.5.2 催化剂的X-射线光电子能谱(XPS)分析结果 为了准确判断催化剂的γ-Al2O3载体表面Fe2O3, 笔者借助XPS技术检测催化剂表面Fe物种的化学状态(图12), 在Fe 2pXPS的图谱中, 结合能为712.2和724.4 eV信号峰归属于Fe 2p3/2和Fe 2p1/2, 是典型的3价铁的特征信号峰, 这意味着氧化铝载体表面铁物种是以氧化铁形式存在. 此外, 通过比较发现反应前后催化剂表面Fe元素的化学状态均未发生改变, 说明Fe2O3/Al2O3催化剂在长期的O3/UV催化氧化体系中具有较高的稳定性.

图12 反应前后催化剂的XPS图Fig.12 XPS spectrum of the catalyst
2.5.3 催化剂的X-射线荧光光谱(XRF)元素分析结果 表2给出的是反应前后催化剂的X射线荧光光谱元素分析结果. 测试结果(表3)表明, 催化剂的组分主要为载体Al2O3和活性组分Fe2O3, 反应前后催化剂的活性组分Fe2O3的含量无明显变化, 说明催化剂在使用过程中具有良好的稳定性.

表2 反应前后催化剂主要元素的结合能和表面含量Table 2 The binding energy and surface content of main elements of the catalysts before reaction and after reaction
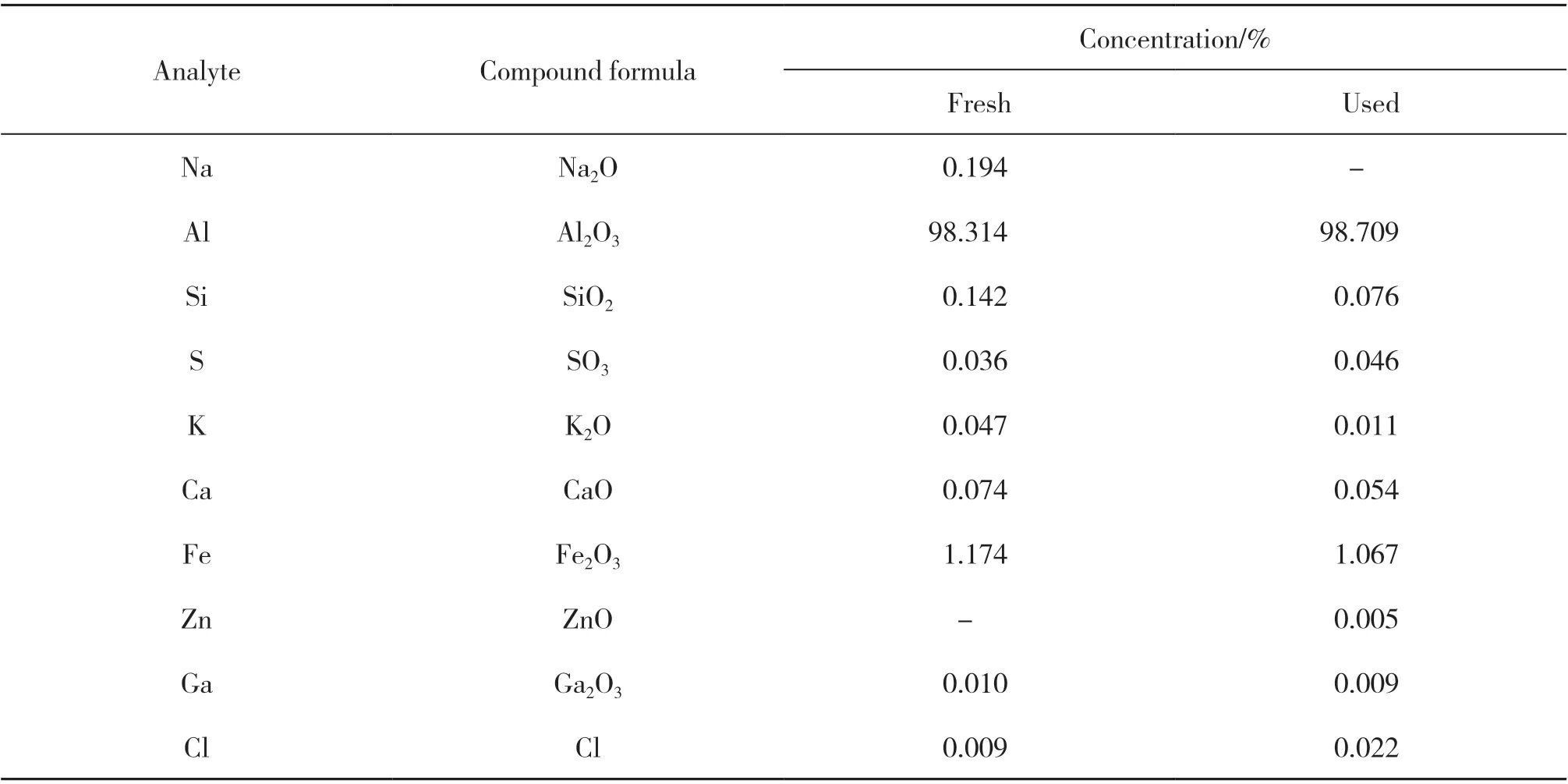
表3 反应前后催化剂的XRF元素分析结果Table 3 XRF results of the catalysts before reaction and after reaction
3 结论
通过对比有无催化剂的条件下O3/UV 体系氧化处理UDMH 废水的效果, 发现在Fe2O3/Al2O3的催化作用下, UDMH 在O3/UV 体系中的降解反应被有效提高, 不仅UDMH 本身的分解反应被加速,其中间产物的分解效率也大大提升, 剧毒中间产物NDMA 的生成被有效抑制.
对O3/UV 多相催化氧化体系氧化UDMH 废水的反应参数进行了优化, 在最佳反应条件下对比了UDMH 及其降解中间产物NDMA 在O3/UV 体系和O3/UV 多相催化剂体系中的反应动力学, 结果表明,Fe2O3/Al2O3催化剂对NDMA 与O3/UV 反应的催化作用优于对UDMH 与O3/UV 的反应的作用, 这使得UDMH 降解过程中的产生的NDMA 得以及时降解.
催化剂的循环实验结果显示, Fe2O3/Al2O3催化剂在经过8 次循环使用后, UDMH 废水中的TOC去除率还可以高达98%, 催化剂表现出优良的可重复使用性. 使用前后催化剂的XRD、 XPS 和XRF表征结果表明Fe2O3/Al2O3催化剂在使用中具有良好的稳定性.
