HLA高分辨等位基因多态性及单倍体与广西汉族终末期肾病易感性的相关性分析*
2022-08-12李海滨孙煦勇裴永峰黄程新覃音红董建辉王洪良吴基华廖吉祥李美思
李海滨,孙煦勇,裴永峰**,黄程新,覃音红,董建辉,杨 锦,王洪良,文 宁,吴基华,廖吉祥,李美思
(1.广西医科大学第二附属医院移植医学中心,广西器官捐献与移植研究重点实验室,广西移植医学工程技术研究中心,广西南宁 530007;2.中国人民解放军联勤保障部队第九二三医院器官移植科,广西移植医学工程技术研究中心,广西移植医学重点实验室,广西南宁 530021)
人类白细胞抗原(Human Leukocyte Antigen,HLA),又称移植抗原,是目前所知人体最复杂的多态系统,在机体免疫系统与疾病的应答时起关键作用,也是影响机体免疫耐受和排斥时非常重要的一个抗原[1]。截至2021年11月,被世界卫生组织HLA系统因子命名委员会命名的等位基因数分别为7 114个(HLA-A)、8 464个(HLA-B)和3 045个(HLA-DRB1),HLA等位基因共有31 675个[2]。不同地域、民族和疾病人群HLA的等位基因和单倍型频率等具有各自的特点[3,4]。
研究发现,中国人群慢性肾病的患病率约为10.8%,部分患者最终发展成终末期肾病(End Stage Renal Disease,ESRD),且ESRD的患者在逐年增加[5]。目前,肾移植被认为是ESRD患者最好的治疗方法,可明显提高患者的生活质量和生存率[6,7]。研究发现肾移植时供体和受体的HLA分型结果越吻合,受体肾的移植效果越好[8],尤其是可直接激活受体的HLA-Ⅱ类分子,是诱导移植排斥的重要靶抗原[9]。HLA与肾疾病相关性的研究始于20世纪,发现许多HLA等位基因与ESRD的发生具有关联性,且在不同地域和人种中,其易感或保护基因具有差异[10-12]。
广西总人口约5 000万,其中,汉族人口约3 100万(数据来源于广西第七次全国人口普查主要数据),远远大于壮族人口。本研究采用聚合酶链反应-序列特异性寡核苷酸(Polymerase Chain Reaction-Sequence Specific Oligonucleotides,PCR-SSO)技术,对本移植医学中心和中国人民解放军联勤保障部队第九二三医院器官移植科的578例汉族ESRD患者进行HLA基因中、高分辨分型,并与中国造血干细胞捐献者资料库广西管理中心的汉族捐献者相应的基因频率及单倍型频率等进行比较,为深入了解HLA和ESRD患者的发病机理及相关性研究奠定基础,同时为器官移植配型筛选等提供数据支持和依据。
1 材料与方法
1.1 一般资料
ESRD组:从本移植医学中心实验室和中国人民解放军第九二三医院器官移植科实验室做HLA分型检测的等待移植患者5 160例(2014年-2021年9月)中,随机选取广西本地汉族终末期肾病患者578例,彼此间无血缘关系。其中男性325例,年龄13-77岁,中位年龄41岁;女性253例,年龄12-68岁,中位年龄39岁。对照组:从中国造血干细胞捐献者资料库广西管理中心约5 000例的捐献者(2011-2015年)中,随机选取广西本地汉族1 644例,其中男性858名,女性786名,年龄18-50岁[13]。HLA分型检测都获得了实验组研究者的知情同意书。
1.2 主要仪器及试剂
DNA提取试剂盒(QIAamp DNA blood mini kit,荷兰QIAGEN,批号:51104和51106);HLA-A、B、DRB1、SSO基因分型检测试剂盒(LIFECODES HLA-SSO TYPING KITS,美国Gen-Probe Transplant Diagnostics,批号LOT-A:628410,LOT-Ae:628459,LOT-B:628510,LOT-Be:628559,LOT-DRB1:628751,LOT-DRB1 e:628759);9600型PCR扩增仪(美国Proflex);核酸蛋白测定仪(Multiskan sky,美国Thermo);多功能流式点阵仪(Luminex-200,美国Luminex),干式恒温器(H1型,珠海黑马医学仪器有限公司)。
1.3 方法
ESRD组采集2 mL或5 mL乙二胺四乙酸(EDTA)抗凝静脉血,严格按试剂盒说明书提取DNA,DNA浓度调整为30-100 ng/μL,A260/A280为1.65-1.90。采用LIFECODES HLA-SSO TYPING KITS对ESRD的静脉血标本进行HLA-A、B、DRB1共3个位点的基因分型,所有的ESRD患者和相应的供体在移植前,都进行微量淋巴细胞毒性实验。如果对ESRD患者的分型结果有疑问,则再次用其静脉血提取DNA,然后用LIFECODES HLA-SSO试剂复核。
1.4 统计分析
ESRD组HLA等位基因的频率采用直接计算法,应用Arlequin 3.5.2.2软件对ESRD组的3个位点作Ewens-Watterson检验和Hardy-Weinberg(HWE)检验,ESRD组的单倍体频率利用该软件的最大期望(EM)算法[14]获得。ESRD组与对照组等位基因及单倍型频率的比较,采用SPSS 19.0软件的χ2检验,P<0.05表示差异有统计学意义,并计算优势比(Odds Ratio,OR)和95%可信区间(Confidence Interval,CI)。
2 结果与分析
2.1 Ewens-Watterson检验
ESRD组和对照组人群Ewens-Watterson检验的结果表明,两组人群的3个位点都符合中性选择(P>0.05)。
2.2 HWE检验
HWE检验结果表明,ESRD组中3个位点都符合HWE遗传平衡(P>0.05),而对照组中的3个位点偏离了HWE遗传平衡(P<0.05)。
2.3 HLA-A等位基因频率比较
ESRD组检出29个HLA-A等位基因,频率在前5位的基因分别是A*11:01(34.86%)、A*24:02(14.45%)、A*02:03(10.73%)、A*02:07(9.95%)和A*33:03(9.17%)。对照组基因频率最高的也是这5个基因,只是频率与ESRD组不同。与对照组相比,ESRD组A*11:01基因和A*02:01基因频率高于对照组(P<0.001),A*11:02基因、A*30:01基因和A*32:01基因频率低于对照组(P<0.05),具体见表1。
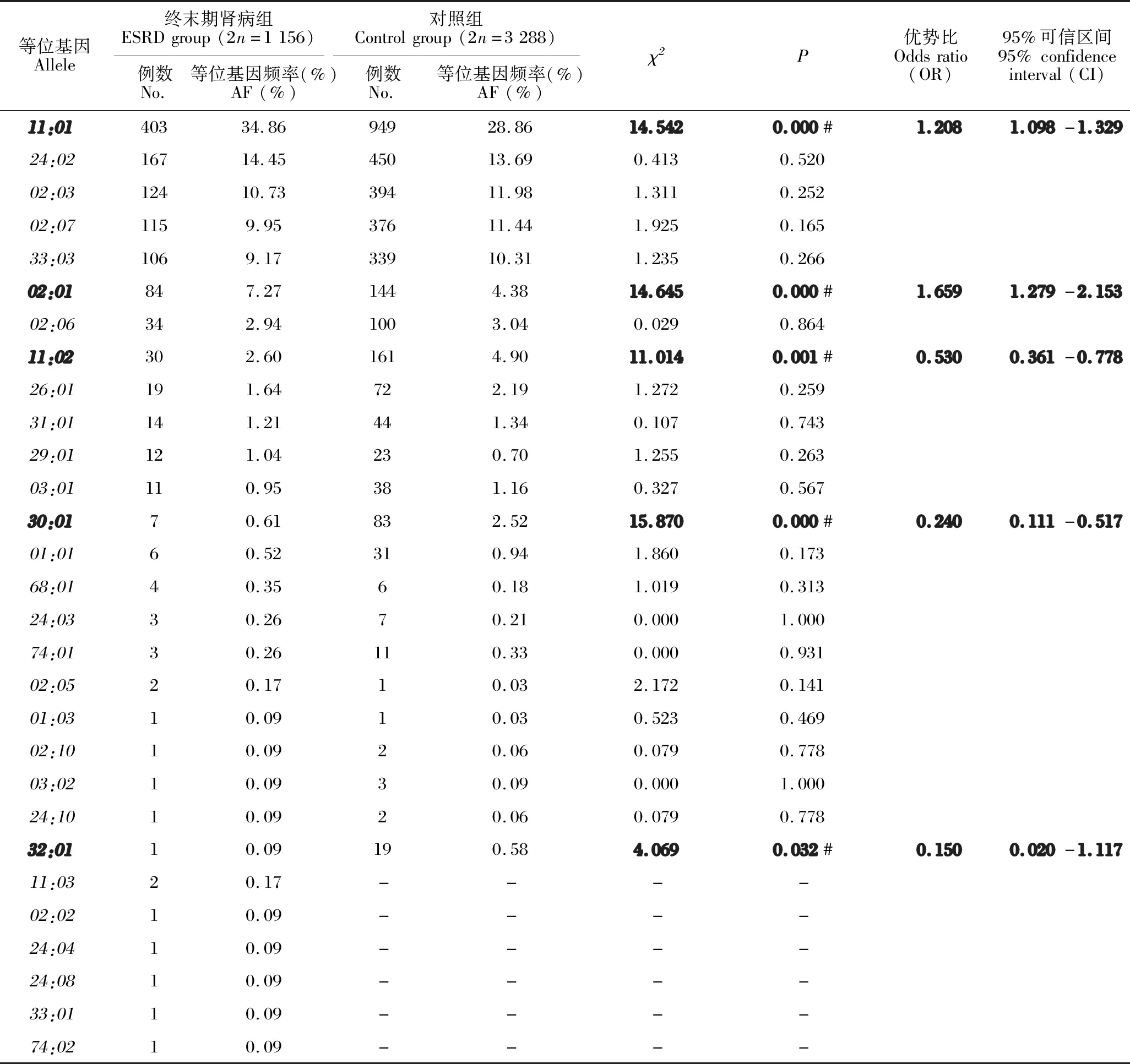
表1 ESRD组和对照组HLA-A等位基因频率的比较Table 1 Comparison of HLA-A allele frequency between ESRD group and control group
2.4 HLA-B等位基因频率比较
ESRD组检出57个HLA-B等位基因,频率在前5位的基因分别是B*46:01(13.32%)、B*40:01(12.80%)、B*15:02(11.42%)、B*13:01(10.64%)和B*58:01(8.65%)。对照组基因频率最高的也是这5个基因,但频率不同。与对照组相比,ESRD组B*13:01基因频率高于对照组(P<0.05),B*13:02基因和B*07:02基因频率低于对照组(P<0.05),具体见表2。

表2 ESRD组和对照组HLA-B等位基因频率的比较Table 2 Comparison of HLA-B allele frequency between ESRD group and control group

续表Continued table
2.5 HLA-DRB1等位基因频率比较
ESRD组检出34个HLA-DRB1等位基因,频率在前5位的基因分别是DRB1*15:01(12.02%)、DRB1*12:02(11.25%)、DRB1*16:02(9.52%)、DRB1*09:01(8.82%)和DRB1*04:05(8.39%)。对照组基因频率最高的5个基因有3个与ESRD组相同。与对照组相比,ESRD组DRB1*12:02、DRB1*04:05、DRB1*14:54和DRB1*11:01基因频率高于对照组(P<0.05),DRB1*07:01和DRB1*13:02基因频率低于对照组(P<0.05),具体见表3。
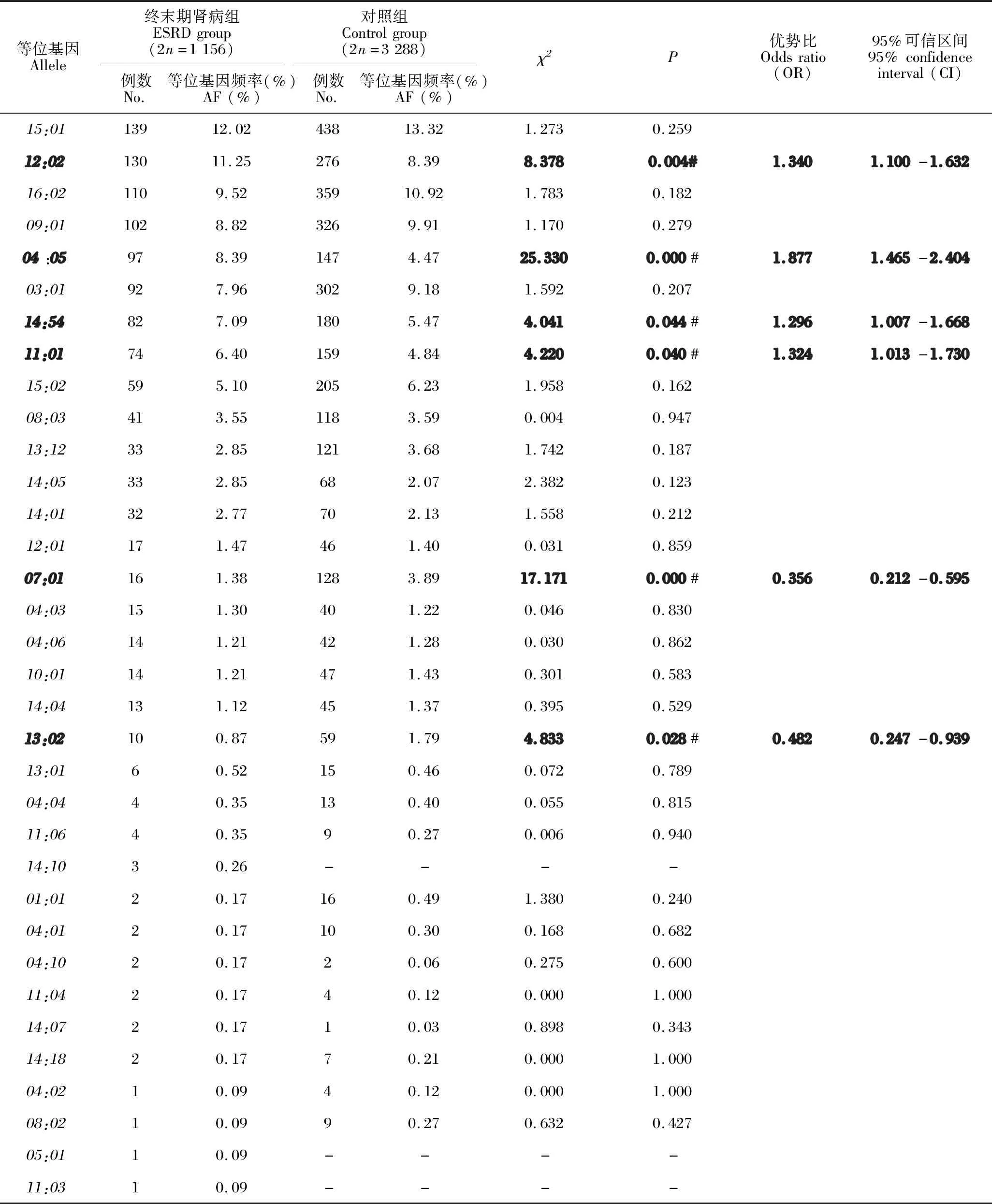
表3 ESRD组和对照组HLA-DRB1等位基因频率的比较Table 3 Comparison of HLA-DRB1 allele frequency between ESRD group and control group
2.6 三位点单倍型频率的比较
Arlequin软件分析显示,ESRD组总共有489个三位点单倍型,只有23.45%的单倍型频率大于1%,最常见的单倍型是A*33:03-B*58:01-DRB1*03:01,这也是对照组最常见的单倍型。两组频率前20位的三位点单倍型频率相比,A*11:01-B*15:02-DRB1*12:02、A*11:01-B*15:02-DRB1*15:01和A*11:01-B*40:01-DRB1*04:05有统计学意义(P<0.05),具体见表4。
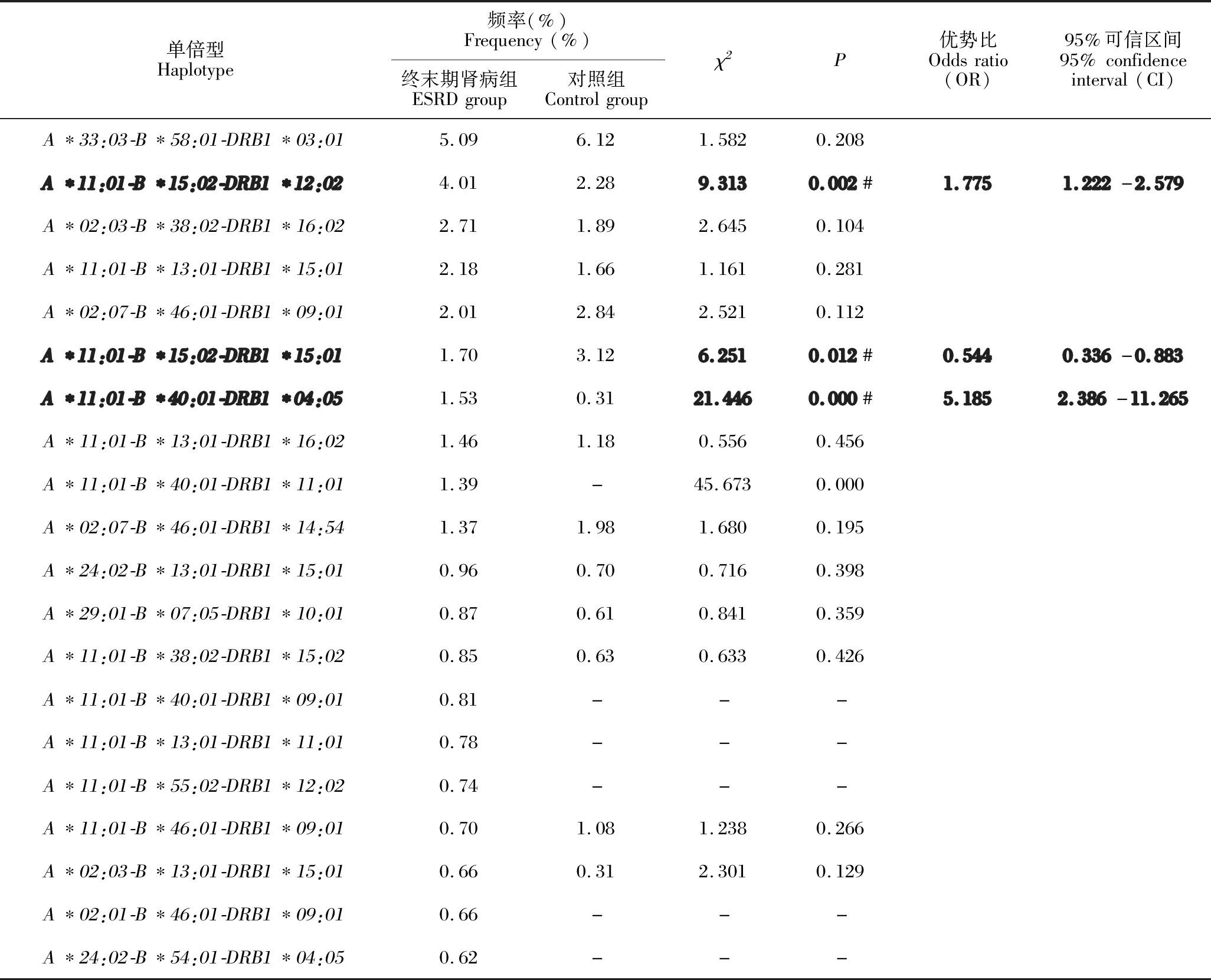
表4 ESRD组前20位的三位点单倍型频率与对照组的比较Table 4 Comparison of three-locus haplotype frequencies at the top 20 sites in the ESRD group with those in the control group
2.7 两位点单倍型频率的比较
Arlequin软件分析显示,ESRD组分别得到了216,274和188个两位点单倍型,其频率低于1%的分别占总频率的40.42%、52.81%和39.59%。各频率前20位的两位点单倍型见表5,频率最高的分别是A*11:01-B*15:02(7.72%)、B*58:01-DRB1*03:01(6.39%)和A*11:01-DRB1*12:02(5.46%)。ESRD组和对照组的两位点单倍型频率比较,A*11:01-B*55:02、B*15:02-DRB1*12:02、B*40:01-DRB1*11:01、B*46:01-DRB1*14:01、A*11:01-DRB1*04:05和A*11:01-DRB1*11:01有统计学意义(P<0.05)。

表5 ESRD组前20位的两位点单倍型频率与对照组的比较Table 5 Comparison of two-locus haplotype frequencies at the top 20 sites in the ESRD group with those in the control group
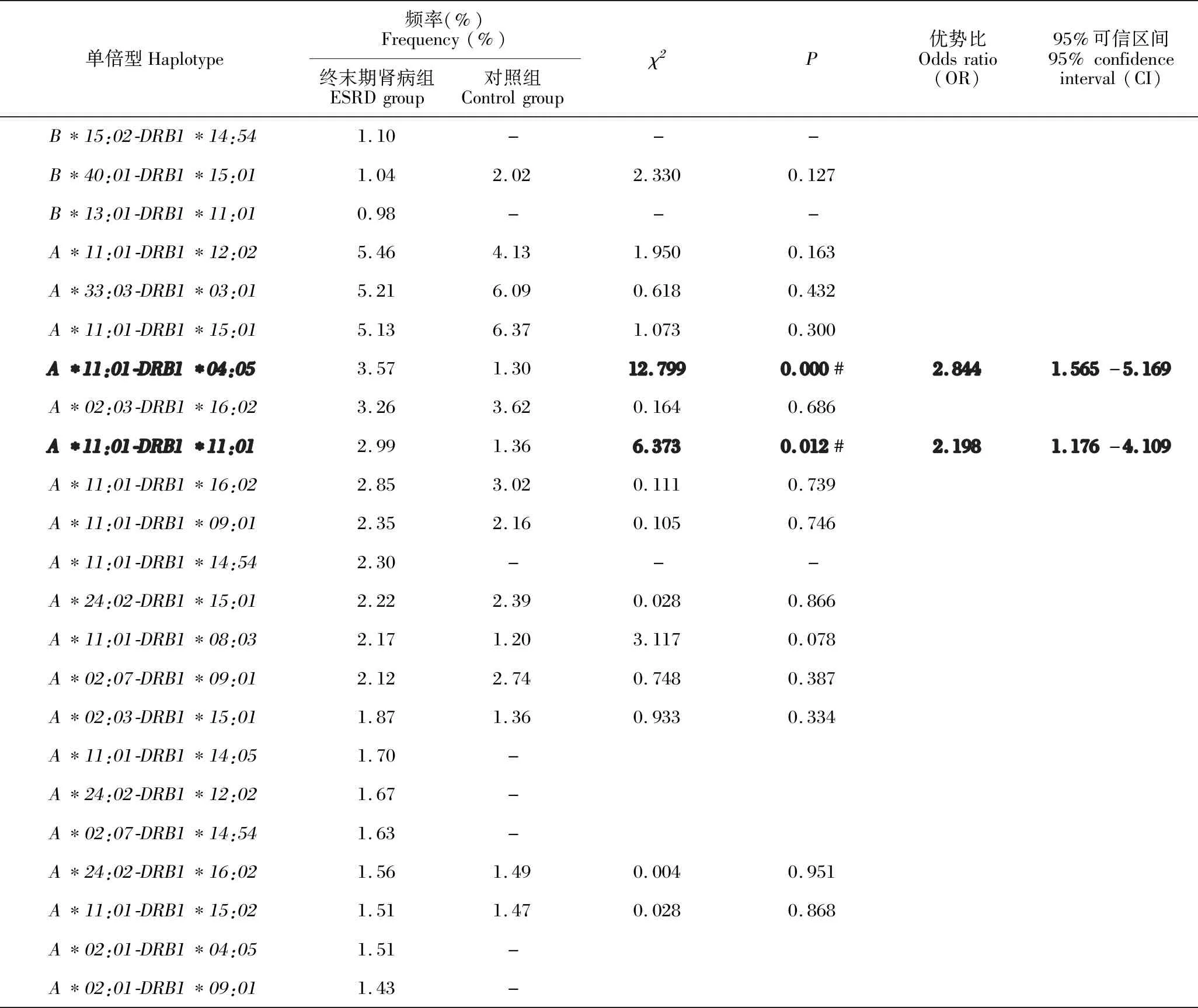
续表Continued table
3 讨论
HLA等位基因的多态性可以体现在地区和人种的差异上[3,4],而且HLA部分等位基因和疾病具有遗传相关性[1,6]。目前疾病与HLA相关性的研究,是通过对比某种疾病的患者和健康人群一些HLA特定等位基因及单倍型等的频率,经过统计分析,判别该基因与疾病的易感性或保护性。前期研究发现,影响ESRD患者的重要分子之一可能是HLA,因为HLA部分等位基因与肾脏疾病的移植免疫密切相关[8,9]。广西汉族的人口目前仍然位居广西首位,因此,探究广西汉族ESRD患者HLA等位基因的分布频率和特点,并和广西健康汉族人群作对比分析,对ESRD患者的诊断、预后及治疗可能会有较深的基础研究和临床应用价值。
本研究首先对广西汉族ESRD患者进行了HLA-A、B和DRB1位点的Ewens-Watterson检验和HWE检验。Ewens-Watterson检验发现,广西汉族ESRD患者HLA-A、B和DRB1位点的数据均符合中性选择,反映出ESRD患者HLA的多态性主要是由基因突变和漂移造成的;HWE检验发现,广西汉族ESRD患者的3个位点都符合HWE遗传平衡,反映出ESRD患者在自然选择、自由婚配和没有新的突变时,HLA等位基因的频率基本没有变化[15],符合遗传学的基本规律。
HLA等位基因和ESRD患者的关联性研究很多,但目前大部分研究是以HLA低分辨方法进行。南京医科大第一附属医院研究发现,HLA-A*11:01、A*31:01、B*15:01、B*55:02、B*39:05、DRB1*03:01、DRB1*04:03、DRB1*04:04、DRB1*04:05、DRB1*11:01和DRB1*12:02是江苏汉族ESRD患者的易感基因,而DRB1*15:01可能是该类患者的保护基因[10];HLA-A*24和B*35是印度尼西亚人ESRD患者的保护基因[16];B*50是巴基斯坦人ESRD患者的易感基因,HLA-B*40、DRB1*13和DRB1*12是该类患者的保护基因[17];HLA-DRB1*15是重庆地区慢性肾功能衰竭患者的易感基因[18];HLA-DRB1*04、DRB1*12和DRB1*14是河北汉族ESRD患者的易感基因,而DRB1*09是该类患者的保护基因[19];HLA-B*56和DRB1*4可能是广西壮族慢性肾衰竭患者的易感基因,HLA-A*26、B*62和DRB1*08可能是该类患者的保护基因[20];广州南方医院移植中心发现,HLA-A*24、B*54、B*55、B*60和DRB1*04是广东地区ESRD患者的易感基因[21];HLA-B*15和B*18是沙特阿拉伯ESRD患者的易感基因,HLA-A*26、B*39和B*50是该类患者的保护基因[22]。上述结果并不完全一致,是否与人群及样本量大小相关,需要进一步验证。
广西汉族ESRD患者共发现HLA-A等位基因29个,B等位基因57个和DRB1等位基因34个。其中A*11:01(34.86%)、A*24:02(14.45%)、A*02:03(10.73%)、B*46:01(13.32%)、B*40:01(12.80%)、B*15:02(11.42%)、B*13:01(10.64%)、DRB1*15:01(12.02%)和DRB1*12:02(11.25%)等9个基因的频率都大于10%,且这些高频率的等位基因对于广西汉族正常人也都属于高频率,因此具有这些等位基因的患者更容易找到合适的移植供体。但也发现,HLA-A*11:01、DRB1*04:05和DRB1*11:01是广西汉族ESRD患者的3个易感基因,这与江苏汉族ESRD患者的易感基因相同[10],同时,DRB1*04也是广东人ESRD患者的易感基因[21],DRB1*11也是台湾ESRD患者的易感基因[23];DRB1*12:02是广西汉族ESRD患者的易感基因之一,而DRB1*12也是大连汉族ESRD患者的易感基因[11]。文献报道,HLA-A和HLA-C位点与移植后受者存活率,以及急慢性排斥反应的发生具有相关性[24],在广西汉族ESRD患者中检出了2个HLA-A易感基因(A*11:01和A*02:01)和3个保护基因(A*11:02、A*30:01和A*32:01),这5个基因是否与受者存活率及排斥反应相关,需要更多临床移植后的数据进行验证。
许多疾病与HLA的连锁不平衡也有相关性[10,25],目前常用单倍型来反映HLA的连锁不平衡。本研究发现,广西汉族ESRD患者频率最高的三位点单倍型是A*33:03-B*58:01-DRB1*03:01(5.09%),这也是广西汉族健康人群及广西壮族健康人群频率最高的单倍型[4,13],因此具有该单倍型的患者,在广西相对比较容易找到合适的移植供体。与对照组相比,广西汉族ESRD患者人群有3条三位点单倍型(A*11:01-B*15:02-DRB1*12:02、A*11:01-B*15:02-DRB1*15:01和A*11:01-B*40:01-DRB1*04:05)和6条两位点单倍型(A*11:01-B*55:02、B*15:02-DRB1*12:02、B*40:01-DRB1*11:01、B*46:01-DRB1*14:01、A*11:01-DRB1*04:05和A*11:01-DRB1*11:01)有统计学意义,这些单倍型可以认为是广西汉族ESRD患者的易感单倍型,但也就意味着带有该单倍型的ESRD患者在广西相对比较难找到匹配的供体。相对于HLA位点的错配,受者的长期存活率受单倍型的错配影响更大,说明HLA等位基因也许不是单独发挥作用,推测是等位基因在单倍型里相互作用后才整体发挥作用[26,27],需要后续进一步研究。
本研究的广西汉族ESRD患者只有部分易感基因与文献报道一致,其他易感或保护基因则与文献报道差别较大。分析原因在于,首先,HLA系统的遗传多态性及连锁不平衡,导致其等位基因在地域和民族上区别较大[3,4];其次,不同研究标本的抽样误差和统计方法对结果也有影响[11,28];再次,目前进行的ESRD与HLA相关性的研究,绝大部分采用HLA低分辨方法,这容易导致HLA抗原和等位基因的漏检;或者是不同ESRD患者的原发基础疾病不同或环境的诱发因素导致[11]。HLA与ESRD患者的相关性机理,用以前常见的连锁不平衡学说、受体学说或免疫逃逸等学说[29]来解释,都只能从不同的侧面说明两者部分的关系,并未完全阐明其相关机制。目前有学者认为,肾脏疾病可能由淋巴器官或肾脏中HLA的作用引起,肾细胞或肾单核吞噬细胞表达的不同HLA同种异体,可能在机制上与肾脏疾病有关[30],需要后续进一步研究。
本移植中心的HLA实验室从2019年4月至2021年12月已经完成HLA分型检测的标本约2 000份,其中90%以上是ESRD患者标本。在有大量的临床标本来源的前提下,需要对ESRD患者的病因进行详细分类,并进行下一步研究。随着HLA二代测序方法在各个移植实验室的应用逐渐开展[31],以及全基因组关联分析(Genome-wide Association Study,GWAS)方法在疾病易感相关性研究方面的应用[32,33],是否可以将这2种方法应用于广西汉族ESRD患者与HLA多态性的关联性分析,需要更多大样本数据的收集、病因分类等进一步综合研究。
4 结论
本研究首次对HLA高分辨等位基因多态性及单倍体与广西汉族终末期肾病易感性的相关性进行了探讨,发现广西汉族ESRD患者HLA-A、B和DRB1高频率的等位基因和单倍型与广西汉族健康人基本相同,其中HLA-A*11:01、A*02:01、B*13:01、DRB1*12:02、DRB1*04:05、DRB1*14:54和DRB1*11:01可能与广西汉族ESRD高发病风险相关;HLA-A*11:02、A*30:01、A*32:01、B*13:02、B*07:02、DRB1*07:01和DRB1*13:02可能与广西汉族ESRD低发病风险相关。研究结果为广西汉族ESRD患者寻找临床移植供体时提供了HLA等位基因的数据参考,同时为后续HLA与ESRD患者发病的机理研究提供了参考,也为临床ESRD患者的早期基因诊断和防治研究提供了有益的探索。
