肿瘤患儿化疗辅助用药超说明书及循证医学分析
2022-08-12徐姗姗宋智慧张弨
徐姗姗,宋智慧,张弨
(首都医科大学附属北京同仁医院药学部,北京 100730)
超说明书用药是指药物应用超出国家药品监督管理部门认可的生产厂家提供的药品说明书界定范围,包括超出了适用年龄、剂量、剂型、给药途径或适应证等[1]。在我国,药品说明书作为具有法律效力的文书,是衡量临床医师用药行为是否正确的标准,因此超说明书用药为医务人员带来了潜在职业风险。因临床研究的缺乏,药品说明书中常缺少儿童用药信息,因此儿童超说明书用药十分普遍,加之住院患儿罹患疾病和用药较门诊更加复杂,超说明书用药现象更为突出。有研究发现,儿科住院患者超说明书用药率达50%~90%[2]。化学治疗(化疗)辅助药物可以提高化疗疗效,减少化疗药物不良反应,在肿瘤患者中应用十分广泛。目前国内有一些关于儿童肿瘤科患者超说明书用药情况的文献报道[3],笔者尚未见关于儿童化疗辅助用药超说明书用药情况的研究。本研究对首都医科大学附属北京同仁医院实体肿瘤患儿化疗辅助用药的超说明书用药情况进行调查,并进行循证医学分析,以期为临床合理用药提供参考。
1 资料与方法
1.1研究资料 研究对象选自2019年10月1日—12月31日在我院儿科病区出院的所有实体肿瘤化疗患儿。排除标准:①住院期间未进行化疗;②病历资料不完整,特别是用药信息缺失。
1.2研究方法
1.2.1数据采集 通过医院信息管理系统(嘉和电子病历系统和东华数字化医院信息管理系统),调取患儿病历资料,并应用自制Excel表格记录患儿住院号、姓名、性别、年龄、体质量、体表面积、入院诊断、化疗方案、医嘱数量以及化疗辅助用药(包括保肝药、止吐药、抑酸药、扶正祛邪中成药、升白细胞药、保护心肌药物等)的相关数据,包括药品通用名、用法用量、给药途径、溶媒等,并查阅记录相关住院病历及病程记录,对符合标准的患儿进行数据采集。
1.2.2超说明书用药判断标准 以国家食品药品监督管理总局批准的最新药品说明书为标准进行判断,将超说明书用药类型按优先顺序分为超禁忌证用药、超适应证用药、超适用人群用药、超给药途径用药、超剂量用药和超给药频次用药。所有医嘱按以上优先顺序进行判定,1条医嘱只能被判定为 1 种超说明书用药类型。如果药品说明书中未提及儿童用药情况、儿童用药情况尚不明确或无可靠参考文献的均被判定为超适用人群用药,提及儿童用药或者具体年龄范围的,按具体情况判定是否超适宜人群。根据体质量或体表面积计算的给药剂量在说明书推荐剂量的±10%范围内为合理,否则为超剂量用药。
1.2.3超说明书用药循证医学证据的调查 首先检索美国Micromedex数据库,对我院超说明书用药进行Thomson 分级评价。这个系统是评价药物用法循证医学证据的常用工具,也是美国医疗保险公司决定超说明书用药能否给予报销的重要参考[4]。Micromedex 的Thomson循证医学证据评价从有效性等级、推荐等级和证据等级 3个方面进行详细描述,具体评价标准见表1[5]。Micromedex数据库中检索不到的由临床药师通过检索 PubMed、中国知网、万方医学等数据库,查阅国内外相关诊疗指南、专家共识、文献等相关证据后,参照Micromedex的Thomson分级系统进行循证医学等级评价。
有效性等级:Ⅰ.治疗有效;Ⅱa .证据支持有效;Ⅱb.有效性具有争议;Ⅲ.治疗无效。推荐等级:Ⅰ.推荐;Ⅱa.大多数情况下推荐;Ⅱb.在某些情况下推荐使用;Ⅲ.不推荐使用;Indeterminate.不明确。证据等级:A.随机对照试验的荟萃分析;多个、设计良好、大规模的随机临床试验。B.结论冲突的随机对照试验的荟萃分析;小规模或研究方法有显著缺陷的随机对照试验;非随机研究。C.专家意见或共识;个案报道或系列案例没有证据。
2 结果
2.1基本情况 共收集恶性实体肿瘤患儿564例,其中男372例(65.96%),女192例(34.04%),年龄2~14岁,平均(6.20±3.28)岁。其中视网膜母细胞瘤患者228例,肝母细胞瘤207例,腹膜后神经母细胞瘤55例,肾母细胞瘤39例,胰母细胞瘤23例,其他12例。
2.2辅助用药超说明书用药情况 564例患儿共涉及医嘱9978条,其中辅助用药医嘱4821条,占全部医嘱的48.32%,平均每人辅助用药医嘱(8.55±1.33)条。涉及辅助用药23种,其中存在超说明书用药的辅助用药18种,涉及医嘱4032条,占全部医嘱40.41%,占全部辅助用药医嘱83.63%,包括超适应证用药医嘱1863条(占46.21%),超适用人群用药医嘱1209条(占29.99%),超剂量用药798条(占19.79%),超给药频次用药162条(占4.02%)。未发现超禁忌证用药和超给药途径给药(表2)。
2.3循证医学证据检索结果 依据Micromedex循证医学数据库进行审查,18种存在超说明书用药的辅助药物均未被收录在数据库,因此所有药物均由临床药师按照Thomson分级系统进行循证医学证据分级。18种药物共涉及19项超说明书用药情况,其中1项(5.26%)用药符合国家食品药品管理局批准的说明书用法,2项(10.53%)用药符合国际指南用法,1项用药(5.26%)符合国内指南用法,5项(26.32%)用药符合专家共识、诊疗常规或专著用法,7项(36.84%)用药符合其他依据(文献报道),4项(21.05%)无任何循证医学证据。上述3种等级类型占总数的70.3%(表1)。具体循证医学证据分级见表1。
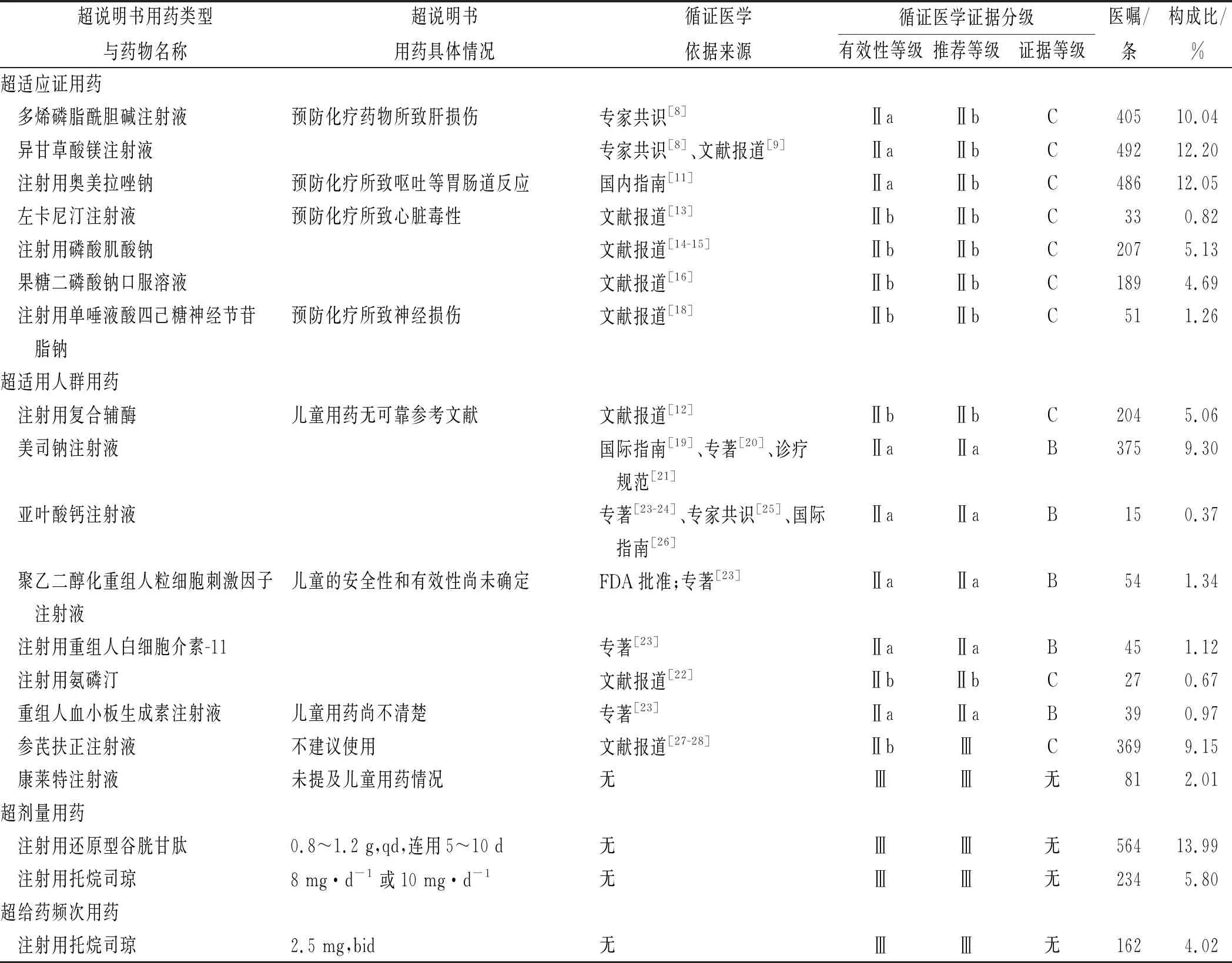
表1 化疗辅助用药超说明书用药情况
3 讨论
近年来,随着肿瘤发病率升高,抗肿瘤药物和抗肿瘤辅助用药使用大量增加,超说明书用药现象也越来越显著,某大型医院调查结果显示,约28%抗肿瘤用药为美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南未推荐用药[6]。刘铎等[7]对全球肿瘤患者超说明书用药现状进行系统评价,发现不同地区超说明书用药医嘱占比相似(约22%),其中瑞士和意大利患者人均接受超说明书用药医嘱分别为 0.44 条和 0.31 条,少于中国(0.98条)和澳大利亚(2.25 条)。超剂量、超适应证、超溶媒品种及剂量占比合计大于超说明书用药医嘱数的80%。本研究发现,儿童肿瘤辅助用药的住院医嘱超说明书用药发生率为40.41%,辅助用药医嘱中超说明书用药的发生率高达83.63%,以超适应证用药和超适宜人群用药为主,其次是超剂量用药和超给药频次用药,与之前研究结果类似。
3.1超适应证用药 超说明书用药中占比最高的为超适应证用药,占46.21%,均为预防化疗引起的不良反应用药,包括四大类:预防胃肠道不良反应、预防肝损伤、预防心脏毒性和预防神经损伤的药物。
注射用还原型谷胱甘肽、异甘草酸镁注射液和多烯磷脂酰胆碱注射液是目前广泛应用的预防化疗药物致肝损伤的药物。本研究中保肝药物的使用率达到100%。除了还原型谷胱甘肽,其他2种药物说明书中均未提及可预防抗肿瘤药物引起的药物性肝损伤。《肿瘤药物相关性肝损伤防治专家共识(2014年)》[8]中建议对于合并基础肝病、既往抗肿瘤治疗曾出现肝损伤、使用抗肿瘤药肝毒性明显或用药剂量过大的患者,可酌情使用保肝类药物。但是选择何种药物尚无定论。秦叔逵等[9]进行的随机对照试验表明,预防性应用异甘草酸镁可以降低化疗相关的急性药物肝损伤,但总体来说,合用保肝类药物是否可以预防抗肿瘤药物引起的肝损伤仍需进一步研究。因此异甘草酸镁注射液和多烯磷脂酰胆碱注射液用于预防化疗引起的肝损伤的有效性等级Ⅱa,推荐等级Ⅱb,证据强度 C,即超说明书用药较合理,仍缺乏循证医学证据等级较高的研究,尤其是几种保肝药物的联用。
奥美拉唑说明书中的适应证包括十二指肠溃疡、胃溃疡、反流性食管炎及卓-艾综合征,没有化疗止吐适应证。奥美拉唑用于化疗止吐的用法未被 Micromedex 数据库收录。2020年NCCN止吐指南[10]也未建议使用奥美拉唑预防有催吐风险的化疗药物引起的呕吐。《肿瘤治疗相关呕吐防治指南(2014版)》[11]中提到在予以神经激肽-1受体拮抗剂、地塞米松、5-HT3受体拮抗剂等联合止吐的基础上,根据患者实际情况可使用质子泵抑制药(PPI)或H2受体拮抗剂。因此奥美拉唑用于化疗止吐的有效等级Ⅱa,推荐等级Ⅱb,证据强度 C。对于化疗止吐药物有许多其他循证医学证据等级更高的药物选择,不建议奥美拉唑用于化疗止吐。
对于儿科常用的抗肿瘤药物中蒽环类可能导致的心脏毒性,右丙亚胺是唯一被FDA批准的心脏保护剂,Micromedex收录 B 级证据,推荐用于预防非乳腺癌儿童患者使用蒽环类药物引起的心脏毒性。我国2013年制订的《蒽环类药物心脏毒性防治指南(2013年版)》中[12]也指出,为有效预防心脏毒性,应在第1次使用前就联合应用右丙亚胺。左卡尼汀说明书中适应证仅针对慢性肾衰竭长期血透患者的心肌病或心律失常等症状,果糖二磷酸钠说明书中适应证为改善冠心病的心绞痛、心肌梗死、心律失常和心力衰竭的心肌缺血以及病毒性心肌炎的辅助治疗,磷酸肌酸钠说明书中的适应证仅为心脏手术时保护心肌以及缺血状态下的肌代谢异常。虽然目前有些研究显示左卡尼汀、果糖二磷酸钠和磷酸肌酸钠或许有一定的心脏保护作用[13-16],但是用于防治蒽环类药物所致的心脏毒性缺乏较高等级的循证医学证据。因此3种药物的有效性等级Ⅱb,推荐等级Ⅱb,证据强度C。
抗肿瘤药物导致的神经毒性是部分抗肿瘤药物的主要剂量限制性毒性,其在化疗患者中的发生率30%~40%,以外周神经毒性为主,且大多不可预测。单唾液酸四己糖神经节苷脂钠可有效预防或抑制苯并芘、戊四氮及戊二酸所致氧化反应和脂质过氧化反应,利于清除自由基,进而保护酶及受体免于氧化损伤,同时可经多种途径阻断铂类药物诱发周围神经病变[17],说明书中适应证包括血管性或外伤性中枢神经系统损伤及帕金森病,没有药物引起的神经毒性适应证。现有小样本临床试验表明单唾液酸四己糖神经节苷脂钠能有效预防和减少铂类药物所致外周神经毒性[18],但循证医学研究现有的数据不足以支持其用于铂类等抗肿瘤药物神经毒性的预防。因此单唾液酸四己糖神经节苷脂钠的有效性等级Ⅱb,推荐等级Ⅱb,证据强度C。
3.2超适宜人群用药 23种药物中仅有5种药物在“用法用量”或“儿童用药”项下标有明确的儿童用法;16种药物在“儿童用药”或“注意事项”项下有相关描述,其中2种药物的描述为不建议儿童使用,2种药物描述为儿童谨慎使用或使用时需注意,9种药物的描述为无可靠参考文献或尚不明确,2种药物的描述为经验有限,1种药物的描述为儿童用量遵医嘱;还有2种药物中未提及任何儿童应用的相关信息。16种无儿童用药相关信息的药物中7种药物按照优先顺序已归为超适应证用药,剩余9种药物归为超适宜人群用药,占全部超说明书用药的29.99%。
注射用复合辅酶包括辅酶、三磷腺苷(ATP)及二磷酸果糖等,可为心肌细胞供给能量,稳定心肌细胞代谢。有研究对采用多柔比星进行化疗的恶性肿瘤患儿应用注射用复合辅酶联合磷酸肌酸钠,结果显示可有效防治抗肿瘤抗生素所致的心肌损伤,明显改善肿瘤患儿药物化疗的预后和患儿的生活质量[12]。因此其有效性等级Ⅱb,推荐等级Ⅱb,证据强度 C,用药的合理性仍需较高等级的循证医学证据支持。
美司钠注射液是FDA批准的预防氧氮磷环(oxazaphosphrine)类药物(包括环磷酰胺、异环磷酰胺等)引起的泌尿道毒性的孤儿药,但未批准其用于儿童。文献搜索发现,指南和参考书中有关于儿童用法用量的推荐[19-20]。我国《儿童神经母细胞瘤诊疗规范(2019年版)》[21]中也给出了不同抗肿瘤方案下儿童应用美司钠的用法用量。因此其有效性等级Ⅱa,推荐等级Ⅱa,证据强度B,超说明书用药较合理。
FDA批准氨磷汀作为顺铂的化学保护剂,用于治疗转移性黑色素瘤和其他需要顺铂治疗的情况,但未批准其用于儿童。文献搜索发现,目前有一些小规模研究中有关于儿童使用的推荐[22],因此其有效性等级Ⅱb,推荐等级Ⅱb,证据强度C,用药的合理性仍需较高等级的循证医学证据支持。
亚叶酸钙注射液说明书中也未见儿童应用的可靠推荐,但《中华人民共和国药典·临床用药须知》(2015年版)[23]和《中国国家处方集:儿童版》[24]中均有儿童的用法用量推荐,《大剂量甲氨蝶呤亚叶酸钙解救疗法治疗恶性肿瘤专家共识》[25]中也有关于儿童血液肿瘤的应用,《NCCN 儿童急性淋巴细胞白血病指南》[26]中也推荐唐氏综合征患儿如果出现严重化疗毒性反应,考虑减少剂量和(或)加强亚叶酸钙解救。因此其有效性等级Ⅱa,推荐等级Ⅱa,证据强度B,超说明书用药较合理。
FDA批准聚乙二醇化重组人粒细胞刺激因子注射液可用于儿童,且推荐儿童用法用量如下:体质量<10 kg,0.1 mg·kg-1;10 ~ 20 kg,1.5 mg;>20 ~ 30 kg,2.5 mg;>30~45 kg,4 mg;>45 kg,6 mg。按照 Thomson 分级系统评价标准,结合指南、诊疗规范等,判断其有效性等级Ⅱa,推荐等级Ⅱa,证据强度B。重组人白细胞介素-11是FDA批准用于预防化疗引起的严重血小板减少症的孤儿药,但并未批准其用于儿童。重组人血小板生成素属于我国一类新药,美国Micromedex未收录此药。国内一些诊疗规范或文献中有两种药物儿童用药的推荐及具体用法用量,且在《中华人民共和国药典·临床用药须知》(2015年版)中两种药物也有明确的儿童用法用量,因此二者的有效性等级为Ⅱa,推荐等级Ⅱa,证据强度B,超说明书用药较合理。
两种中药注射剂参芪扶正和康莱特注射液在儿童中的应用研究很少,仅有少数研究显示参芪扶正注射液可以缓解肿瘤患儿化疗期间的骨髓抑制等,缺乏较高等级的循证医学证据,康莱特注射液目前尚无任何循证医学证据[27-28]。近几年国家基于安全考虑,对中药注射剂在儿童中的应用管理更加严格,对于此类药物在儿童中的使用应谨慎。因此参芪扶正注射液和康莱特注射液的有效性等级分别是Ⅱb和Ⅲ,推荐等级均为Ⅲ,参芪扶正注射液的的证据强度是C,康莱特注射液为无证据,即目前循证医学证据不建议儿童应用康莱特注射液,参芪扶正注射液的用药合理性仍需较高等级的循证医学证据支持。
3.3超剂量和超给药频次用药 还原型谷胱甘肽说明书中建议用于化疗的辅助用药时首剂1.5 g·(m2)-1,静脉滴注,2~5 d肌内注射0.6 g·d-1,但实际给药时许多患儿用量为0.8~1.2 g·d-1,化疗期间持续滴注;托烷司琼说明书建议>2岁0.1 mg·kg-1,最高5 mg·d-1,第1天静脉给药,化疗前静脉滴注,第2~6天口服给药,每天1次,但是实际应用中许多以8 或10 mg·d-1超剂量给药,且用法为4 mg,bid和5 mg,bid,给药频次也不合理。文献检索未查到以上相关超说明书用药合理依据,因此其有效性等级为Ⅲ,推荐等级为Ⅲ,证据强度为无证据,不建议儿童按照上述超说明书用法用量使用。
4 结束语
超说明书用药现象在儿童用药中十分普遍,主要与药品上市前临床试验缺乏针对儿童群体的临床研究从而导致药品说明书不完善有关。部分超说明书用药有循证医学证据支持,但各质量等级存在差异,部分超说明书用药无任何循证医学证据。超说明书用药会增加患儿用药不良事件发生风险,虽然很多超说明书用药通常是经过多年或多例临床观察,且有文献和循证医学证据,但由于缺乏法律支持,也会让医师存在执业风险、医疗机构存在法律风险。目前全球7个国家如日本、美国、印度等对药品超说明书使用有相关额法律法规章程,而德国等则允许合理的药品超说明书使用,印度不允许药品超说明书使用[29]。我国目前对超说明书用药尚没有相关立法。因此,一方面随着儿童临床试验越来越多的开展,及时修订药品说明书;另一方面,通过制定超说明书用药的相关政策法规,在保证医师和患者利益的同时,确保药品超说明书使用的合理性,严格限制无依据的超说明书用药行为,确保儿童的用药安全。
