优化替加环素在革兰阴性杆菌血流感染患者中的给药方案:基于全国血流感染耐药监测联盟的蒙特卡洛模拟研究*
2022-08-12徐荣黄晨嵇金如应超群王培培刘志盈肖永红
徐荣,黄晨,嵇金如,应超群,王培培,刘志盈,肖永红
(1.江西省宜春市人民医院检验科,宜春 336000;2.宁波市医疗中心李惠利医院呼吸内科,宁波 315000;3.浙江大学医学院附属第一医院传染病诊治国家重点实验室、国家感染性疾病临床医学研究中心、感染性疾病诊治协同创新中心,杭州 310003)
替加环素是第一个被美国食品药品管理局(FDA)批准的甘氨酰四环素类抗菌药物,结构和药理作用与四环素类药物相似,但抑菌效果不受外排泵和核糖体保护机制的影响,对除铜绿假单胞菌、变形杆菌和普罗维登斯菌之外的临床常见病原菌普遍具有较强的体外抗菌活性[1]。临床上替加环素除了被用于复杂皮肤软组织感染、复杂腹腔感染和社区获得性细菌性肺炎,还被广泛用于医院获得性肺炎、糖尿病足感染、尿路感染和血流感染等疾病的治疗,因为逐渐增多的难治性病原菌,尤其是多重耐药和泛耐药革兰阴性杆菌如碳青霉烯类耐药肠杆菌科细菌和泛耐药鲍曼不动杆菌等经常使临床常规用药治疗失败[2-5]。
血流感染是临床重症感染的主要致死原因,尽早开始恰当的抗菌经验治疗对患者至关重要[6]。由于血浆浓度较低、治疗有效性缺少评估、大剂量使用不良反应明显等原因,替加环素作为危重血流感染患者经验治疗候选药物仍存在争议[7-8]。本研究旨在以全国血流感染细菌耐药监测联盟(blood bacterial resistant investigation collaborative system,BRICS)开展的系统性细菌耐药监测数据为基础,通过对替加环素的药动学/药效学(pharmacokinetic/pharmacodynamic,PK/PD)模型进行蒙特卡洛模拟,评估该药不同给药方案对我国革兰阴性杆菌血流感染的治疗效果。
1 材料与方法
1.1菌株收集 收集2018—2019年度BRICS全国56家成员单位临床微生物室分离的血流感染革兰阴性杆菌,菌株统一寄送至传染病诊治国家重点实验室进行复核鉴定后保存。剔除重复菌株及对替加环素固有耐药的铜绿假单胞菌、变形杆菌和普罗维登斯菌。
1.2最低抑菌浓度(minimum inhibitory concentration,MIC)测定与比较 采用美国临床实验室标准化研究所(Clinical And Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法,检测替加环素对革兰阴性杆菌的MIC[9]。质控菌株大肠埃希菌ATCC 25922为实验室常备菌株。替加环素购自大连美仑生物技术有限公司,批号:M0503AS,效价:99%。
1.3PK/PD模型 替加环素药动学参数来自针对复杂腹腔感染和皮肤软组织感染患者所做的群体药动学研究,主要参数药物总清除率(total body clearance,CLt)算术平均值为15.79 L·h-1,标准差为7.97[10-11]。预测替加环素疗效的最佳PK/PD指数为24 h游离药物浓度-时间曲线下面积(fAUC0-24)与MIC比值(fAUC0-24/MIC),fAUC0-24=(24 h给药剂量×游离分数)/CLt,游离分数0.2[12]。参考以往体内药效学研究,替加环素治疗肠杆菌科细菌和鲍曼不动杆菌的fAUC0-24/MIC靶值分别为1.2和5.9[13-14]。
1.4蒙特卡洛模拟 蒙特卡洛模拟借助甲骨文公司水晶球(Crystal Ball version 11.1)软件,模拟实验次数设为10 000次,替加环素CLt定义为对数正态分布,革兰阴性杆菌MIC定义为离散分布。模拟替加环素静脉注射给药方案有4种,分别为:针对肝功能不全患者的方案一,首剂100 mg,维持剂量25 mg,q12h[15-16];FDA推荐的方案二,首剂100 mg,维持剂量50 mg,q12h;方案三,首剂150 mg,维持剂量75 mg,q12h;方案四,首剂200 mg,维持剂量100 mg,q12 h。依据给药方案设定替加环素24 h给药剂量后,体外模拟并统计fAUC0-24/MIC在不同MIC条件下的达标概率(probability of target attainment,PTA),以及在临床分离菌群体中的累计应答率(cumulative fraction of response,CFR)。当PTA或CFR>90%时,抗菌药物给药剂量通常被认为足够[7,17]。
2 结果
2.1菌株收集情况 共收集到血流感染革兰阴性杆菌9674株,菌种分布情况见表1,其中肠杆菌科细菌9160株,非发酵菌514株,分离较多的菌种为大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、阴沟肠杆菌阴沟亚种、沙门菌和粘质沙雷菌粘质亚种等。
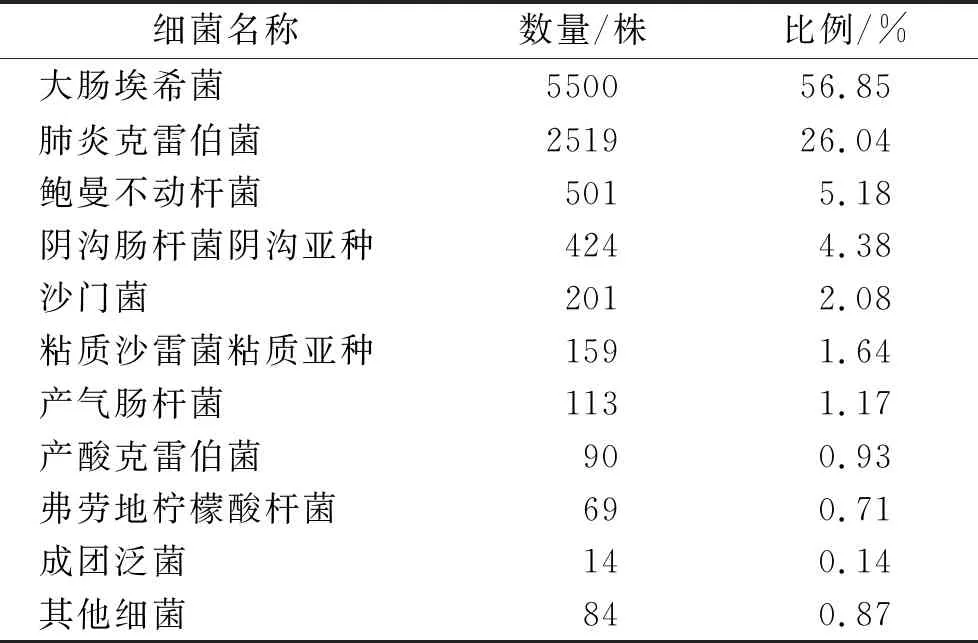
表1 血流感染菌株分布情况
2.2体外抗菌活性 替加环素对血流感染革兰阴性杆菌的体外抗菌活性见表 2,肠杆菌科细菌中MIC≤2 mg·L-1的菌株比例为99.7%,鲍曼不动杆菌比例为85.8%。
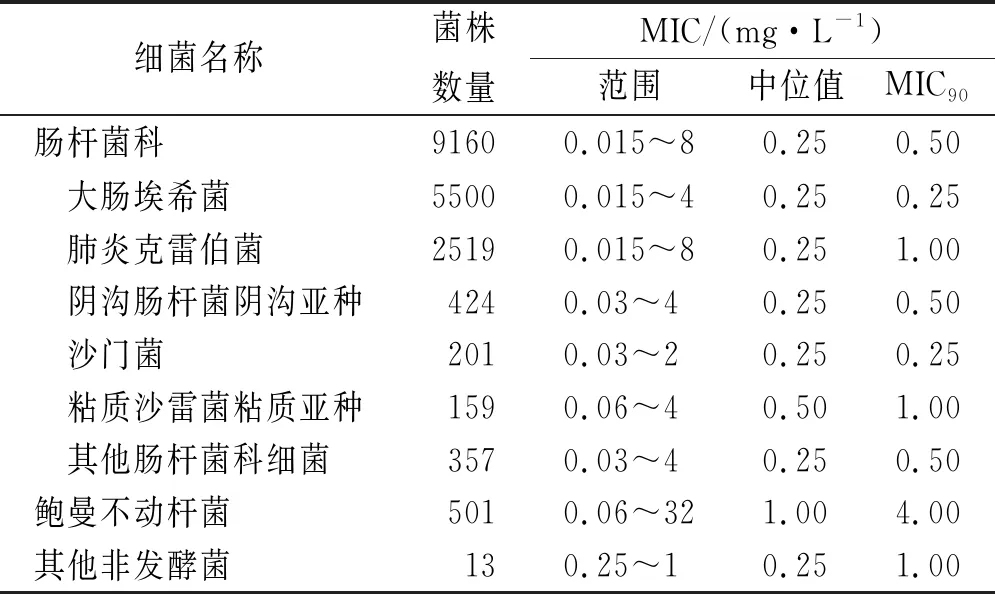
表2 替加环素对血流感染革兰阴性杆菌的体外抗菌活性
2.3替加环素不同给药方案的PTA 蒙特卡洛模拟中,替加环素4种给药方案对不同MIC菌株感染者的PTA见图 1。针对相同MIC菌株感染,随着不同给药方案中24 h给药剂量的增加,模拟血流感染患者接受替加环素治疗后fAUC0-24/MIC的PTA逐渐升高。当菌株MIC为1 mg·L-1时,方案一PTA仅78.98%,方案二达到88.50%,方案三和四均>90%。当菌株MIC为2 mg·L-1时,方案一~三PTA依次为26.41%、39.52%和72.65%,但方案四能达到87.98%。
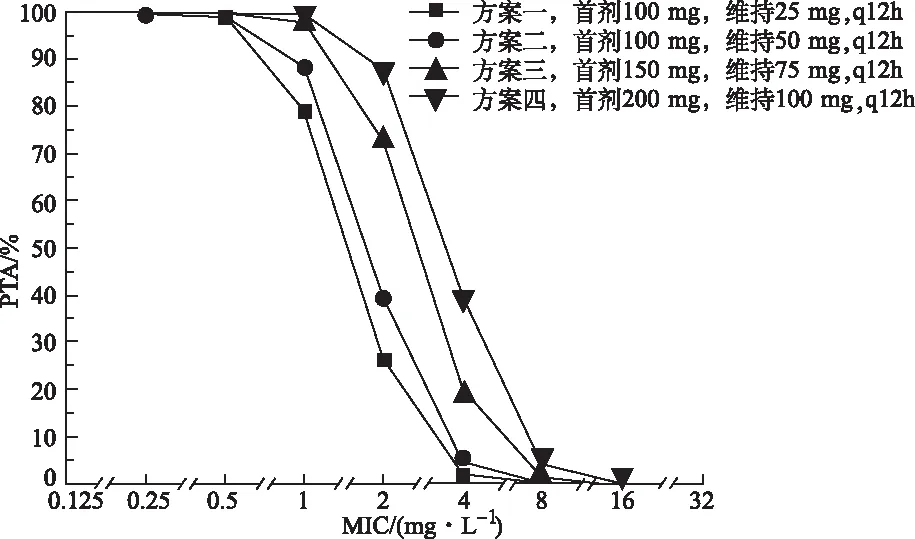
图1 替加环素4种给药方案对不同MIC菌株血流感染PTA
2.4替加环素不同给药方案的CFR 蒙特卡洛模拟结果显示,替加环素对肠杆菌科细菌血流感染有较高CFR,24 h给药剂量最低的方案一对各种肠杆菌科细菌感染的CFR均>90%。替加环素对鲍曼不动杆菌血流感染的CFR均较低,方案四CFR仅42.83%。但由于鲍曼不动杆菌占比(5.18%)较低,对革兰阴性杆菌血流感染患者总体而言,替加环素4种用药方案CFR仍然均>90%,见图2。
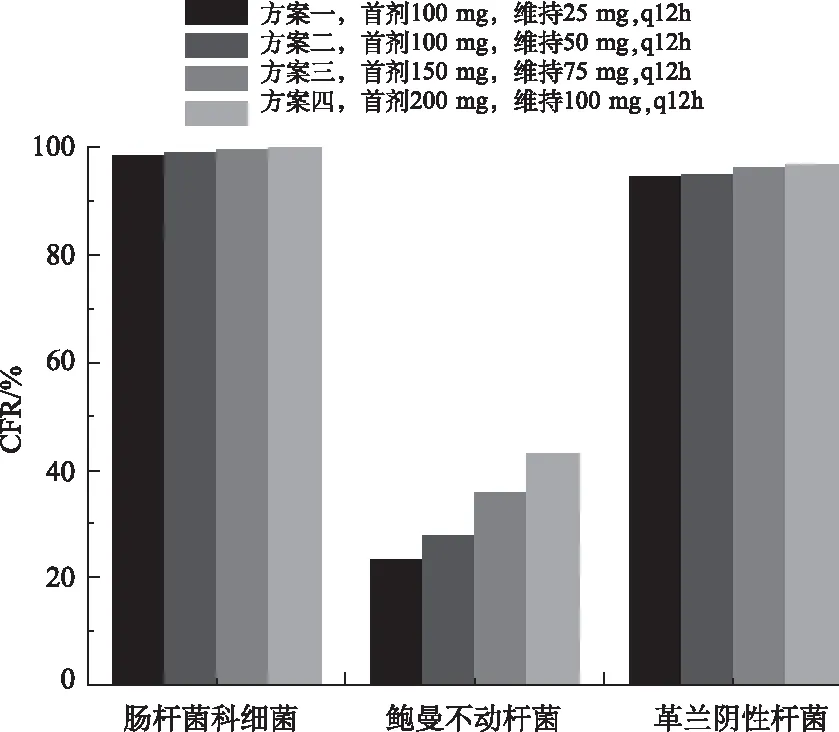
图2 替加环素4种给药方案对不同细菌血流感染的CFR
3 讨论
依据FDA标准,以2 mg·L-1为折点,血流感染肠杆菌科细菌和鲍曼不动杆菌对替加环素的敏感性分别为99.7%和85.8%[6]。BRICS研究数据显示,血流感染病原菌中革兰阴性杆菌占比>70%,其中对替加环素固有耐药的铜绿假单胞菌和变形杆菌分别仅占3.9%和0.5%;革兰阳性菌中金黄色葡萄球菌、肠球菌和链球菌等对替加环素的敏感性接近100%[6]。单从广谱体外抗菌活性看,替加环素可以作为经验治疗血流感染非常好的备选药物。但抗菌药物在体内的吸收、分布、代谢和排泄是一个动态过程,与MIC测定过程中固定药物浓度的情况存在很大差异,临床治疗中替加环素的用药方案也往往不统一,因此对于替加环素在说明书适应证之外的使用仍需进一步的证据[2]。
群体药动学研究可以通过数学模型来描述和预测药物在特定群体中的PK/PD总体特征,明确PK/PD变异性,进而为模拟临床试验、优化给药方案、设定抗菌药物PK/PD折点、评估药物的疗效等提供依据[18-19]。本研究基于群体药动学PK/PD模型,通过蒙特卡洛模拟评估替加环素4种临床给药方案治疗不同MIC菌株感染时fAUC0-24/MIC的PTA,结果显示当感染菌株MIC≤0.5 mg·L-1时,即使患者因肝功能不全需将维持给药方案调整为25 mg,q12h时,剂量依然足够。菌株MIC在1~4 mg·L-1之间时,PTA会随着给药剂量的增加显著提高。临床提高替加环素给药剂量主要受药物不良反应限制,研究显示,替加环素的胃肠道不良反应与进食相关,进食后患者能够耐受的单次给药剂量可以从100 mg 提高到200 mg[15]。值得注意的是,当MIC为2 mg·L-1时,替加环素常规推荐给药方案的PTA<90%,这可能与替加环素在人体不同部位的药动学分布特点与人群生理差异有关。
蒙特卡洛模拟中通过整合血流感染革兰阴性杆菌的MIC总体分布特点,可用CFR来预测替加环素经验治疗成功的概率[12]。对于肠杆菌科细菌,4种用药方案的CFR均>90%,提示替加环素治疗成功概率很高。对于耐药性较强的鲍曼不动杆菌,替加环素治疗方案的CFR均远<90%,方案四成功的概率也仅为42.83%。蒙特卡洛模拟结果表明,替加环素可以用于经验治疗肠杆菌科细菌导致的血流感染,但不适用于鲍曼不动杆菌相关血流感染。临床经常选择以替加环素为基础,联合头孢哌酮/舒巴坦、碳青霉烯类和多粘菌素类等药物治疗多重耐药鲍曼不动杆菌感染,但很多研究表明,以替加环素为基础的治疗方案并不适于多重耐药鲍曼不动杆菌所致血流感染[20-21]。因此,临床决定使用替加环素经验治疗血流感染前,首先应当评估变形杆菌、普罗维登斯菌、铜绿假单胞菌和鲍曼不动杆菌感染的可能性,这些病原菌可能导致抗感染治疗失败。相反,如果患者血流感染的是其他革兰阴性杆菌,同时面临细菌多重耐药风险性高、缺乏其他可用抗菌药物、治疗容错率较低等复杂因素时,可以选择以替加环素为基础的经验治疗。一项关于替加环素治疗血流感染的荟萃分析显示,对于血流感染重症患者,替加环素的联合治疗比单药治疗死亡率更低,更有优势[3]。
鉴于早期FDA警告替加环素在血液中的浓度较低,用于血流感染的治疗存在风险[15]。本研究使用的群体药动学模型和参数来自复杂腹腔感染和皮肤软组织感染患者,用于模拟血流感染患者可能存在一定偏差,因此虽然蒙特卡洛模拟显示替加环素可用于革兰阴性杆菌血流感染的治疗,但不应该作为一线药物。
志谢:本研究数据来源于全国血流感染细菌耐药监测联盟(BRICS)成员单位2018—2019年监测数据。特此鸣谢BRICS成员单位(排名按实际分析菌株):
浙江大学医学院附属第一医院;
丽水市中心医院;
滨州医学院附属医院;
连云港市第一人民医院;
安徽医科大学第一附属医院;
皖南医学院弋矶山医院;
安徽省立医院;
武汉市普仁医院;
荆州市第一人民医院;
宁夏回族自治区人民医院;
安阳地区医院;
云南省第二人民医院;
浙江省中医院;
黄山市人民医院;
宁德市闽东医院;
济宁医学院附属医院;
庆阳市人民医院;
滕州市中心人民医院;
六安市人民医院;
新疆伊犁哈萨克自治州友谊医院;
宜春市人民医院;
九江市第一人民医院;
山东第一医科大学附属省立医院;
荆州市中心医院;
赣南医学院附属第一医院;
莆田市第一医院;
海宁市人民医院;
胜利油田中心医院;
牡丹江医学院附属红旗医院;
宁波大学医学院附属医院;
浙江大学医学院附属妇产科医院;
安徽医科大学第四附属医院;
安徽省天长市人民医院;
陕西省人民医院;
河南科技大学第一附属医院;
荆州市第二人民医院;
六安世立医院;
蚌埠医学院第二附属医院;
河南大学淮河医院;
山东大学齐鲁儿童医院;
自贡市第三人民医院;
山西医科大学第二医院;
安徽庐江县人民医院;
嘉峪关市第一人民医院;
合肥市第三人民医院;
中国人民解放军北部战区总医院;
新余市新钢中心医院;
西安医学院第一附属医院;
甘肃省中医院;
郴州市第一人民医院;
山西医科大学第一医院;
云南省盈江县人民医院;
福建医科大学附属第二医院;
六安市儿童医院;
南昌大学第一附属医院;
兰州大学第二医院。
