3004例乌灵胶囊上市后安全性医院集中监测研究*
2022-08-12王嘉麟周莉王忠邢佳高翔焉石侯震刘小北曹利民陆文惠单利华0吕莹常和生郭蓉娟
王嘉麟,周莉,王忠,邢佳,高翔,焉石,侯震,刘小北,曹利民,陆文惠,单利华0,吕莹,常和生,郭蓉娟
(1.北京中医药大学东方医院康复科,北京 100700;2.北京中医药大学东直门医院脑病二科,北京 100700;3.中国中医科学院中医临床基础医学研究所,北京 100700;4.宁波大学医学院附属医院神经内一科,宁波 315000;5.中国医科大学航空总医院中医科,北京 100012;6.北京市大兴区人民医院中医科,北京 102600;7.平湖市第一人民医院神经内科,平湖 314200;8.杭州市萧山区中医院神经内科,杭州 311201;9.西安交通大学第一附属医院神经内科,西安 710061;10.浙江省海宁市人民医院神经内科,海宁 314400;11.清华大学附属垂杨柳医院神经内科,北京 100022;12.北京丰台医院精神科,北京 100071;13.北京中医药大学东方医院党院办,北京 100700)
乌灵胶囊于1999年获批生产并上市,是源于珍稀药食兼用真菌黑柄炭角菌(别名乌灵参),经现代生物工程技术精制而成的纯中药制剂。其制备工艺和菌种为国内首创,是国家中药一类新药。其化学成分与天然乌灵参相似,含有腺苷、腺嘌呤、甘露醇、鸟苷、多糖、19种氨基酸(其中必需氨基酸9种)以及多种维生素和微量元素[1-2]。乌灵胶囊适用于心肾不交所致失眠、健忘、心悸心烦、神疲乏力、腰膝酸软、头晕耳鸣、少气懒言、脉细或沉无力、神经衰弱见上述症候者[3],具有补肾健脑、养心安神功效。药理研究证实,乌灵胶囊能增加脑组织对兴奋性神经递质谷氨酸和抑制性神经递质γ-氨基丁酸的通透性,保护和提高大脑生理功能,增强谷氨酸脱羧酶活性,从而使γ-氨基丁酸合成增加,同时可提高γ-氨基丁酸受体活性,最终发挥镇静安眠作用[2]。
目前,乌灵胶囊在临床上已广泛应用。但其相关药物不良反应(adverse drug reaction,ADR)和不良事件(adverse drug event,ADE)笔者鲜见报道。笔者统计国家药品不良反应监测系统全国数据库,发现2009年至2013年仅收到乌灵胶囊相关一般ADR392例,其中皮疹瘙痒67例,恶心42例,腹泻 31 例,呕吐 31 例。ADR发生率每万人0.33例。涉及乌灵胶囊相关的ADR文献报道少。杨怀恩[4]报道2例患者在无明显诱因情况下,服用常规剂量乌灵胶囊后出现水样腹泻,同时伴有恶心、呕吐症状。陈文燕等[5]应用乌灵胶囊合用生脉注射液治疗失眠症40例,口服乌灵胶囊后l例患者出现大便稀,l例患者出现上腹部轻度不适,未作处理。但是受研究局限性以及缺乏大规模人群临床研究,上述ADR证据级别较低。
药品上市后安全性再评价,可以弥补药品上市前研究不足,医院集中监测是近年来药物临床安全性评价中主动监测方法之一,具有不干预临床用药、资料详尽、数据准确可靠、能够计算出ADR相对发生率,并可对其危险因素进行探讨等特点[6-7]。根据《药品不良反应报告和监测管理办法》(卫生部令第81号)、《关于加强国家基本药物目录(2009版)药品不良反应监测相关工作的通知》(监测与评价综[2009]199号)等规范文件要求,笔者在本研究以乌灵胶囊为研究对象,采用医院集中监测法,对在真实世界下使用乌灵胶囊的患者进行系统研究,明确乌灵胶囊上市后大规模人群使用时的临床安全性,发现安全性信号,现报道如下。
1 资料与方法
1.1资料来源 选择2013年6月15日—2015年12月31日12家医疗机构(北京中医药大学东方医院、北京中医药大学东直门医院、宁波大学医学院附属医院、北京丰台医院、浙江省海宁市人民医院、中国中医科学院广安门医院南区、中国医科大学航空总医院、北京市大兴区人民医院、清华大学附属垂杨柳医院、杭州市萧山区中医院、西安交通大学第一附属医院、平湖市第一人民医院所有使用乌灵胶囊(批准文号:国药准字Z19990048)且符合伦理要求的患者为研究对象。参考2013年《中药上市后安全性医院集中监测技术规范》(征求意见稿)[7]中关于样本量计算的“三例原则”,即“在现有X例研究中没有观察到特定事件的发生,则有95%可能性相信这类事件发生率≤3/X”,并按检出罕见药品ADR(1/10000—1/1000)估算,拟收集3000例。
1.2研究设计 本研究采用单臂、多中心、前瞻性医院集中监测设计。
1.3医学伦理与注册 本研究监测方案通过北京中医药大学东方医院临床研究伦理委员会审查,伦理委员会批件文号:2013041702-2,方案在中国临床试验注册中心网站(网址https://www.chictr.org)注册,注册号:ChiCTR-ONC-13003245。
1.4监测方法和流程 由经过统一培训的、指定的医生、护士或者药学工作者根据监测医疗机构门诊现场记录或者医院信息管理系统(hospital information system,HIS),无挑选、连续地纳入使用乌灵胶囊的患者(即被监测者)。被监测者自用药开始即进入患者监测阶段,并记录在《乌灵胶囊集中监测观察表》中,选择第0天、第7天、第30天及其后每隔30 d为一个随访点,直至患者停止使用乌灵胶囊。在用药期间发生ADE,需研究者在获知后24 h内填写《乌灵胶囊不良事件观察表》,并及时随访和电话追踪患者ADE转归情况及采取措施,若发生任何严重ADE(包括需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),研究者除立即对受试者采取紧急的处理措施外,还必须立即(3 h内)报告本研究中心负责人或监查员,监查员应在12 h内到达现场了解并反馈处理结果。纸质观察表格由填表者和观察者签名。
1.5安全性评价指标 本研究选取ADE/ADR发生率、ADE/ADR转归、ADR危险因素(如年龄、性别、既往史、剂量等)等为评价指标。其中ADE/ADR分类参照《WHO药品ADR术语集》[8],并根据国际医学科学组织委员会(CIOMS)推荐使用的标准[9]。将ADR发生率分级为:十分常见(≥10%)、常见(1%~<10%)、偶见(0.1%~<1%)、罕见(0.01%~<0.1%)、十分罕见(<0.01%)。并根据国家药品不良反应监测中心现行6级评价标准(肯定、很可能、可能、可能无关、待评价、无法评价)[10]进行ADR关联性评价。ADE/ADR依次经过监测者及临床专家判读,对确实难以判定或监测者与临床专家判读结果不一致时,由监测医疗机构专家委员会召开专家会议讨论后确认。
1.6质量控制 本项目的研究过程进行严格的质量控制,分工明确,责任到人。
1.6.1研究中心与研究者 项目方案经论证后,由合同研究单位根据企业和品种的市场分布情况,联系确定研究中心及研究者,明确工作流程、工作职责。研究者选择具有实施能力的医师、护士、药学工作者。
1.6.2药物安全监测委员会 本项目聘请或委任4名医学(分别是神经内科、精神科、康复科、中医科)、2名药学(均为临床药师)、2名药品监督管理、2名统计学方面的专家提供咨询意见。这些专家可以从他们各自的专业角度提供专业意见。该委员会的主要任务为:在集中监测期间,定期对安全性数据进行阶段性分析,这种分析主要着重于系统性分析,也就是经过对统计学处理过的数据进行分析,通过与历史性数据进行对比,观察ADR与ADE发生率、分布情况以及是否具有临床意义。
1.6.3项目培训 在牵头单位及分中心召开方案实施启动会,对各研究中心负责人、研究者、监查员、监查助理等涉及人员进行培训,明确工作流程、工作职责,统一工作表格、在线系统的填写规范。
1.6.4报表质量 统一制定观察表,并附填表说明和研究者手册。每份观察表必须由指定的填表员亲自填写,监测人员在收集观察表时,应确认该表填写无误,并签名;组织单位对收集的报表按10%的比例进行抽查;对于严重病例,应定期随访,直至项目结束。
1.6.5观察表失访 每份观察表事先制定唯一编码,根据各地区项目负责人掌握的销售情况,估计观察例数,如有报表缺失,需注明原因。
1.6.6ADE失访 项目组对未发生ADE的病例按照10%比例进行电话回访。
1.7数据管理 本研究数据采集使用集中监测观察表(纸质资料)和在线数据系统(电子数据库)。纸质材料实行双人双份录入、核对制度,原始报表由组织单位统一保管,查阅报表者需签名登记。
在线系统的建立及研究期间的维护委托专业单位完成,组织单位、主办单位等单位的相关人员具有不同的访问权限,及时查看在线病例数据,及时处理疑问。研究结束后由中国中医科学院中医临床基础医学研究所负责数据分析。数据分析完毕后交由组织单位和主办单位保存。
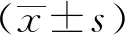
2 结果
2.1病例分布
2.1.1一般人口学资料 本研究共纳入患者3004例,年龄12~102岁,平均(51.00±15.65)岁。其中男1000例,平均(51.03±16.76)岁,女1997例,平均(50.99±15.06)岁,7例患者未填写一般人口学资料。本研究中首次使用乌灵胶囊患者2738例(91.15%)。
2.1.2用药情况 按乌灵胶囊说明书所示,乌灵胶囊用法用量为一次3粒,一日3次。根据本研究纳入3004例患者服用药物剂量记录:其中平时剂量为3粒2683例(89.31%),其他粒数321例(10.69%);根据用药频次,其中一日1次、一日2次、一日3次分别是301例(10.02%)、28例(0.93%)、2675例(89.05%)。本研究中有84例患者存在特殊剂量使用情况。其中一日3粒、4粒、6粒以及早3粒晚6粒患者分别是17例(0.57%)、10例(0.33%)、57例(1.90%)、2例(0.07%)。
2969例有停药原因记录,其中治愈1171例(38.98%),无效换药277例(9.22%),其他1410例(46.94%),不详111例(3.70%)。3004例患者均记录是否存在间隔用药,其中有间隔用药者545例(18.14%),无间隔用药者2459例(81.86%);均记录是否依据中医证型用药,其中完全符合2068例(68.84%),基本符合926例(30.83%),不符合但接近10例(0.33%);均记录是否存在合并用药,其中有合并用药1762例(58.66%),无合并用药1242例(41.34%)。
2.2安全性分析
2.2.1ADE/ADR发生情况 研究结束时,3004例中发生ADE19例,包括食欲减退和腹泻各4例,胃部不适3例,感冒和口干各2例,神倦乏力、恶心、心悸头痛、头晕各1例,发生率0.63%,无严重ADE发生。根据国家药品不良反应监测中心现行6级评价标准,15例经专家判断为ADR,ADR发生率0.50%,无新发现ADR。各中心监测病例数及发现的ADE/ADR明细见表1。
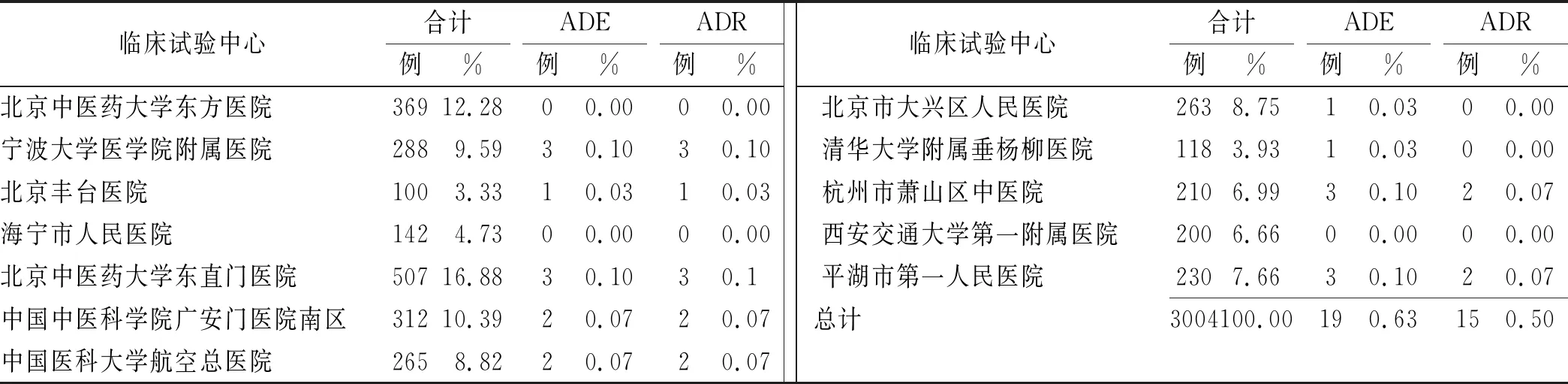
表1 乌灵胶囊监测中心分布情况
2.2.2ADE/ADR表现、处置及转归 19例ADE,治愈8例,好转11例。2例停药,其余17例均按原剂量继续使用,见表2。

表2 ADE/ADR表现、转归及判定
2.2.3ADR累及系统 15例药物ADR主要累及系统是胃肠系统损害(食欲减退、口干、恶心、腹泻、胃部不适),交感-副交感神经系统损害(心悸),中枢及外周神经系统损害(头晕、头痛),即主要为消化系统和神经系统,见表3。

表3 乌灵胶囊ADR分布与表现
2.2.4ADR影响因素分析 治疗中心、性别、年龄分段、既往病史、首次用药、ADR史、家族ADR、首次剂量、平时剂量(粒·次-1,次·d-1)、特殊剂量(粒·次-1,次·d-1)、疗程、停药原因、辨证用药、有无合并用药对乌灵胶囊的ADR发生率影响差异无统计学意义,见表4。

表4 ADR影响因素分析
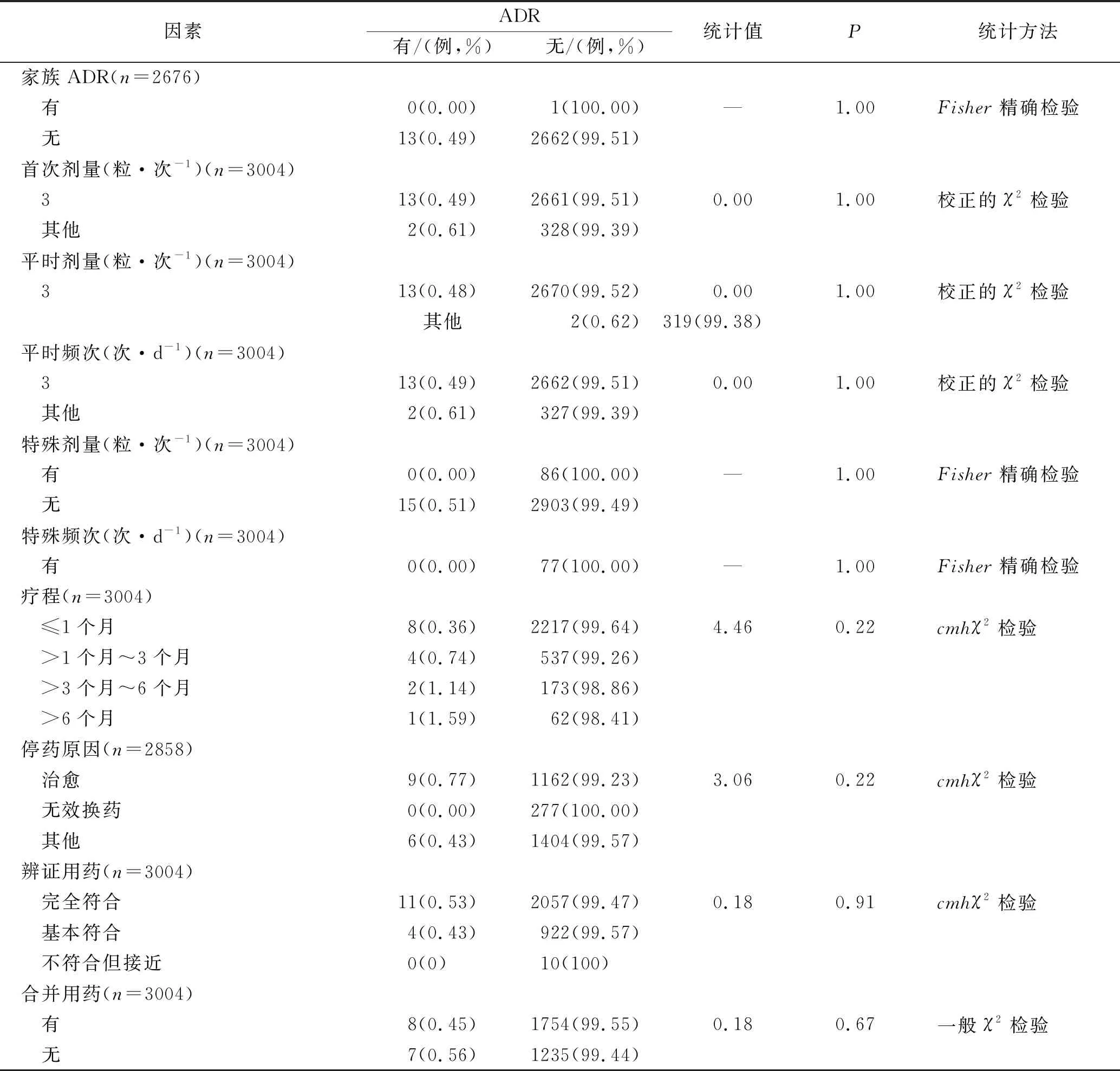
续表4 ADR影响因素分析
3 讨论
3.1乌灵胶囊的安全性 乌灵参又称乌灵菌、鸡茯苓、雷震子等,具有镇静安神、补气固肾、健脾除湿等功效。目前,其中药制剂乌灵胶囊在神经、精神、消化系统疾病中应用广泛,虽然乌灵参属于药食两用中药,但是在临床应用时,仍偶见上腹不适、腹泻等消化系统症状。笔者曾收集1989—2009年有关乌灵胶囊应用的文献75篇[11],发现其ADR包括水样便、恶心呕吐、上腹不适、过敏性皮炎、心悸、头晕头痛等,停药后可自行恢复正常。一项多中心、随机、双盲、双模拟平行对照研究[12]发现,无伴随精神用药的群体中,单独服用乌灵胶囊比单独服用氟哌噻吨美利曲辛的ADR发生率更低。另一项多中心、随机、双盲研究[13]观察到,受试者服用乌灵胶囊或者安慰药,其ADR发生率无明显差异。上述两项多中心研究均证实服用乌灵胶囊具有较高安全性。但为更系统研究该药ADR及ADE,本研究采用多中心医院集中监测法,进行乌灵胶囊上市后安全性再评价,以期获得更真实、客观的临床使用数据,从而更好指导临床用药。
本研究在2015年12月底共收集临床病例3004例,随后经过病例登记表数据复核等一系列审核及统计工作,直至 2019 年底获得初步结论。数据整理期间,国家药品不良反应系统新收到ADR704例,结合乌灵胶囊的用药人群估算,推测其ADR发生率约为每万人0.76例,且以皮疹瘙痒、恶心、腹泻为主。虽然后期ADR发生率略高于早期每万人 0.33 例,但仍低于本研究采用医院集中监测观察到的结果。因此,也客观证明医院集中监测研究在探讨药物安全性问题上具有一定优势。在本研究中,所有患者均使用乌灵胶囊,研究结果显示乌灵胶囊ADR症状包括食欲减退、腹泻、胃部不适、口干、恶心、心悸、头痛、头晕等,其中以消化系统多见,属偶见ADR,未见严重ADE。乌灵胶囊ADE/ADR发生率分别为0.63%及0.50%,同时未发现与ADR相关影响因素,包括中心效应、患者性别、年龄、既往史、首次用药、ADR史、家族ADR、首次剂量、平时剂量、特殊剂量、疗程、疗程分段、停药原因、辨证用药、合并用药等,因此该药临床应用安全性较高。
3.2本研究的优势 药物上市后安全性研究中,包括大样本医院集中监测研究、基于国家药品不良反应监测中心数据的ADR信号发现、文献分析等[14]。本研究采取大样本、前瞻性医院集中监测方法,其数据来源于真实世界,不仅能观察到不良事件发生情况,而且已知使用药物的基础人群情况,因此能计算ADR发生率,得出的结论是药物安全性研究中证据级别最高的[15],也是目前较好的药物安全性研究方法。
3.3本研究的缺陷 在ADE和ADR观察方面,本研究可能存在一定问题:①研究涉及的实验室指标相对较少,有可能低估实验室检查异常值方面的ADE/ADR;②研究医院的选择主要集中在北京市、浙江省和陕西省。对于西部和南部等地区用药情况欠缺,可能地域选择存在偏倚;③部分医学中心对ADR理解有偏差,如将“感冒”当成ADR上报;填表不仔细,缺失项目较多,提示培训中表格填写的统一性和填表质量的督导力度仍不够,均予以剔除。
总之,通过本研究证实乌灵胶囊ADR属偶见ADR,临床应用安全性较高。但是后续仍需要重视新发现的ADR,并进行深入的研究阐明其发生机制,来修订和完善药品使用说明书,为临床安全用药提供依据。同时集中监测法是开展中成药安全性研究的适宜方法。
