腹主动脉瘤病人血清和组织中Notch1和T细胞激活分泌调节因子的表达及其意义
2022-08-12李光泽张济林昌俭俞慎林包平倩
李光泽 张济 林昌俭 俞慎林 包平倩
腹主动脉瘤(abdominal aortic aneurysm,AAA)定义为腹主动脉局部扩张超过正常直径的1.5倍,是一种老年人群的慢性退行性疾病,与炎性反应密切相关[1]。AAA早期无明显症状,早期诊断指标有限,在发现时病人出现破裂和血栓的风险大大提高[2]。Notch通路是细胞内调控细胞免疫和炎性反应的关键通路,Notch被激活后可通过促进细胞中泌白细胞介素(interleukin,IL)-1β、IL-6以及凋亡蛋白的分泌,从而引起血管重塑[3]。T细胞激活分泌调节因子(reduced upon activation mormal T expression and secreted,RANTES)是一种由血管细胞分泌的趋化因子配体,具有促进炎症影响血管结构和功能的作用,参与血压引起血管病变以及动脉粥样硬化等[4]。本文分析Notch1和RANTES在AAA病人血清和组织中的表达及其意义。
对象与方法
一、对象
2019年1月~2021年1月于我院接受手术治疗的AAA病人41例作为AAA组,年龄45~80岁,平均年龄(59.4±4.4)岁,男23例,女17例,吸烟史15例,高血压18例,糖尿病8例。所有病人均保存外周血液标本,在手术过程中收集AAA组织和AAA旁距病灶3 cm以上的正常腹主动脉组织。同时选择在我院进行体检的健康志愿者41例作为健康组,年龄44~78岁,平均(58.7±4.5)岁,男22例,女18例,吸烟11例,高血压12例,糖尿病5例。两组一般资料比较差异无统计学意义。本研究经我院伦理委员会批准。纳入标准:年龄45~80岁;CT血管造影符合AAA的诊断标准[5];首次发病;病人均签署知情同意书。排除标准:合并全身性感染;合并精神异常、意识障碍;合并恶性肿瘤、自身免疫性疾病、血液学疾病;资料不全。
二、方法
1.RT-qPCR检测:提取外周血中总RNA,逆转录,条件:37 ℃/15分钟;98 ℃/5分钟。使用BestarTMqPCR试剂盒(DBI Bioscience公司,德国)进行qPCR实验,条件如下:95 ℃ 2分钟, 94 ℃ 20秒,58 ℃ 20秒,72 ℃ 20秒,40个循环,72 ℃下延伸4分钟。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。通过比较循环阈值并以GAPDH作为内参计算Notch1 mRNA的相对表达水平。Notch1上游引物:5'-TCAGCGGGATCCACTGTGAG-3',下游引物:5'-ACACAGGCAGGTGAACGAGTTG-3',GAPDH上游引物:5'-TGAGGCTGGAAGTGGAAG-3',下游引物:5'-CTTTAGGGTAGTGGTAGAAG-3' 。
2.ELISA检测:外周血离心(2 000 rpm,20分钟)收集血清。根据试剂盒说明书加入抗体和显色剂进行反应,利用酶标仪检测450 nm吸光度,根据标准曲线计算RANTES的浓度。
3.Western blot检测:组织裂解后4 ℃,12 000 rpm离心5分钟,收集总蛋白。8% SDS-PAGE分离样品中等量(50 μg)的蛋白质,并转移到硝酸纤维素膜上。室温下将膜浸入5%脱脂牛奶中2小时封闭非特异性抗原。将膜分别与anti-Notch1和anti-RANTES在4 ℃下孵育过夜,将膜与相应的二抗室温下孵育1小时。使用化学发光试剂盒进行显色,使用Quantum One软件分析灰度计算蛋白相对于GAPDH的表达量。
三、统计学处理

结果
1.血清中Notch1 mRNA和RANTES水平比较: AAA病人血清中Notch1 mRNA和RANTES水平均高于健康组,两组比较差异有统计学意义(P<0.05)。见表1。

表1 血清中Notch1 mRNA和RANTES水平比较
2.Notch1和RANTES蛋白在AAA组织中的表达:AAA组织中的Notch1和RANTES蛋白表达水平高于正常的腹主动脉组织,两组比较差异有统计学意义(P<0.05)。见图1和表2。
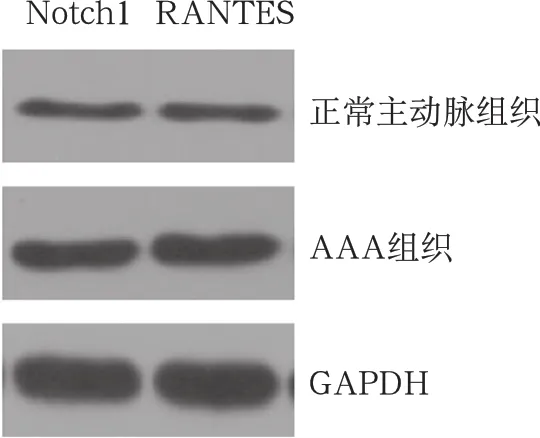
图1 Western blot检测AAA组织和主动脉组织中Notch1和RANTES蛋白表达水平

表2 AAA组织和主动脉组织中Notch1和RANTES蛋白相对表达水平
3.Notch1和RANTES在血清和组织中的相关性:AAA病人组织Notch1蛋白水平和血清Notch1 mRNA水平正相关(r=0.485,P=0.025);组织中RANTES蛋白水平与血清RANTES浓度正相关(r=0.506,P=0.016)。见图2。
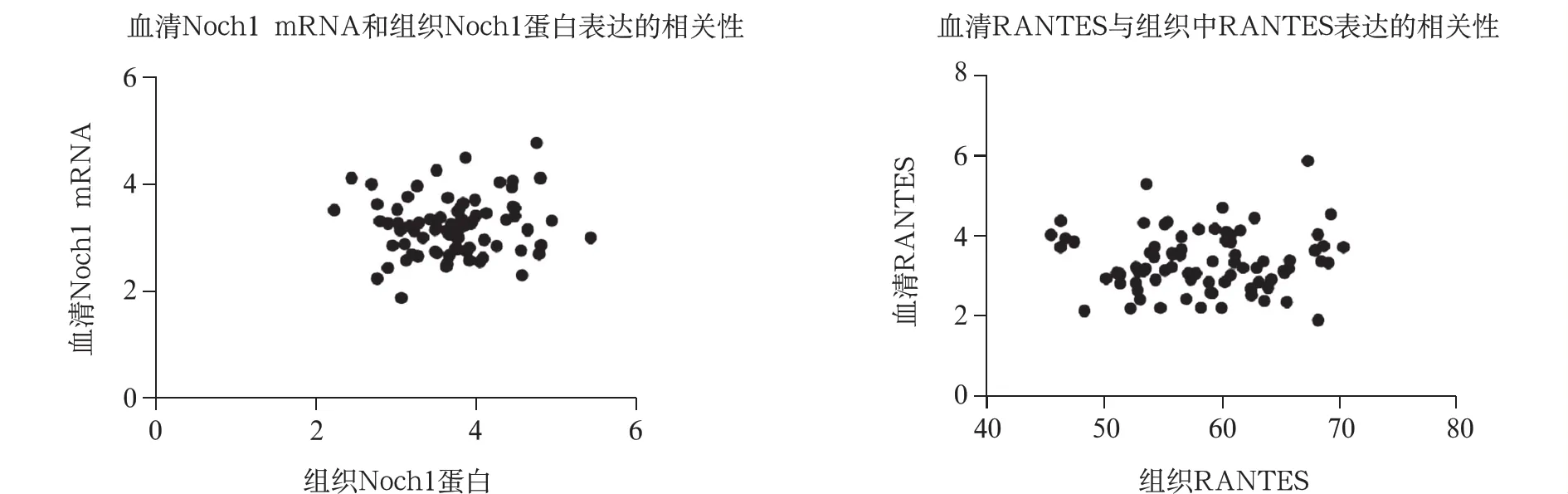
图2 Notch1和RANTES在血清和组织中的相关性
4.AAA中Notch1与RANTES的相关性:在AAA病人组织和血清中,Notch1和RANTES表达均呈正相关(r血清=0.515,P=0.014;r组织=0.537,P=0.008)。见图3。

图3 AAA中Notch1与RANTES的相关性
讨论
目前,治疗AAA的方法仍主要为对症治疗。有研究表明,炎性反应参与AAA的发生和发展进程,且免疫细胞的浸润和血管凋亡促进AAA疾病进展[6]。
Notch通路是诱导促炎基因转录的关键通路,在炎性进程中,Notch1蛋白过表达,其剪切下的NICD片段会进入细胞核诱导转录的激活,促进IL-6和TNF-α等的表达和分泌[7]。RANTES也称为CC趋化因子配体5(CCL5),是炎症细胞的重要化学引物,与动脉的粥样硬化发病机制有关[8]。RANTES可以由血管细胞和脂肪组织的常驻细胞产生,体外添加的血管紧张素Ⅱ会增加RANTES在小动脉和小静脉内皮中的表达,而RANTES在血管周围炎症的发生中起关键作用,并引起高血压相关的血管功能障碍[9]。本次研究主要分析Notch通路和RANTES是否参与了AAA的发生和发展,结果表明AAA病人血清中Notch1 mRNA和RANTES的水平显著高于健康者,且AAA组织中的Notch1和RANTES蛋白水平也显著高于正常AAA组织。此外,AAA组织中的Notch1和RANTES水平与血清正相关。本次研究结果初步表明,Notch1和RANTES的过表达可能参与了AAA的发生或发展,并且组织中的Notch1和RANTES水平可反应在血清中,提示检测血清中Notch1和RANTES的水平可能是早期辅助诊断AAA的可行的指标。但是关于Notch1和RANTES在AAA中的临床意义仍需要扩大样本分析。
T淋巴细胞和组织中浸润的巨噬细胞也参与AAA的发生和发展,它们会响应各种环境因素而发生表型变化,从而分泌细胞因子导致血管重塑[10-11]。Notch通路不但会促进T淋巴细胞分泌炎性因子,还会促进巨噬细胞向M1表型转化,M1表型巨噬细胞会分泌IL-6和TNF-α等引起血管内皮细胞损伤、凋亡[12]。而Notch通路也会促进免疫细胞中RANTES的表达,从而进一步激活炎性反应[13]。本研究中,AAA病人血清和组织中Notch1和RANTES均呈现正相关,初步说明了Notch1和RANTES存在共同促炎的作用。文献报道提示,Notch1可能通过促进RANTES的表达促进炎性反应,进而参与AAA[14]。然而,Notch1促进RANTES表达的机制仍需要进一步的细胞定位的方法验证Notch1与RANTES表达在AAA组织中的何种细胞,从而进一步分析Notch1和RANTES参与AAA的机理。
综上所述,AAA病人血清和组织中的Notch1和RANTES均过表达,且二者正相关。检测血清Notch1 mRNA和RANTES水平对AAA早期诊断具有重要意义。
