环介导等温扩增技术LAMP在植物病毒检测中的研究进展
2022-08-11孟若雪
孟若雪
(贵州省植物保护研究所,贵州 贵阳 550006)
植物在人的生存发展中起着尤为重要的作用。植物可作为食物、观赏、灾害防控等作用,植物的第二大病原是植物病毒,植物病毒每年给重要经济作物带来严重的损失,全世界每年农作物遭到植物病毒危害造成的损失达200 亿美元[1],对人类的生存和发展构成严重威胁。植物病毒病有很多种,对植物的影响不仅包括外观的损害,还包括植物的质量,在植物病毒病的防控方面人们采取了很多措施,但并不能阻止植物病毒病的快速传播,所以切断来源就成了最为重要并且主要的防控措施,生产初期对植物种苗以及种薯进行脱毒处理便成为主要的防控措施。
植物病毒病的识别、诊断及病原鉴定比真菌和细菌病害的鉴定更复杂,传统植物病毒病一般根据症状,发生特征、寄主类型、植物长势、显微镜观察以及血清学方法进行检测鉴定,常依靠的是试验人员的经验[2]。这些方法存在很多不足,因为很多病毒在引起病害过程中的病症较相似,寄生在寄主的过程中变化也较快,不能根据简单的血清学方法鉴定,因此,只依靠传统的方法进行检测,不但影响检测效率,还很难适应多种变化的检测环境。
随着分子生物学、生物化学、免疫学的进步,为植物病毒的鉴定监测和量化提供了新的方法。NOTOMI 等[3]于2000年开发了一种新型的核酸扩增方法——环介导等温扩增法(Loop-mediated isothermal amplifica⁃tion,LAMP),该方法只需要一台环介导等温扩增仪,在等温条件下可以高效、灵敏、快速、特异地扩增靶序列,且操作简便,适合各种各样的检测环境。该方法广泛应用于医学病原物检测、食品安全检测、饮用水检测等方面,近年来,开始应用于植物病原物的检测,但在应用过程中呈现出一些问题。介绍LAMP方法的原理、特点、植物病毒LAMP检测的应用进展以及未来的发展趋势,为植物病毒病的早期预防提供技术支撑,同时也为该技术更好应用于其他领域提供借鉴。
1 LAMP方法原理及特点
1.1 LAMP引物的设计和扩增原理
在LAMP反应中,引物设计较复杂,决定LAMP 方法能否具有高效特异反应的关键主要在于引物设计的合理性,只有最佳的引物才能与Bst 聚合酶产生链置换反应。设计LAMP 引物的过程主要是针对靶基因的6 个特定区域,通过LAMP引物的设计原理,主要设计4个引物,包括1对外引物和1对内引物。如果想提高引物的特异性并且缩短LAMP反应的时间,还可以在引物组里面添加1对环引物[4-5],如图1所示。
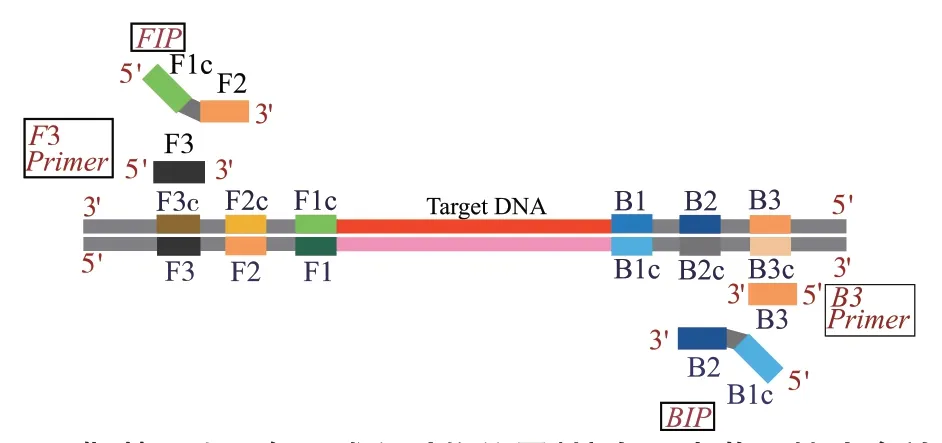
图1 靶基因上6个区域和引物位置(摘自日本荣研株式会社)
Bst DNA 聚合酶适宜的温度是60~65℃,所以LAMP 反应温度一般设置为60~65℃,并且是等温扩增,不同病毒LAMP 反应的温度可能略有差异。LAMP 反应的第一阶段如图2所示,模板首先与内部引物进行特异性结合,同时,在聚合酶作用下进行有效的扩增反应,特定的序列开始向前延伸,在引发链中进行置换反应,替换新的目的序列,然后引入外部引物以形成环结构[6]。第二阶段,主要涉及到内部引物的参与,引物和模板进行特异性识别的过程中,模板通过延伸和置换无限的循环作用,在反应结束后,形成大小不同的双链DNA混合物[7-8]。
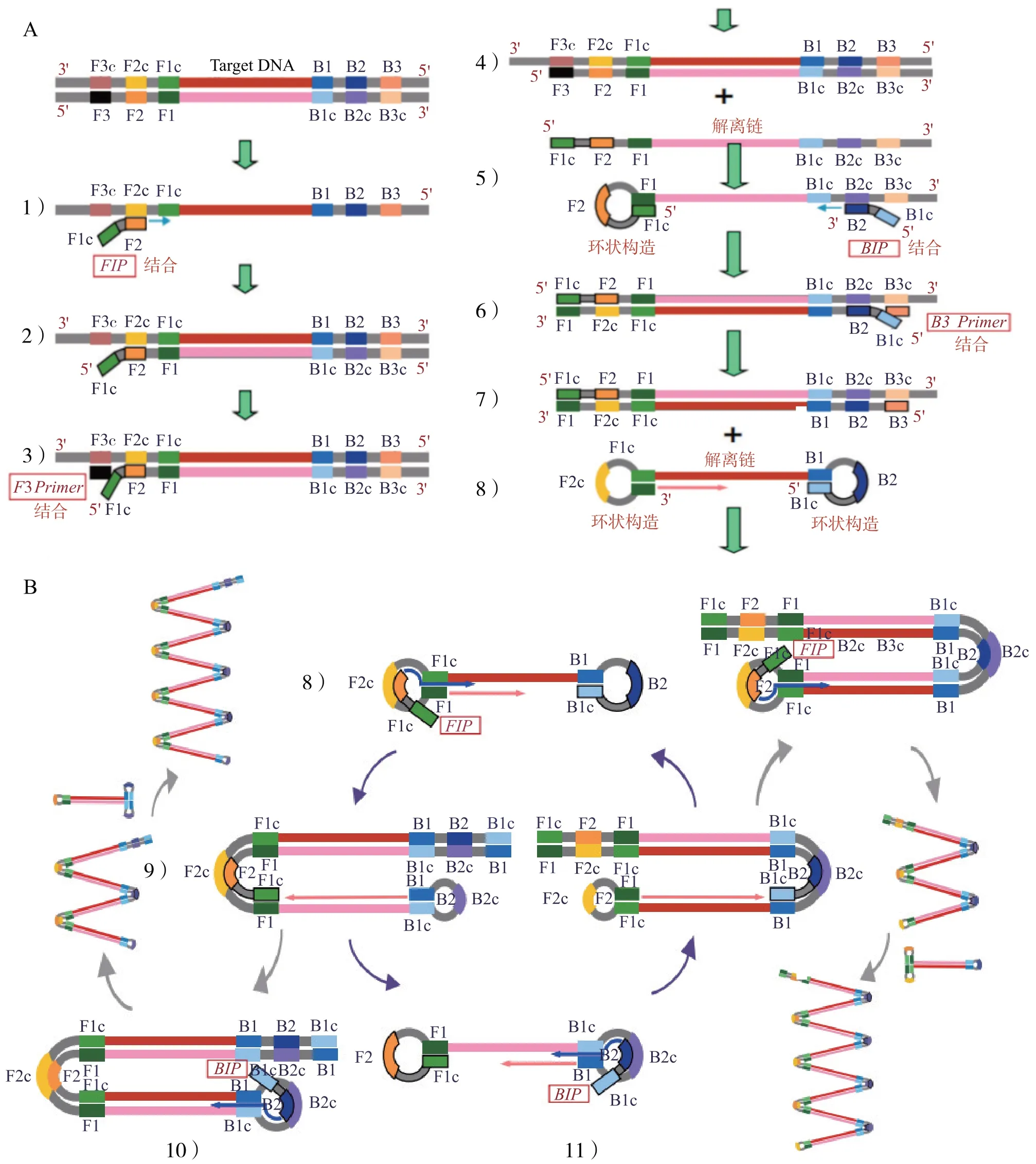
图2 LAMP反应原理(摘自日本荣研株式会社)
1.2 LAMP的反应体系
LAMP 反应体系需要在缓冲液、镁离子、活性酶和引物组的参与下完成。LAMP 所需的酶是具有链置换功能的Bst DNA 聚合酶,并且RT-LAMP 还需要添加抑制酶和逆转录酶;缓冲液的主要作用是在LAMP 扩增过程中起辅助和缓冲在适当的条件下进行反应;引物组包括外部引物和内部引物,外部引物和内部引物的浓度不同;与此同时,镁离子和dNTP 的参与也非常重要,在这些试剂的共同作用下,酶才能进行充分反应。并且LAMP 反应中各个试剂的浓度也会影响到反应进程,所以对体系中浓度的优化可以提高LAMP反应的效率[9]。
1.3 LAMP方法的特点
1.3.1 高效、快速、耗时短 整个扩增反应在恒定温度(60~65℃)进行,过程中不需要经过普通PCR那样几十次循环的变性退火延伸过程,体系反应时间大大缩短,通常在60 min 内就可以完成反应并检测指定样品[10]。
1.3.2 特异性比较强 设计LAMP 引物的过程较繁琐,LAMP 的4 条引物主要是针对靶基因的6 个区域进行设计,并且这6 个区域之间的序列识别有严格的顺序性,这决定了LAMP方法具有较高的特异性。
1.3.3 操作便捷且对仪器设备要求不高 LAMP 反应全程在固定温度(常在60~65℃)中完成,所以只有确保等温环境即可,对仪器要求不高,特别是对于基层实验室,常见的水浴锅就能满足要求。
1.3.4 灵敏度高 LAMP 反应的灵敏度非常高,并且能够在短时间内对样品进行扩增,扩增的数量级可以达到107数量级,最低能够检测到10 pg/μL 的样品,比普通PCR 灵敏100 倍,并且LAMP 反应的准确性和实时荧光PCR 相当,因此当检测病毒量较少的样品时,LAMP方法比较适合[11]。
1.3.5 能够直接扩增RNA LAMP 方法可直接扩增RNA,并且可以向体系中加入适量的逆转录酶和抑制酶,以实现一步法RT-LAMP的扩增。
1.3.6 结果判定简便 LAMP 反应会形成大量白色沉淀物,可以通过肉眼直接观察,还可以利用实时浊度仪进行全程监控,通过沉淀产生的时间和产生的量进行数据的量化,判断扩增的效率及效果,提高条件优化的效率,准确掌握方法的灵敏度,反应结束也不需要通过凝胶电泳进行观察,可以省去这一繁琐的过程,也避免试剂的污染[12]。
1.3.7 LAMP反应的缺点 LAMP反应至少需要涉及4条特异性引物,并且对序列的特异性要求特别高,如果设计不合理,可能会导致非目标扩增链的产生,严重影响到结果的判断,与此同时,LAMP 实验过程容易污染,则可能难以检测并且不能检测到靶基因的序列。另外,引物的长度也是LAMP 反应的一个关键点,所以在LAMP 引物设计过程中引物的长度最好在300 bp以内[13]。
1.4 LAMP的产物检测
1.4.1 直接法 在LAMP反应期间、扩增过程中会产生白色沉淀物焦磷酸镁,如果该产物达到一定浓度,则可以直接通过肉眼进行观察,因此通过肉眼观察产物中有无沉淀的产生是最直接简单明了的检测方法[14]。
1.4.2 间接法
1)随着科技的进步,研究人员研制出了可以对LAMP反应整个过程进行实时监控的仪器——LAMP 浊度仪,可以对LAMP 反应过程中产生的白色沉淀进行实时分析,并且每一秒的浊度都是通过数据进行呈现,然后可以根据该数据绘制曲线,直观地观察到LAMP 反应的实时浊度,还可以分析反应速率,对比不同的样品[15]。
2)荧光染料可以与LAMP 反应过程中产生的双链DNA 结合,产生荧光信号,因此,将SYBR Green I 等荧光染料添加到产物中后,产物的颜色会发生变化,如果产物为阳性,则产物的颜色会变成荧光绿色,如果没有变色则说明该产物是阴性[16]。
3)通过琼脂糖凝胶电泳也可以观察到LAMP 扩增产物,电泳后,在琼脂糖凝胶上可以看到清晰的梯形带,便于观察。通过凝胶电泳观测,电泳图如果产生了梯形条带则证明产物是阳性,反之则是阴性[17-18]。
2 LAMP技术在植物病毒检测中的应用
2.1 植物DNA病毒的检测
植物DNA 病毒种类相对较少,目前应用LAMP 技术检测植物DNA 病毒的研究也相对较少。其中较为典型的植物DNA 病毒有花椰菜花叶病毒,其具有重要经济价值和生物学意义,其在35S 启动子区域含有3个转录因子专一的结合位点[19-20]。
FUKUTA 等[21]建立的基于CaMV35S启动子的LAMP 检测方法,可检测出转基因大豆及其产品中含量为0.5%~5%的转基因成分。孙敏等[22]采用LAMP 方法检测花椰菜花叶病毒CaMV35S 启动子,灵敏度可达0.002%,远高于欧盟标准,且LAMP 检测法与实时荧光PCR 法的检测结果完全相同。陈金松等[23]针对玉米表达载体的花椰菜花叶病毒35S启动子(CaMV35S)的6个区域设计4 种特异引物,建立转基因玉米花椰菜花叶病毒35S 启动子环介导等温扩增技术检测方法,为检测转基因玉米花椰菜花叶病毒35S启动子提供了一种更加简便快速的方法。肖维威等[24]针对CaMV35S 启动子设计4 对特异性引物,建立的LAMP 法具有快速、简单、可视化、灵敏度高和特异性强等优点,可应用于转基因产品的初步筛选。
2.2 植物RNA病毒的检测
对于RNA 病毒的检测,科研工作者采取在LAMP 体系内加入RNA 酶抑制剂和RNA 逆转录酶,从而建立了逆转录LAMP(reverse transcription LAMP,RT-LAMP)技术,RT-LAMP 技术可省去反转录的步骤和减少在扩增核酸过程的污染几率,该方法在速度上快于RT-PCR 检测方法,灵敏度也是RT-PCR的10~100倍。
RT-LAMP 技 术 由NOTOMI 等[3]建立,但首先应用该技术检测RNA 病毒的则是FUKUTA 等人,应用该技术快速检测出了叶片、种子、根、茎中的日本红薯花叶病毒(JYMV)[25]。NIE[26]分别利用RT-LAMP技术检测了240 份样品中的植物Y 病毒属(Potato Virus Y),检出率均为97.5%。国内刘雅馨等[27]用RT-LAMP 方法对疑似感染樱桃小果病的样品进行检测,在35 个样品中检测出13 个样品感染了LChv-1,检测结果与RT-PCR 法一致。RT-LAMP 法具有特异性强、操作简单、快速等特点,适合对LChV-1样品的快速检测与鉴定。
袁英哲等[28]用RT-LAMP 方法在新疆甜瓜种子中检测出黄瓜花叶病毒(CMV)和小西葫芦黄花叶病毒(ZYMV),与常规的PCR 技术相比,灵敏度比常规RT-PCR 高10~100 倍,提高了检测的效率。LE 等[29]2 h内完成了RNA 快速提取到RT-LAMP 检测,检测出水稻条纹病毒(RSV),水稻东格鲁杆状病毒(RTBV),灵敏度比RT-PCR 高10倍。FUKUTA 等[30]建立了感染番茄的菊花斑点枯萎病毒RT-LAMP 检测体系,灵敏度是RT-PCR 的100 倍,整个扩增过程不到1 h,在扩增过程中,加入了环引物,浊度20 min 就开始增加,大大提高了反应的可视度。闻伟刚等[31]在菜豆荚斑驳病毒(BPMV)RT-LAMP 体系中加入了2 条环引物,灵敏度是RT-PCR 的1 000 倍,从核酸的提取到结果观察只需要2~2.5 h,该研究说明环引物可以大幅提高反应速度和效率。
除上述病毒外,吴凡等[32]建立了桑脉带相关病毒的RT-LAMP 检测体系;邹佳伶等[33]建立了猕猴桃褪绿环斑病毒RT-LAMP 检测体系;KUAN 等[34]建立了南瓜曲叶病毒(SLCV)LAMP 快速检测体系;康明蛟等[35-36]建立了植物卷叶病毒RT- LAMP和豇豆重花叶病毒(CPSMV)的RT-LAMP 检测体系;高彦萍等[37]对植物卷叶病毒(PLRV)RT-LAMP 的方法进行了优化,优化后的RT-LAMP 检测结果与RT-PCR一致。
2.3 植物类病毒的检测
类病毒是目前为止发现的侵染植物的最小病原物,类病毒不编码任何蛋白,完全依靠寄主植物进行复制,在复制过程中引起病症,并且症状与病毒引起的病症极为相似,很难区分,侵染过程不显性,造成检测鉴定较为困难[2]。由于类病毒不产生蛋白质,传统的血清学方法不能满足检测需求,而LAMP方法的出现为类病毒的检测提供了新的思路,该方法可以满足类病毒检测的特殊性,实现类病毒的高特异性和灵敏检测。比较有代表性的类病毒是植物纺锤块茎类病毒(PSTVd),大多数植物感染该病毒都不显症状,并且潜育期很长,前期无法判断是否感染了该病毒,较难检测。TSUTSUMI等[38]利用RT-LAMP方法在番茄的叶片、块茎、种子内检测出PSTVd,灵敏度是RT-PCR的10倍,所需的时间是RT-PCR的一半。另外,果树类病毒检测中LAMP技术也有应用,桃潜隐花叶类病毒(PLMVd)是危害桃的病原之一,不仅影响水果的品质和口感,还影响果树的长势,引起倒伏等症状,对次年桃树的生长发育产生严重影响,因此,希腊学者BOUBOURAKAS等[39]建立了PLMVd的RT-LAMP检测体系,32 min即可在桃样品中检测出该类病毒,与RT-PCR的180 min相比,具有高效、快速特点,此外,该体系还能够在其他果树样品中检测到该类病毒。国内辛言言等[40]建立了苹果锈果类病(ASSVd)的RT-LAMP 检测方法,具有灵敏度高、特异性强和检测时间短的特点,可用于现场ASSVd的快速检测。
3 展望
RT-LAMP 检测技术有假阳性的缺陷,所以在体系建立过程中最好采用浊度仪实时检测浊度,避免产物检测的污染,同时通过设置空白对照的方式以确定没有产生假阳性,并且通过重复性试验结果可以判断,RT-LAMP 不但具有重复性的特征,在重复的过程中不产生假阳性。在实际操作过程中,必须在超净工作台中进行RT-LAMP 体系的建立,RT-LAMP的产物必须及时丢弃,保证样品不被污染[41]。
在LAMP 检测过程中,可以与免疫磁珠捕获结合进行分子检测,该方法可以大大缩短时间,实现互补优势,更易于操作且经济;并且可以通过在引物对里添加环引物的方式提高RT-LAMP的反应速率[42]。
LAMP 技术虽因建立时间较短,还存在诸多问题,但其在大多数植物病毒检测方面表现出特异性强、灵敏性高、产物检测方便等优点,使其在植物病毒快速检测研究中应用价值越来越明显,目前,该技术在植物病原、医学病原、食品检测等方面均有应用且效果良好。相信随着该技术的不断完善,该方法作为分子生物的一种快速检测技术必将为及时控制重大植物病害的发生和流行、灾变预警、分子病理学研究等提供技术支撑。
