猪CYP11A1基因编码区扩增及核心启动子区的鉴定与分析
2022-08-11曾强关钦泽王思琪李齐发杜星
曾强,关钦泽,王思琪,李齐发,杜星
(南京农业大学动物科技学院,江苏 南京 210095)
细胞色素450家族(cytochrome P450 family,又称CYP450 family)是由一类能发生自氧化的富含亚铁血红素蛋白组成的庞大家族,因该家族成员在450 nm激发波长照射下具有特定的吸收峰而得名[1]。其中,胆固醇侧链裂解酶(cholesterol side-chain cleavage enzyme)作为其中一个重要的亚家族得到了广泛关注[2]。经鉴定该亚家族中存在多个成员,包括CYP11A1、CYP11B1、CYP17B1、CYP19A1以及CYP21A1等[3]。该亚家族成员广泛参与调控哺乳动物体内众多关键的生理过程,包括能量代谢、免疫调节、应激适应、稳态平衡、性别分化以及性腺形成与性器官成熟等[4]。其中,细胞色素P450侧链胆固醇单加氧酶(CYP11A1)作为类固醇激素合成的第一步关键作用酶得到了广泛关注[5]。细胞定位分析发现CYP11A1蛋白贯穿于线粒体内膜上,其分子功能主要是催化胆固醇与孕烯醇酮(大多数类固醇激素前体)发生侧链裂解反应,进而促进孕烯醇酮及其下游类固醇激素的生物学合成[6]。组织表达谱分析也证实CYP11A1基因主要在哺乳动物的肾上腺、睾丸、卵巢以及子宫等类固醇激素分泌旺盛的组织高表达[7]。
21世纪初对雌性哺乳动物卵巢组织中CYP11A1基因的研究多见于卵泡膜细胞中[8-9]。随着对卵巢组织中雌二醇合成过程的深刻解析,近年来的相关研究表明雌二醇的合成依赖“两细胞学说”,即依赖卵泡膜细胞(thecal cell)与颗粒细胞(granulosa cell)。该学说证实CYP11A1基因在上述2种细胞中均高表达,并且其编码蛋白胆固醇侧链裂解酶(P450scc)可将胆固醇转化为孕烯醇酮,这是雌二醇合成的第一步关键限速步骤,该过程同时发生在2种细胞中[10];另外,依赖最后一步关键限速酶(P450arom)可将雄激素转化为雌二醇,但该过程仅发生在颗粒细胞中。因此,近年来在卵巢组织中研究雌二醇合成与分泌过程多见于颗粒细胞中[11-12]。由此,本研究选择在颗粒细胞中对CYP11A1基因进行相关试验。
自发现至今,CYP11A1基因在生物学领域中的研究主要集中在雌性哺乳动物卵巢组织发育、功能发挥以及生殖疾病等方面[13-14]。对CYP11A1编码基因的研究却鲜有报道,同时其表达调控机制尚不完全清楚。目前对该基因的探究(表达调控与生物学功能方面)主要集中在人[15]与小鼠[16]上,而在猪等家畜动物中的研究较少,其关键的理化性质与表达调控机制尚未见报道。因此,本研究以猪CYP11A1基因为研究对象,通过基因克隆测序获得其编码区全长序列并对其序列特征进行分析;鉴定猪CYP11A1基因的核心启动子区并在猪卵巢颗粒细胞中分析转录因子NR2C1对猪CYP11A1基因转录活性与表达水平的影响,为进一步探究CYP11A1基因转录调控机制以及类固醇激素合成通路的调控模式提供参考。
1 材料与方法
1.1 试验动物
随机选取180日龄健康的杜长大三元杂交母猪(南京竹顺生物有限公司),屠宰后采集双侧卵巢,立即置37 ℃生理盐水中并于2 h内带回实验室,用于猪卵巢颗粒细胞体外培养与卵巢组织总RNA的提取。
1.2 猪卵巢颗粒细胞的分离与体外培养
利用预热的75%乙醇和生理盐水将采集的新鲜猪卵巢反复轻柔冲洗数次,以彻底去除其表面的血渍及可能残留的污染源。利用10 mL注射器抽取直径3~5 mm健康卵泡的卵泡液,1 200 r·min-1离心5 min,吸弃上层浑浊卵泡液,再利用37 ℃磷酸盐缓冲液(PBS)重悬并轻柔吹打清洗细胞2次。将充分重悬的颗粒细胞以合适的密度接种在含有适量培养基的细胞培养板中,置于37 ℃湿度培养箱中培养。培养基成分:DMEM/F12基础培养基、15%胎牛血清以及1%青/链霉素。静置36 h待细胞牢固贴壁后,利用37 ℃PBS清洗细胞以去除非贴壁细胞与死亡细胞,用于后续试验。
1.3 细胞总RNA的提取及反转录(RT)
采用Trizol试剂提取体外培养的猪卵巢颗粒细胞的总RNA,再利用氯仿-异丙醇法对颗粒细胞总RNA进行纯化,纯化后的RNA于-80 ℃长期保存。利用PrimeScriptTM反转录试剂盒(南京诺唯赞公司)制备cDNA。具体过程如下:吸取500 ng细胞总RNA,加入2 μL 4×gDNA weeper MIX,混合均匀后42 ℃反应2 min,用于去除残留的DNA,随后在上述反应体系中加入2 μL 5×HiScript Ⅲ qRT Super Mix,混合均匀后进行反转录(RT)。RT反应条件:37 ℃ 15 min,85 ℃ 5 s。最终利用DEPC水将获得的cDNA样品稀释2~3倍后于-80 ℃保存。
1.4 引物设计与PCR扩增和测序
通过NCBI上GenBank数据库获得猪CYP11A1基因编码区序列(NM_214427.1),利用Primer Premier 5.0软件设计4对相应的扩增引物。针对猪CYP11A1基因的5′调控区序列设计5对引物,用于构建缺失表达载体。根据猪CYP11A1、NR2C1(XM_013998075.2)以及GAPDH(NM_001206359.1)基因编码区序列分别设计定量引物并交上海生工生物工程股份有限公司合成。引物详细信息见表1。
通过PCR扩增获得相应的序列。20 μL PCR反应体系:2×VazymeLAmp®Master Mix 10 μL,上游引物1 μL,下游引物1 μL,cDNA模板1 μL,ddH2O 7 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 15 s,50~60 ℃ 15 s,72 ℃ 1 min·kb-1(35个循环);72 ℃ 5 min;4 ℃保存。扩增产物使用15 g·L-1琼脂糖凝胶电泳进行分离检测,利用凝胶成像系统(美国BIORAD公司)获取高分辨率图像。对清晰、单一的目的条带切胶后,送南京擎科公司测序,再用DNAMAN v6.0和Chromas Pro软件进行分析。

表1 本试验涉及的引物信息Table 1 Primer information involved in this experiment
1.5 载体构建与荧光素酶活性试验
为了构建缺失表达载体,利用P5—P9引物扩增的产物以及pGL3-Basic线性载体用限制性内切酶KpnⅠ与XhoⅠ进行双酶切,经T4连接酶连接后转化至感受态DH5α中,随后将单克隆菌落进行平板划线扩大培养,最终获得相应的阳性重组质粒,并将其命名为pCYP11A1;猪NR2C1基因的真核生物表达载体pcDNA3.1-NR2C1来源于本课题组前期构建。
荧光素酶活性试验:在猪卵巢颗粒细胞中完成。转染24 h后,收集细胞并用荧光素酶活性检测试剂盒(美国Promega公司)检测样品中的萤火虫荧光与海肾荧光活性。荧光相对活性为萤火虫荧光与海肾荧光的比值。每组设立3个独立重复样本。
1.6 RT-qPCR检测基因的表达水平
转染24 h后,收集体外培养的猪卵巢颗粒细胞,按上述方法提取细胞总RNA后,反转录成cDNA。以cDNA为模板,用AceQ®qPCR SYBR Green Master Mix试剂盒(南京诺唯赞公司)对NR2C1和CYP11A1基因mRNA水平进行定量分析。所用引物序列见表1。以GAPDH作为内参基因。每组设立3个重复样本,采用2-ΔΔCT法计算相对表达量。
1.7 Western blot检测蛋白的表达水平
体外培养的猪卵巢颗粒细胞转染48 h后,使用预冷的RIPA细胞裂解缓冲液裂解细胞,4 ℃、12 000 r·min-1离心3 min,收集上清液即为细胞总蛋白裂解物。采用BCA法测定每个蛋白质样品的浓度,然后稀释成同一浓度后于-20 ℃保存。利用Western blot对CYP11A1蛋白表达水平进行检测。具体操作参见文献[17]。本试验采用0.25%牛血清白蛋白(BSA)溶液稀释抗体。试验所用一抗如下:兔NR2C1抗体(1∶1 000,Abconal)、兔CYP11A1抗体(1∶1 000,Sangon Biotech)、鼠GAPDH抗体(1∶1 000,Sangon Biotech)。二抗有辣根过氧化物酶标记的小鼠抗兔lgG抗体(1∶1 000,Sangon Biotech)以及山羊抗小鼠lgG抗体(1∶1 000,Sangon Biotech)。
1.8 染色质免疫沉淀(ChIP)检测转录因子NR5A1与CYP11A1基因启动子区的结合
ChIP试验具体步骤参照文献[18]。用1%甲醛溶液固定颗粒细胞10 min,加入甘氨酸终止交联。用超声波破碎仪将交联染色质切割成500 bp左右的片段,使用5 μg兔NR2C1抗体(Abconal)在猪卵巢颗粒细胞中分离CYP11A1-DNA复合物,用酚氯仿提取纯化目的蛋白上的DNA,通过PCR分析获取DNA片段富集情况。以辣根过氧化物酶标记的小鼠抗兔lgG抗体作为阴性对照,未进行处理的染色质作为总样本对照。ChIP试验所用引物信息见表1。
1.9 生物信息学分析
利用BioXM 2.6和DNAMAN v6.0软件对猪CYP11A1基因编码区核苷酸序列进行分析。利用BDGP数据库(https://fruitfly.org/seqtools/promoter.html)和Promoter 2.0 Prediction Server在线软件(http://www.cbs.dtu.dk/services/Promoter/)对猪CYP11A1基因的潜在核心启动子区进行初步预测。利用EMBOSS Cpgplot与MethPrimer在线分析系统对猪CYP11A1基因5′调控区潜在的CpG岛进行预测。利用JASPAR在线数据库(http://jaspar.genereg.net/)分析猪CYP11A1基因核心启动子区潜在的转录因子结合位点。
1.10 数据分析
采用GraphPad v8.0软件与IBM SPSS 20.0软件对数据进行方差分析,然后利用双尾t检验分析2组之间的差异显著性。
2 结果与分析
2.1 猪CYP11A1基因编码区序列扩增
利用引物P1—P4对猪CYP11A1基因编码区序列进行PCR扩增(图1-A),扩增产物经15 g·L-1琼脂糖凝胶电泳检测。电泳结果表明:在相应的退火温度下均能得到单一、清晰、明亮且与设计目的长度一致的特异性扩增条带(图1-B)。通过克隆测序证实,利用P1—P4引物对的特异性扩增片段长度依次为492、519、463和480 bp,与预期目的片段长度一致。

图1 猪CYP11A1基因编码区PCR扩增产物Fig.1 The PCR amplified product of the coding region of the pig CYP11A1 gene A.CYP11A1编码区序列扩增示意图;B.P1—P4引物对的扩增产物(M:2 000 bp标准品)。A.Schematic diagram of amplification of CYP11A1 coding region sequence;B.P1-P4 amplification product(M:2 000 bp marker).
2.2 猪CYP11A1基因编码区核苷酸序列特征分析
PCR产物经克隆、测序以及序列拼接后,获得猪CYP11A1基因编码区全序列,序列长度为1 563 bp(图2-A),与猪基因组序列信息比对后发现猪CYP11A1基因由9个外显子与8个内含子组成(图2-B)。采用BioEdit 7.0软件对猪CYP11A1基因核苷酸序列的碱基组成进行分析,发现猪CYP11A1基因核苷酸序列中A、T、C、G碱基数分别为378、348、435、402个,分析碱基含量发现嘌呤碱基(A+G)含量为49.9%,嘧啶含量(C+T)为50.1%,表明A+G含量与C+T含量基本相当(图2-C)。通过BLAST对比分析猪CYP11A1基因编码区序列与人(NM_000781.3)、牛(NM_176644.2)、绵羊(NM_001093789.1)、马(NM_001082521.1)、兔(XM_008253734.2)以及黑猩猩(NM_001280408.1)等哺乳动物的相似性分别为84.16%、87.84%、87.40%、84.77%、78.16%、83.78%;而与鸡(NM_001001756.1)和斑马鱼(NM_152953.2)等非哺乳动物的相似性分别为58.85%和48.41%(图2-D),表明CYP11A1基因在哺乳动物中具有较高的序列保守性。进一步分析序列进化保守性发现CYP11A1基因在猪、牛和绵羊等哺乳动物中具有较高程度的进化保守性(图2-E)。
2.3 猪CYP11A1基因核心启动子区鉴定
为了鉴定猪CYP11A1基因的核心启动子区,根据猪CYP11A1基因5′调控区序列设计了5对特异性引物P5—P9,能在最适退火温度下得到清晰、明亮且符合预期大小的电泳条带(图3-A)。将目的条带进行切胶回收、纯化、克隆测序与序列拼接最终获得猪CYP11A1基因 5′调控区序列,并成功构建相应的缺失表达荧光报告载体(图3-B)。分别将各个重组质粒瞬时转染体外培养的猪卵巢颗粒细胞,荧光素酶活性试验结果显示pCYP11A1-140与pCYP11A1-430之间的荧光活性呈现显著差异,即pCYP11A1-430的荧光活性极显著高于pCYP11A1-140(P<0.01,图3-C),表明猪CYP11A1基因核心启动子区位于-398~-108 bp(转录起始位点作为+1)。
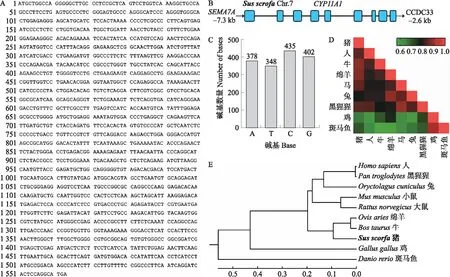
图2 猪CYP11A1基因编码区核苷酸序列特征分析Fig.2 Characteristic analysis of the nucleotide sequence of the coding region of pig CYP11A1 gene A.编码区核苷酸序列;B.序列组成;C.序列碱基含量;D.序列同源性分析;E.进化保守性分析。A.Coding region nucleotide sequence;B.Sequence composition of coding region;C.Sequence composition;D.Sequence homology analysis;E.Evolutionary conservation analysis.

图3 猪CYP11A1基因核心启动子区鉴定Fig.3 Identification of the core promoter region in pig CYP11A1 geneA.P5—P9引物产物(M:2 000 bp标准品);B.构建载体的示意图;C.荧光素酶活性试验。A.P5-P9 amplification product(M:2 000 bp marker);B.Schematic diagram of vector construction;C.Luciferase activity test.
2.4 猪CYP11A1基因核心启动子区序列特征分析
序列分析发现猪CYP11A1基因核心启动子区由291个碱基组成(图4-A),其中A碱基61个(21%)、T碱基89个(30.6%)、C碱基63个(21.6%)、G碱基78个(26.8%)。嘌呤碱基(A+G)含量为47.8%,嘧啶含量(C+T)为52.2%,表明A+G含量略低于C+T含量(图4-B)。利用JASPAR在线数据库分析发现猪CYP11A1基因核心启动子区包含多个潜在的转录因子结合位点,例如核受体亚家族2C组成员1(nuclear receptor subfamily 2,group C,member 1,NR2C1)、SRY-盒转录因子10(SRY-box transcription factor 10,SOX10)、核因子Ⅸ(nuclear factor Ⅸ,NFIX)和E74样ETS转录因子5(E74 like ETS transcription factor 5,ELF5)等(图4-C)。通过在线软件EMBOSS分析发现,在猪CYP11A1基因启动子区共鉴定15个潜在的甲基化位点(CG位点),其中4个位点定位于近端启动子区(0~-400 bp)、8个位于中远端启动子区(-800~-1 200 bp)、3个位于远端启动子区(-1 200~-1 600 bp)(图4-D);在线软件MethPrimer分析发现在猪CYP11A1基因近端、中远端和远端启动子区有3个潜在的高甲基化区域,跟甲基化位点(CG位点)的位置是对应的(图4-E),但并未预测到相应的CpG岛。提示猪CYP11A1基因的转录可能在一定程度上受DNA甲基化的影响。

图4 猪CYP11A1基因核心启动子区序列特征分析Fig.4 Sequence analysis of porcine CYP11A1 gene core promoter region 1)A.核心启动子区碱基组成Base composition and ratio of core promoter region;B.核心启动子区碱基数及组成Base number and composition of core promoter region;C.潜在转录因子生物信息学分析Bioinformatics analysis of potential transcription factors;D.利用EMBOSS Cpgplot分析CG位点Analysis of CG sites by EMBOSS Cpgplot;E.利用MethPrimer分析甲基化区域Analysis of methylated regions by MethPrimer。2)NR2C1:核受体亚家族2C组成员1 Nuclear receptor subfamily 2,group C,member 1;MAZ:MYC相关锌指蛋白 MYC associated zinc finger protein;ELF5:E74样ETS 转录因子5 E74 like ETS transcription factor 5;NR2F1:核受体亚家族2F组成员1 Nuclear receptor subfamily 2 group F member 1;ZNF263:锌指蛋白263 Zinc finger protein 263;VDR:维生素D受体 Vitamin D receptor;ZBTB6:锌指和BTB结构域6 Zinc finger and BTB domain containing 6;NFATC2:活化T细胞的核因子2 Nuclear factor of activated T cells 2;ZBTB12:锌指和BTB结构域12 Zinc finger and BTB domain containing 12;NFIX:核因子IX Nuclear factor IX;SOX10:SRY-box转录因子10 SRY-box transcription factor 10;FOXC1:叉头盒C1 Forkhead box C1;FOXL1:叉头盒L1 Forkhead box C1.
2.5 转录因子NR2C1对猪卵泡颗粒细胞中CYP11A1基因转录的影响
根据图4-C的分析结果可知,转录因子NR2C1与猪CYP11A1基因的核心启动子区存在较强的互作结合能力(预测分值为11.039 00),因此选择转录因子NR2C1进行后续研究。首先将重组质粒pcDNA3.1-NR2C1瞬时转染体外培养的猪卵巢颗粒细胞,分别通过RT-qPCR和Western blot方法检测NR2C1的mRNA与蛋白表达水平。结果发现,转染pcDNA3.1-NR2C1能够极显著上调猪卵巢颗粒细胞中NR2C1基因mRNA(图5-A,P<0.01)与蛋白表达水平(图5-B,P<0.05),表明猪NR2C1基因真核生物表达载体构建成功。根据JASPAR数据库信息,CYP11A1核心启动子区有1个潜在的转录因子NR2C1的结合位点。RT-qPCR和Western blot结果证实NR2C1过表达可极显著促进猪卵巢颗粒细胞中CYP11A1基因mRNA(图5-C,P<0.01)与蛋白表达水平(图5-D,P<0.01)。另外,荧光素酶活性试验证实,NR2C1过表达能够极显著促进CYP11A1基因核心启动子区转录活性(图5-E,P<0.01)。通过ChIP试验证实在猪卵巢颗粒细胞中,转录因子NR2C1能够与CYP11A1基因核心启动子区特异性结合(图5-F)。上述结果表明在猪卵巢颗粒细胞中,转录因子NR2C1能够通过上调CYP11A1基因核心启动子区活性来促进其转录。

图5 转录因子NR2C1对猪卵巢颗粒细胞中CYP11A1基因和蛋白表达的影响Fig.5 Effects of transcription factor NR2C1 on gene and protein expression of CYP11A1 in porcine ovarian granulosa cells A.RT-qPCR检测NR2C1 mRNA的表达水平;B.Western blot检测NR2C1蛋白的表达水平;C.过表达NR2C1对CYP11A1 mRNA水平的影响;D.过表达NR2C1对CYP11A1蛋白水平的影响;E.过表达NR2C1对CYP11A1基因核心启动子活性的影响;F.ChIP试验鉴定NR2C1与CYP11A1核心启动子的结合特性(M:2 000 bp DNA标准品;Blank:空白对照;Input:阳性对照)。A.The mRNA levels of NR2C1 are measured by RT-qPCR;B.The protein levels of NR2C1 are detected by Western blot;C.The effect of NR2C1 overexpression on CYP11A1 mRNA expression level;D.The effect of NR2C1 overexpression on the protein expression level of CYP11A1;E.The effect of NR2C1 overexpression on the activity of CYP11A1 gene core promoter;F.ChIP assay was performed to analyze the enrichment of NR2C1 on the core promoter of CYP11A1(M indicates 2 000 bp DNA marker;Blank indicates blank control;Input indicates positive control).
3 讨论
自20世纪80年代CYP11A1基因首次在人体组织中发现以来,CYP11A1基因与其编码蛋白相继在鼠[19]、牛[20]、绵羊[21]等多个哺乳动物中成功鉴定,然而目前关于猪CYP11A1基因及其编码蛋白结构与功能的研究却鲜有报道。本研究通过克隆扩增与测序技术获得了猪CYP11A1基因编码区全序列,再通过对CYP11A1基因编码区序列同源性比较发现其核苷酸序列与其他哺乳动物的一致性均高于84%,表明CYP11A1基因在哺乳动物进化过程中具有高度保守性,这也从另一方面说明CYP11A1基因在哺乳动物中所发挥的相关生物学功能是稳定和必不可少的。在蛋白质构成方面,CYP11A1蛋白与其他糖蛋白和具有潜伏肽的蛋白不同,其仅由1个相对分子质量约为50×103的蛋白质肽链构成。有研究表明CYP11A1蛋白在正常状态下并不存在相关蛋白修饰,这对其功能的完整性和敏感性至关重要[22]。研究表明MTS突变可导致CYP11A1发生折叠错误并引起定位改变,进而在丝氨酸/苏氨酸蛋白激酶(serine/threonine-protein kinase pim-1,PIM1)的作用下降解[23];另外,F-G loop作为CYP11A1蛋白特异性功能结构域在识别、结合及催化线粒体内类固醇的过程中起到至关重要的作用[24]。研究证实CYP11A1蛋白存在的一系列功能结构域与其亚细胞定位、空间结构以及功能完整性相关。因此,我们的后续研究将会着重探讨猪CYP11A1蛋白结构域对CYP11A1蛋白功能的影响以及对母猪繁殖性状调控的分子机制。
近年来,研究发现CYP11A1作为类固醇激素的第一步合成酶,其表达与活性的异常可导致多种疾病的发生,主要包括幼儿与老人肾功能不全、雌性繁殖障碍、免疫障碍以及癌症等[25-26]。然而,目前仅在人和小鼠中对CYP11A1基因表达调控机制进行了探究,而对猪等大型家畜CYP11A1基因的表达调控机制少有报道[27]。因此,本研究首先通过构建缺失表达载体与荧光素酶活性试验鉴定了猪CYP11A1基因核心启动子位于近端调控区,而这与前人对人和小鼠等哺乳动物的研究一致,证实哺乳动物CYP11A1基因的核心启动子位于近端500 bp范围内[28]。另外,转录调控是基因表达的重要环节,转录启动是众多顺式作用元件与反式作用因子相互作用的结果[29]。前人研究证实人与小鼠CYP11A1近端核心启动子区主要受到剪接因子1(splicing factor 1,SF-1)[30]、特异性蛋白1(specificity protein 1,SP1)[31]以及神经纤维蛋白1(neurofibromin 1,NF-1)[32]等转录因子的调控,而本研究利用生物信息学分析发现,除了上述几个已确定的转录因子外,猪CYP11A1基因核心启动子区还包含其他多种转录因子的结合元件,例如核受体亚家族2C组成员1(nuclear receptor subfamily 2,group C,member 1,NR2C1)、SRY-box转录因子10(SRY-box transcription factor 10,SOX10)、核因子Ⅸ(nuclear factor Ⅸ,NFIX)和E74样ETS转录因子5(E74 like ETS transcription factor 5,ELF5)等,以上结果提示这些转录因子可能在猪CYP11A1基因转录启动过程中发挥重要作用。本研究证实NR2C1过表达可显著促进CYP11A1基因核心启动子区活性,同时显著上调体外培养的猪卵巢颗粒细胞中CYP11A1基因的转录水平,为解析猪CYP11A1基因转录调控机制以及拓展类固醇合成的调控网络提供了一定的参考。另外,DNA甲基化与组蛋白修饰是哺乳动物基因表达过程中最为常见的表观遗传修饰,它们可以诱导基因在生物体正常生理或病理状态下的表达与沉默[33]。DNA甲基化与组蛋白修饰相关,这些表观遗传修饰的相互作用对于通过改变染色质构象调控基因组功能至关重要[34]。本研究通过生物信息学软件分析发现猪CYP11A1基因启动子区存在15个潜在的甲基化位点(CG位点),其中有4个位于近端核心启动子区,而这与前人的研究结果基本一致[35]。但与其他哺乳动物研究不同的是,我们在猪CYP11A1基因的中端与远端启动子上分别发现了多个潜在的甲基化位点,推测猪CYP11A1基因转录可能在一定程度上受到DNA甲基化的影响,但更深层次的机制仍需要进一步探究。
